ПЯТНИЦА 04.12.20 г. 206,308, 201
ГРУППА 206
Тема:Фенол. Физические и химические свойства фенола. Взаимное влияние атомов в молекуле фенола: взаимодействие с гидроксидом натрия и азотной кислотой. Применение фенола на основе свойств.
Альдегиды. Понятие об альдегидах
1. Фенолы - производные ароматических углеводородов, в молекулах которых гидроксильная группа (- ОН) непосредственно связана с атомами углерода в бензольном кольце.
2. Классификация фенолов
Различают одно-, двух-, трехатомные фенолы в зависимости от количества ОН-групп в молекуле:
В соответствии с количеством конденсированных ароматических циклов в молекуле различают сами фенолы (одно ароматическое ядро – производные бензола), нафтолы (2 конденсированных ядра – производные нафталина), антранолы (3 конденсированных ядра – производные антрацена) и фенантролы:
3. Изомерия и номенклатура фенолов
Возможны 2 типа изомерии:
- изомерия положения заместителей в бензольном кольце
- изомерия боковой цепи (строения алкильного радикала и числа радикалов)
Для фенолов широко используют тривиальные названия, сложившиеся исторически. В названиях замещенных моноядерных фенолов используются также приставки орто-, мета- и пара -, употребляемые в номенклатуре ароматических соединений. Для более сложных соединений нумеруют атомы, входящие в состав ароматических циклов и с помощью цифровых индексов указывают положение заместителей
4. Строение молекулы
Фенильная группа C6H5 – и гидроксил –ОН взаимно влияют друг на друга
- неподеленная электронная пара атома кислорода притягивается 6-ти электронным облаком бензольного кольца, из – за чего связь О–Н еще сильнее поляризуется. Фенол - более сильная кислота, чем вода и спирты.
- В бензольном кольце нарушается симметричность электронного облака, электронная плотность повышается в положении 2, 4, 6. Это делает более реакционноспособными связи С-Н в положениях 2, 4, 6. и – связи бензольного кольца.
5. Физические свойства
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления.
Фенол C6H5OH (карболовая кислота) — бесцветное кристаллическое вещество на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком
6. Токсические свойства
Фенол ядовит. Вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу. Попадая в организм, Фенол очень быстро всасывается даже через неповрежденные участки кожи и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюхой, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Зачастую фенол является причиной онкозаболеваний.
7. Применение фенолов
1. Производство синтетических смол, пластмасс, полиамидов
2. Лекарственных препаратов
3. Красителей
4. Поверхностно-активных веществ
5. Антиоксидантов
6. Антисептиков
7. Взрывчатых веществ
8-
9. Химические свойства фенола (карболовой кислоты)
I. Свойства гидроксильной группы
Кислотные свойства – выражены ярче, чем у предельных спиртов (окраску индикаторов не меняют):
- С активными металлами-
2C6H5-OH + 2Na → 2C6H5-ONa + H2
фенолят натрия
- Со щелочами -
C6H5-OH + NaOH (водн. р-р) ↔ C6H5-ONa + H2O
! Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой –
C6H5-ONa + H2O + СO2 → C6H5-OH + NaHCO3
По кислотным свойствам фенол превосходит этанол в 106 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2-, Br-)
C6H5-OH< п-нитрофенол < 2,4,6-тринитрофенол |
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной
II. Свойства бензольного кольца
1). Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы (см. выше), но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях (+М-эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
- Нитрование. Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов:
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
- Галогенирование. Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол):
- Конденсация с альдегидами. Например:
2). Гидрирование фенола
C6H5-OH + 3H2 Ni, 170ºC → C6H11 – OH циклогексиловый спирт (циклогексанол)
III. Качественная реакция - обнаружение фенола
6C6H5-OH + FeCl3 → [Fe(C6H5-OH)3](C6H5O)3 + 3HCl
FeCl3 - светло-жёлтый раствор
[Fe(C6H5-OH)3](C6H5O)3 - фиолетовый раствор
Тема: Альдегиды - органические вещества
Альдегиды - органические вещества, молекулы которых содержат карбонильную группу —![]() —, связанную с атомом водорода и углеводородным радикалом.
—, связанную с атомом водорода и углеводородным радикалом.
Общая формула альдегидов ![]() или R—CHO. Функциональная группа альдегидов (—CHO) называется альдегидной группой.
или R—CHO. Функциональная группа альдегидов (—CHO) называется альдегидной группой.
Кетоны - органические вещества, молекулы которых содержат карбонильную группу —![]() —, связанную с двумя углеводородными радикалами.
—, связанную с двумя углеводородными радикалами.
Общая формула кетонов ![]() или R—CO—R'.
или R—CO—R'.
Альдегиды и кетоны называются карбонильными соединениями, их общая формула - CnH2nO.
Изомеры и гомологи
| г о м о л о г и | HCHO метаналь (формальдегид, муравьиный альдегид) | ||
| CH3CHO этаналь (ацетальдегид, уксусный альдегид) | |||
| CH3CH2CHO пропаналь (пропионовый альдегид) | CH3—CO—CH3 пропанон (ацетон) | ||
| CH3CH2CH2CHO бутаналь (масляный альдегид) | 2-метилпропаналь | бутанон (метилэтилкетон) | |
| и з о м е р ы | |||
В молекулах альдегидов, а тем более кетонов, в отличие от спиртов нет атомов водорода со значительным положительным частичным зарядом, поэтому между молекулами как альдегидов, так и кетонов нет водородных связей.
Химические свойства
Химические свойства альдегидов и кетонов в значительной степени обусловлены наличием в их молекулах сильно полярной карбонильной группы (связь ![]() поляризована в сторону атома кислорода). Чем больше частичный заряд (
поляризована в сторону атома кислорода). Чем больше частичный заряд (![]() +) на атоме углерода этой группы, тем выше активность соединения.
+) на атоме углерода этой группы, тем выше активность соединения.
- Горение:2CH3CHO + 5O2
 4CO2 + 4H2O
4CO2 + 4H2O
2CH3COCH3 + 9O2 6CO2 + 6H2O
6CO2 + 6H2O - Присоединение (по двойной связи карбонильной группы).
В ряду HCHO RCHO
RCHO  RCOR' склонность к реакциям присоединения уменьшается. Это связано с наличием и числом углеводородных радикалов, связанных с атомом углерода карбонильной группы.
RCOR' склонность к реакциям присоединения уменьшается. Это связано с наличием и числом углеводородных радикалов, связанных с атомом углерода карбонильной группы.
а) Гидрирование (восстановление водородом):HCHO + H2 CH3OH
CH3OH
CH3—CO—CH3 + H2 CH3—CH(OH)—CH3
CH3—CH(OH)—CH3
Из альдегидов при этом получаются первичные спирты, а из кетонов - вторичные. - Окисление:CH3CHO + Ag2O
 2Ag
2Ag + CH3COOH (реакция "серебряного зеркала" - качественная реакция)
+ CH3COOH (реакция "серебряного зеркала" - качественная реакция)
HCHO + 2Cu(OH)2 2H2O + Cu2O
2H2O + Cu2O + HCOOH (образуется красный осадок - качественная реакция)
+ HCOOH (образуется красный осадок - качественная реакция)
Кетоны слабыми окислителями не окисляются. - Замещение атомов водорода в углеводородном радикале (замещение происходит в
 -положение, т. е. замещается атом водорода у 2-го атома углерода):
-положение, т. е. замещается атом водорода у 2-го атома углерода):3 2(  )
)1 CH3 —CH2 —CHO + Cl2  CH3—CHCl—CHO + HCl
CH3—CHCl—CHO + HClФормальдеги́д (от лат. formīca — «муравей»[4]) — органическое соединение, бесцветный газ с резким неприятным запахом, хорошо растворимый в воде, спиртах и полярных растворителях. Ирритант, контаминант, канцерогенен. В больших концентрациях ядовит.
Формальдегид — первый член гомологического ряда алифатических альдегидов, альдегид метанола и муравьиной кислоты.
Он, в основном, используется в производстве смол — бакелита, галалита (в сочетании с мочевиной, меламином и фенолом), для дубления кож, протравливания зерна. Также из него синтезируют лекарственные средства (уротропин) используют как консервант биологических препаратов (благодаря способности свертывать белок).
ГРУППА 308
Тема:Дисперсные системы. Понятие о дисперсной системе. Дисперсная фаза и дисперсионная среда. Классификация дисперсных систем. Понятие о коллоидных системах.
Дисперсные системы
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению истинных растворов и дисперсных систем: способам выражения концентрации растворов, видам дисперсных систем, их свойствам, способам коагуляции золей, строению гелей.
Глоссарий
Аэрозоль – грубодисперсная система, в которой твёрдые или жидкие частицы размером более 10-3 см равномерно распределены в газообразной среде.
Гель – полутвёрдая трёхмерная ячеистая структура, каркас которой образован коллоидными частицами, а в прослойках между частицами удерживается дисперсионная среда.
Грубодисперсная система – дисперсная система, в которой размер частиц дисперсной фазы более 10-3 см.
Дисперсионная среда – сплошная фаза, составная часть дисперсной системы, в которой равномерно распределены частицы дисперсной фазы.
Дисперсная система – гетерогенная система, состоящая, как минимум, из двух фаз, одна из которых мелко раздроблена и равномерно распределена в другой, сплошной фазе.
Дисперсная фаза – мелко раздробленные частицы, равномерно распределённые в дисперсионной среде.
Гетерогенная система – неоднородная система, в которой компоненты находятся в разных фазах и между ними существует видимая граница раздела фаз.
Гомогенная система – однородная система, все компоненты которой находятся в одной фазе, граница раздела фаз между компонентами отсутствует.
Золь (коллоидный раствор) – тонкодисперсная система, в которой твёрдые частицы дисперсной фазы размером 10-7 – 10-5 см равномерно распределены в жидкой среде.
Истинный раствор – гомогенная система, состоящая из двух или более компонентов, состав которой в определённых пределах можно изменять без нарушения однородности.
Коагуляция – процесс слипания коллоидных частиц в более крупные агрегаты.
Опалесценция – изменение окраски бесцветного коллоидного раствора с желтоватой в проходящем свете на голубую в отраженном свете.
Седиментация – процесс оседания крупных частиц дисперсной фазы.
Суспензия – грубодисперсная система, в которой твёрдые частицы размером более 10-3 см равномерно распределены в жидкой дисперсионной среде.
Фаза – часть системы, однородная по составу и свойствам, отделённая от окружающей среды видимой границей раздела.
Электрофорез – движение коллоидных частиц золя в постоянном электрическом поле к одному из электродов.
Эмульсия – грубодисперсная система, в которой одна жидкая фаза в виде отдельных мелких капель равномерно распределена в другой жидкости, при этом жидкости взаимно нерастворимы.
Эффект Тиндаля – образование светлого конуса в отраженном свете при прохождении через дисперсную систему луча света.
Истинные растворы
Истинным раствором называется гомогенная система, состоящая из нескольких компонентов, состав которой в определённых пределах можно менять без нарушения однородности.
Растворимостью называется такое количество вещества, которое можно при данной температуре растворить в 100 г растворителя. Абсолютно нерастворимых веществ в природе не существует.
Дисперсные системы
Дисперсной называется гетерогенная система, состоящая, как минимум, из двух фаз, одна из которых мелко раздроблена и равномерно распределена во второй, сплошной фазе. В отличие от истинных растворов, дисперсная система неоднородна, а между составляющими её фазами всегда существует граница раздела. Мелкораздробленная фаза называется дисперсной фазой, а сплошная фаза – дисперсионной средой. В зависимости от размера частиц дисперсной фазы различают грубодисперсные (размер частиц больше 100 нм) и тонкодисперсные (от 1 до 100 нм), или коллоидные системы. Если размер частиц дисперсной фазы становится меньше 1 нм, система перестает быть гетерогенной, образуется истинный раствор. В истинном растворе вещество раздроблено до отдельных молекул или ионов. В зависимости от агрегатного состояния дисперсной фазы и дисперсионной среды дисперсные системы разделяют на суспензии, эмульсии, пены и аэрозоли. В суспензии твёрдые частицы распределены в жидкости. Эмульсия состоит из мелких капель жидкости, равномерно распределённых в другой жидкости, причем эти жидкости взаимно нерастворимы. Пена – это мелкие пузырьки газа в жидкости. Аэрозоль представляет собой газообразную среду, в которой распылены мелкие твёрдые или жидкие частицы.
Получение и свойства коллоидных растворов
Тонкодисперсные коллоидные системы получили название «золь». Золи могут быть образованы как неорганическими веществами, так и органическими макромолекулами, размеры которых превышают 1 нм, например, белками. Приготовить золь можно смешиванием малорастворимого вещества с растворителем (раствор крахмала, яичного белка), так и с помощью химических реакций ионного обмена, гидролиза, окисления-восстановления, в которых один из продуктов реакции не растворяется в жидкости.
Золи прозрачны, как и истинные растворы. Чтобы отличить золь от истинного раствора, надо посмотреть на проходящий через раствор луч в отражённом свете. В коллоидном растворе свет рассеивается, образуя светлый конус. Это явление получило название «эффект Тиндаля» - по фамилии английского физика Джона Тиндаля, который впервые описал и объяснил это явление. С древних времён люди ценили драгоценный камень опал за игру света. Его окраска в зависимости от угла зрения изменяется с голубой на желтоватую. Опал – это затвердевший коллоидный раствор, а свойство золей изменять окраску в проходящем и отражённом свете получило название «опалесценция».
Тема: Приготовление суспензии карбоната кальция в воде.(НЕ ДЛЯ ЗАПИСИ! НАПОМИНАНИЕ: КАРБОНАТ КАЛЬЦИЯ В ДАННОМ СЛУЧАЕ- МЕЛ)
Цель: изучить способы приготовления суспензий; отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии.
Оборудование: пробирка с порошком мела, пробирка с водой.
ХОД РАБОТЫ.
Дисперсные системы – это системы, в которых мелкие частицы вещества, или дисперсная фаза, распределены в однородной среде (жидкость, газ, кристалл), или дисперсионной фазе
Суспензия относится к дисперсной системе ВЗВЕСИ, и состоит из жидкости и распределенного в ней твердого вещества с размером частиц более 100 нм. Если порошок поместить в жидкость и перемешать, то получится суспензия, а при высушивании суспензия снова превращается в порошок.
Концентрированные суспензии (пасты) могут быть получены как в результате оседания более разбавленных суспензий, так и непосредственно растиранием порошков или массивных твердых тел с жидкостями.
Последовательность выполнения работы:
1. К порошку мела в пробирке добавИМ 1-2 мл воды и энергично взболтайте.
2. Опишите наблюдаемое явление. Записи внесите в таблицу по форме:
Что делали
Что наблюдали
Вывод
3. Сформулируйте вывод
Контрольные вопросы:
1. Укажите, что в полученной вами дисперсной системе «суспензия» является дисперсионной средой, а что дисперсной фазой?
2. Разделяются ли со временем дисперсионная среда и дисперсная фаза в данной суспензии?
ГРУППА 201
Тема: Алкены. Этилен, его получение (дегидрированием этана, деполимеризацией полиэтилена). Гомологический ряд, изомерия, номенклатура алкенов.
Непредельные углеводороды
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкины, алкадиены (полиены). Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных углеводородов — алканов.
Алкены
Алкены - непредельные (ненасыщенные) ациклические алифатические углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь). Своё второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел.
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда - этилену - CH2=CH2. Общая формула их гомологического ряда - CnH2n.
Гомологический ряд алкенов | Структурные формулы | Названия, суффикс ен, илен |
C2Н4 | CH2=CH2 | этен, этилен |
C3H6 | CH2=CH-CH3 | пропен |
C4H8 | CH2=CH-CH2-CH3 | бутен-1 |
CH3-CH=CH-CH3 | бутен-2 |
Гомологи
СH2=CH2 этен
СH2=CH-CH3 пропен
СH2=CH-CH2-CH3 бутен-1
СH2=CH-CH2-CH2-СН3 пентен-1
Физические свойства алкенов
Этилен (этен) – бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, малорастворим в воде.
С2 – С4 (газы)
С5 – С17 (жидкости)
С18 – (твёрдые)
§ Алкены не растворяются в воде, растворимы в органических растворителях (бензин, бензол и др.)
§ Легче воды
§ С увеличением Mr температуры плавления и кипения увеличиваются
Строение
Этилен – простейший представитель
Молекулярная формула – С2Н4
Электронная формула | |
Структурная формула | |
Пространственное строение | В молекуле этилена подвергаются гибридизации одна s- и две p-орбитали атомов C – sp2-гибридизация: Таким образом, каждый атом C имеет по три гибридных орбитали (идут на образование трёх σ-связей) и по одной негибридной p-орбитали (идут на образование одной p-связи): |
Запомните характеристики sр2 –гибридизации
1) Плоское тригональное (треугольное) строение
2) Угол – HCH - 120°
3) Длина (-С=С-) связи – 0,134 нм
4) Связи - σ, p
5) Невозможно вращение относительно (-С=С-) связи
Изомерия
Структурная изомерия алкенов
1. Изомерия углеродного скелета (начиная с С4Н8):
2. Изомерия положения двойной связи (начиная с С4Н8):
3. Межклассовая изомерия с циклоалканами, начиная с С3Н6:
Пространственная изомерия алкенов
Вследствие жесткой закрепленности атомов С возможна цис-транс-изомерия.
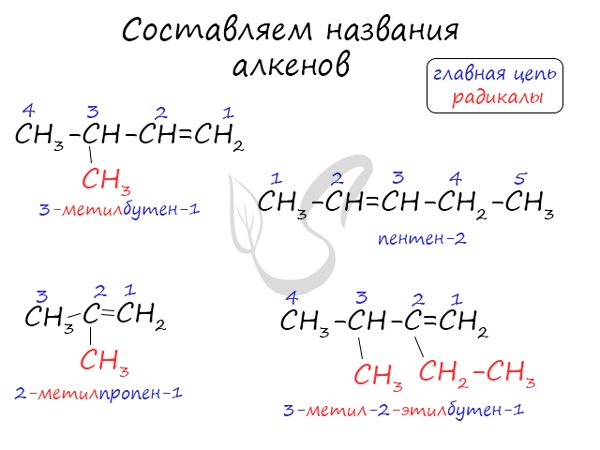
Номенклатура
Названия алкенов формируются путем добавления суффикса "ен" к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.
Образование названий алкенов по номенклатуре ИЮПАК