19/04/21г. 303, 305, 306
ГРУППА 303
ТЕМА: Химические свойства этилена: горение, качественные реакции (обесцвечивание бромной воды и раствора перманганата калия), гидратация, полимеризация.Применение этилена на основе свойств.
Алкены. Строение, номенклатура, изомерия, физические свойства
Непредельные углеводороды К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкины, алкадиены (полиены). Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных углеводородов — алканов. Алкены Алкены - непредельные (ненасыщенные) ациклические алифатические углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь). Своё второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел. Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда - этилену - CH2=CH2. Общая формула их гомологического ряда - CnH2n.
Гомологи СH2=CH2 этен СH2=CH-CH3 пропен СH2=CH-CH2-CH3 бутен-1 СH2=CH-CH2-CH2-СН3 пентен-1 Физические свойства алкенов Этилен (этен) – бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, малорастворим в воде. С2 – С4 (газы) С5 – С17 (жидкости) С18 – (твёрдые) § Алкены не растворяются в воде, растворимы в органических растворителях (бензин, бензол и др.) § Легче воды § С увеличением Mr температуры плавления и кипения увеличиваются Строение Этилен – простейший представитель Молекулярная формула – С2Н4
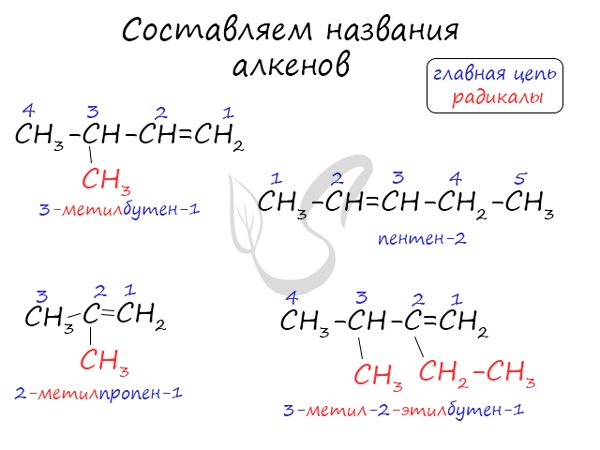
Запомните характеристики sр2 –гибридизации 1) Плоское тригональное (треугольное) строение 2) Угол – HCH - 120° 3) Длина (-С=С-) связи – 0,134 нм 4) Связи - σ, p 5) Невозможно вращение относительно (-С=С-) связи Изомерия Структурная изомерия алкенов 1. Изомерия углеродного скелета (начиная с С4Н8): 2. Изомерия положения двойной связи (начиная с С4Н8): 3. Межклассовая изомерия с циклоалканами, начиная с С3Н6: Пространственная изомерия алкенов Вследствие жесткой закрепленности атомов С возможна цис-транс-изомерия. Номенклатура Названия алкенов формируются путем добавления суффикса "ен" к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д. При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь. |
Реакции присоединения
1. Гидрирование (гидрогенизация – взаимодействие с водородом)):
CnH2n + H2 -t, Ni → CnH2n+2
2. Галогенирование (взаимодействие с галогенами):
CnH2n + Г2 → СnH2nГ2
Видео - Это качественная реакция алкенов – бромная вода Br2 (бурая жидкость) обесцвечивается
3. Гидрогалогенирование* (взаимодействие с галогенводородами):
4. Гидратация* (присоединение молекул воды):
CH2=CH2 + H2O -t, H3PO4→ CH3-CH2-OH (этанол – этиловый спирт)
5. Реакции полимеризации:
Реакции окисления
1. Горение – пламя ярко светящееся Видео
Полное сгорание – CnH2n + 3n/2O2 -t→ nCO2 + nH2O + Q
2. Каталитическое окисление
2. Окисление перманганатом калия (р. Вагнера) в нейтральной среде или слабощелочной среде** – розовый раствор марганцовки обесцвечивается, это качественная реакция алкенов. Видео
*Присоединение галогеноводородов и воды к несимметричным алкенам происходит по правилу Марковникова В.В.
Присоединение водорода происходит к наиболее гидрированному атому углерода при двойной углерод-углеродной связи.
Исключения!!!
1) Если в алкене присутствует электроноакцепторный заместитель, т.е. группа, способная оттягивать на себя электронную плотность:
F3C ← CH=CH2 + H-Br → F3C - CH2 - CH2(Br) 1,1,1- трифтор-3-бромпропан
2) Присоединение в присутствии Н2О2 (эффект Хараша) или органической перекиси (R-O-O-R ):
СH3-CH=CH2 + H-Br - Н2О2→ H3C - CH2 - CH2(Br)
** Влияние среды на характер продуктов реакций окисления
1) Окисление в кислой среде при нагревании идёт до: а) карбоновых кислот; б) кетонов (если атом углерода при двойной связи содержит два заместителя); в) углекислого газа (если двойная связь на конце молекулы, то образуется муравьиная кислота, которая легко окисляется до CO2):
2) Окисление в нейтральной или слабощелочной среде на холоде (см. выше)
Важные реакции! Обратите внимание на реакции циклоалкенов
Тренажёры ЦОР:
Химические свойства алкенов (расчетные задачи)
Уравнения реакций, характеризующие химические свойства этилена и пропилена
Реакции, иллюстрирующие генетическую связь между классами органических соединений
Получение в промышленности
1. Крекинг алканов:
CnH2n+2 -t, (400-700) → CnH2n+2 + CnH2n (алкан+алкен)
2. Дегидрирование алканов:
CnH2n+2 - t, kat-Ni или (Cr2O3) → CnH2n +H2
3. Гидрирование алкинов:
CnH2n-2 + H2 - t, kat-(Pt или Pd, Ni) → CnH2n
Получение в лаборатории
1. Дегидратация* спиртов:
Получение этилена из этилового спирта
R-CH2-CH2-OH - t>140°C, H2SO4(конц.) → R-CH=CH2 + H2O
2. Дегидрогенирование* моногалогеналканов:
R-CH2-CH2-Г + NaOH - спиртовой р-р, t→ R-CH=CH2 + NaГ +H2O (здесь R – радикал, Г – галоген)
*Правило Зайцева А. М.: отрыв атома водорода происходит от наименее гидрогенизированного атома углерода.
3. Дегалогенирование дигалогеналканов:
Применение алкенов (использованы материалы с сайта "Фоксфорд")
Алкены широко используются в полимерной промышленности, для получения спиртов и др. органических веществ. Алкены являются важнейшим химическим сырьем.
Этилен используется для производства целого ряда химических соединений: винилхлорида, стирола, этиленгликоля, этиленоксида, этаноламинов, этанола, диоксана, дихлорэтана, уксусного альдегида и уксусной кислоты. Полимеризацией этилена и его прямых производных получают полиэтилен, поливинилацетат, поливинилхлорид, каучуки и смазочные масла. Мировое производство этилена составляет порядка 100 млн тонн в год (по данным на 2005 год: 107 млн тонн).
Пропилен в промышленности применяется, в основном, для синтеза полипропилена (62 % процента всего выпускаемого объема). Также из него получают кумол, окись пропилена, акрилонитрил, изопропанол, глицерин, масляный альдегид. В настоящее время мировые мощности по выпуску пропилена составляют около 70 млн тонн в год. По прогнозам специалистов, потребность в пропилене в ближайшем будущем будет существенно превышать объемы его производства, причем, ожидается, что к 2010 году объем его мирового выпуска достигнет 90 млн тонн
Бутилены применяют для производства бутадиена, изопрена, полиизобутилена, бутилкаучука, метилэтилкетона и др.
Изобутилен — сырье для получения бутилкаучука, изопрена, трет-бутанола; используется для алкилирования фенолов при синтезе ПАВ. Его сополимеры с бутенами применяют как присадки к маслам и герметики.
Высшие алкены состава C10C18 применяют при синтезе ПАВ, а также для получения высших спиртов.
ГРУППА 305 БИОЛОГИЯ
ТЕМА: Развитие жизни в Криптозое.
Развитие жизни на Земле
Историю живых организмов на Земле изучают по сохранившимся в осадочных горных породах остаткам, отпечаткам и другим следам их жизнедеятельности. Этим занимается наука палеонтология. Для удобства изучения и описания вся история Земли разделена на отрезки времени, имеющие различную длительность и отличающиеся друг от друга климатом, интенсивностью геологических процессов, появлением одних и исчезновением других групп организмов и т. д. В геологической летописи эти отрезки времени соответствуют разным слоям осадочных пород с включенными в них ископаемыми остатками. Чем глубже расположен слой осадочных пород (если, конечно, слои не перевернуты в результате тектонической деятельности), тем древнее находящиеся там ископаемые. Такое определение возраста находок является относительным. Кроме того, нужно помнить, что зарождение той или другой группы организмов происходит раньше, чем она появляется в геологической летописи. Группа должна стать достаточно многочисленной, чтобы через сотни миллионов лет мы могли обнаружить ее представителей при раскопках.

Рис. 71. История развития жизни на Земле и формирование современной атмосферы
Названия этих отрезков времени греческого происхождения. Самые крупные такие подразделения — зоны, их два — криптозой (скрытая жизнь) и фанерозой (явная жизнь). Зоны делятся на эры (рис. 71). В криптозое две эры — архей (древнейший) и протерозой (первичная жизнь). Фанерозой включает в себя три эры — палеозой (древняя жизнь), мезозой (средняя жизнь) и кайнозой (новая жизнь). В свою очередь, эры разделены на периоды, периоды иногда делят на более мелкие части. Для того чтобы выяснить, какие реальные промежутки времени соответствуют эрам и периодам, определяют содержание изотопов различных химических элементов в горных породах и остатках организмов. Поскольку скорость распада изотопов строго постоянная и хорошо известная величина, можно определить абсолютный возраст найденных ископаемых. Чем дальше от нас отстоит тот или другой период времени, тем с меньшей точностью определяется его возраст.
§ 55. Развитие жизни в криптозое
По мнению ученых, планета Земля формировалась 4,5—7 млрд лет назад. Около 4 млрд лет назад стала остывать и затвердела земная кора, на Земле возникли условия, позволившие развиваться живым организмам. Эти первые организмы были одноклеточными, не имели твердых оболочек, поэтому обнаружить следы их жизнедеятельности очень трудно. Неудивительно, что ученые долгое время считали, что Земля значительную часть времени своего существования была безжизненной пустыней. Хотя на криптозой приходится около 7/8 всей истории Земли, интенсивное изучение этого зона началось только в середине XX в. Применение современных методов исследования, таких, как электронная микроскопия, компьютерная томография, методов молекулярной биологии позволило установить, что жизнь на Земле намного древнее, чем представлялось ранее. В настоящее время науке неизвестны такие осадочные породы, в которых бы не было следов жизнедеятельности. В самых древних известных на Земле осадочных породах, возраст которых 3,8 млрд лет, обнаружены вещества, входившие, по-видимому, в состав живых организмов.
Архей. Архей — самая древняя эра, начался более 3,5 млрд лет назад и продолжался около 1 млрд лет. В это время на Земле были уже довольно многочисленны цианобактерии, окаменевшие продукты жизнедеятельности которых — строматолиты — найдены в значительных количествах. Австралийскими и американскими исследователями были найдены и сами окаменевшие цианобактерии. Таким образом, в архее уже существовала своеобразная «прокариотическая биосфера». Цианобактериям обычно для жизнедеятельности нужен кислород. Кислорода в атмосфере еще не было, однако им, по-видимому, хватало кислорода, который выделялся при химических реакциях, протекавших в земной коре. Очевидно, биосфера, состоящая из анаэробных прокариот, существовала еще раньше. Важнейшим событием архея явилось возникновение фотосинтеза. Нам неизвестно, какие именно организмы явились первыми фотосинтетиками. Самым ранним свидетельством существования фотосинтеза являются содержащие углерод минералы с таким соотношением изотопов, которое характерно именно для углерода, прошедшего через процесс фотосинтеза. Эти минералы имеют возраст более 3 млрд лет. Возникновение фотосинтеза имело огромное значение для дальнейшего развития жизни на Земле. Биосфера получила неиссякаемый источник энергии, а в атмосфере начал накапливаться кислород (см. рис. 71). Содержание кислорода в атмосфере еще долго оставалось низким, однако появились предпосылки бурного развития аэробных организмов в дальнейшем.
Протерозой. Протерозойская эра — самая длинная в истории Земли. Она продолжалась около 2 млрд лет. Примерно через 600 млн лет после начала протерозоя, около 2 млрд лет назад, содержание кислорода достигло так называемой «точки Пастера» — около 1% от его содержания в атмосфере, современной нам. Ученые считают, что такая концентрация кислорода достаточна для того, чтобы обеспечить устойчивую жизнедеятельность одноклеточных аэробных организмов. Медленное, но постоянное увеличение содержания кислорода в атмосфере способствовало совершенствованию клеточного дыхания, возникновению окислительного фосфорилирования. Окислительное фосфорилирование, будучи значительно более эффективным способом утилизации энергии углеводов, чем анаэробный гликолиз, в свою очередь, вело к процветанию аэробных организмов. Накопление кислорода в атмосфере привело к формированию озонового экрана в стратосфере, что сделало принципиально возможной жизнь на суше, защитив ее от смертоносного жесткого ультрафиолета. Прокариоты — бактерии и одноклеточные водоросли — жили, по-видимому, и на суше, в пленках воды между минеральными частицами в зонах частичного затопления вблизи водоемов. Результатом их жизнедеятельности стало образование почвы.

Рис. 72. Флора и фауна позднего протерозоя.
1 — многоклеточная водоросль; 2 — губка; 3 — медуза; 4 — ползающий кольчатый червь; 5 — сидячий кольчатый червь; 6 — восьмилучевой коралл; 7 — примитивные членистоногие неясного систематического положения
Не менее важным событием было и возникновение эукариот. Когда оно произошло, неизвестно, так как зафиксировать его очень трудно. Исследования на молекулярном уровне дали основание некоторым ученым предположить, что эукариоты могут быть столь же древними, как и прокариоты. В геологической же летописи признаки деятельности эукариот появились примерно 1,8—2 млрд лет назад. Первые эукариоты были одноклеточными организмами. По-видимо-му, уже у них сформировались такие фундаментальные признаки эукариот, как митоз и наличие мембранных органелл. Ко времени 1,5—2 млрд лет назад относят возникновение одного из самых важных ароморфозов — полового размножения.
Важнейшим этапом в развитии жизни явилось возникновение многоклеточности. Это событие дало мощный толчок увеличению разнообразия живых организмов, их эволюции. Многоклеточность делает возможными специализацию клеток в пределах одного организма, возникновение тканей и органов, в том числе органов чувств, активное добывание пищи, передвижение. Эти преимущества способствовали широкому расселению организмов, освоению всех возможных экологических ниш и в конечном итоге формированию современной биосферы, пришедшей на смену «прокариотической». Первые многоклеточные организмы появились в протерозое не менее 1,5 млрд лет назад. Однако некоторые ученые считают, что это произошло гораздо раньше — около 2 млрд лет назад. Это были, по-видимому, водоросли.
Вспышка разнообразия животных. Конец протерозоя, примерно 680 млн лет назад, ознаменовался мощной вспышкой разнообразия многоклеточных организмов и появлением животных (рис. 72). До этого периода находки многоклеточных редки и представлены растениями и, возможно, грибами. Возникшая в конце протерозоя фауна получила название эдиакарской по местности в Южной Австралии, где в середине XX в. в слоях возрастом 650—700 млн лет были обнаружены первые отпечатки животных. Впоследствии похожие находки были сделаны и на других материках. Эти находки послужили причиной выделения в протерозое особого периода, получившего название венд (по названию одного из славянских племен, живших на берегу Белого моря, где обнаружено множество ископаемых остатков представителей этой фауны). Венд продолжался примерно 110 млн лет. За это короткое по сравнению с предыдущими эпохами время возникло и достигло значительного разнообразия большое количество видов многоклеточных животных, относящихся к типам кишечнополостных, червей, членистоногих. Некоторые из этих животных имели до 1 м в длину, по-видимому, они были студенистыми, как медузы. Отличительная особенность животных вендо-эдиакарской фауны — отсутствие какого бы то ни было скелета. Вероятно, тогда еще не было хищников, от которых надо было защищаться.
С чем же связана такая вспышка разнообразия? Ученые предполагают, что в конце протерозоя наша планета претерпевала значительные потрясения. Была очень высокой гидротермальная активность, шло горообразование, оледенения сменялись потеплением климата. В атмосфере увеличилось содержание кислорода. Повышение содержания кислорода до 5—6% от современного уровня, по-видимому, было необходимым для успешного существования многоклеточных животных довольно крупных размеров. Эти изменения в среде обитания, очевидно, и привели к появлению новых типов и их бурному развитию. Кончался криптозой, эон «скрытой жизни», охватывающий более 85% всего времени существования жизни на Земле, начинался новый этап — фанерозой.
- Как определяется относительный и абсолютный возраст палеонтологических находок?
- Какие основные ароморфозы можно выделить в эволюции одноклеточных организмов?
- Как жизнедеятельность живых организмов повлияла на изменение геологических оболочек Земли?
- 4. Чем можно объяснить возникновение большого разнообразия многоклеточных животных в конце протерозоя?
ГРУППА 306
ТЕМА:Кислоты как электролиты, их классификация по различным признакам.
|
Химические свойства кислот в свете теории электролитической диссоциации. Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков. |
Классификация кислот
1. По числу атомов водорода: число атомов водорода (n) определяет основность кислот:
n = 1 одноосновная
n = 2 двухосновная
n = 3 трехосновная
2. По составу:
а) Таблица кислородсодержащих кислот, кислотных остатков и соответствующих кислотных оксидов:
Кислота (НnА) | Кислотный остаток (А) | Соответствующий кислотный оксид |
H2SO4 серная | SO4 (II) сульфат | SO3 оксид серы (VI) |
HNO3 азотная | NO3 (I) нитрат | N2O5 оксид азота ( V) |
HMnO4 марганцевая | MnO4 (I) перманганат | Mn2O7 оксид марганца (VII) |
H2SO3 сернистая | SO3 (II) сульфит | SO2 оксид серы (IV ) |
H3PO4 ортофосфорная | PO4 (III) ортофосфат | P2O5 оксид фосфора (V) |
HNO2 азотистая | NO2 (I) нитрит | N2O3 оксид азота (III ) |
H2CO3 угольная | CO3 (II) карбонат | CO2 оксид углерода ( IV) |
H2SiO3 кремниевая | SiO3 (II) силикат | SiO2 оксид кремния (IV) |
НСlO хлорноватистая | СlO (I) гипохлорит | Сl2O оксид хлора (I) |
НСlO2 хлористая | СlO2 (I) хлорит | Сl2O3 оксид хлора (III) |
НСlO3 хлорноватая | СlO3 (I) хлорат | Сl2O5 оксид хлора (V) |
НСlO4 хлорная | СlO4 (I) перхлорат | Сl2O7 оксид хлора (VII) |
б) Таблица бескислородных кислот
Кислота (НnА) | Кислотный остаток (А) |
HCl соляная, хлороводородная | Cl (I) хлорид |
H2S сероводородная | S(II) сульфид |
HBr бромоводородная | Br (I) бромид |
HI йодоводородная | I(I) йодид |
HF фтороводородная,плавиковая | F(I) фторид |
Физические свойства кислот
Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3. Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.
Способы получения кислот
бескислородные | кислородсодержащие |
HCl, HBr, HI, HF, H2S | HNO3, H2SO4 и другие |
ПОЛУЧЕНИЕ | |
1. Прямое взаимодействие неметаллов H2 + Cl2 = 2 HCl | 1. Кислотный оксид + вода = кислота SO3 + H2O = H2SO4 |
2. Реакция обмена между солью и менее летучей кислотой 2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl | |
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Распределите химические формулы кислот в таблицу. Дайте им названия:
LiOH, Mn2O7, CaO, Na3PO4, H2S, MnO, Fe(OH)3, Cr2O3, HI , HClO4 ,HBr , CaCl2, Na2O, HCl , H2SO4 , HNO3 , HMnO4 , Ca(OH)2, SiO2, H2SO3 , Zn(OH)2, H3PO4 , HF , HNO2 ,H2CO3 , N2O, NaNO3 ,H2S , H2SiO3
Кислоты | ||||||
Бес-кисло- родные | Кислород- содержащие | растворимые
| нераст-воримые | одно- основные | двух-основные | трёх-основные |
ТРЕНАЖЁРЫ
Тренажёр №1. "Формулы и названия кислот"
Тренажёр №2. " Установление соответствия: формула кислоты - формула оксида"
Тренажёр №3. "Действие кислот на индикаторы"
Тренажёр №4. "Классификация кислот по наличию кислорода в кислотном остатке"
Тренажёр №5. "Классификация кислот по основности"
Тренажёр №6. "Классификация кислот по растворимости в воде"
Тренажёр №7. "Классификация кислот по стабильности"
Техника безопасности - Оказание первой помощи при попадании кислот на кожу
Техника безопасности - Правила техники безопасности при работе с кислотами файл
Техника безопасности - Правило разбавления концентрированной серной кислоты водой
Химические свойства кислот
Химические свойства кислот 1. Изменяют окраску индикаторов Видео "Действие кислот на индикаторы"
2.Реагируют с металлами в ряду активности до H2 (искл. HNO3 –азотная кислота) Видео "Взаимодействие кислот с металлами" Ме + КИСЛОТА =СОЛЬ + H2↑ (р. замещения) Zn + 2 HCl = ZnCl2 + H2
3. С основными (амфотерными) оксидами – оксидами металлов Видео "Взаимодействие оксидов металлов с кислотами" МехОу + КИСЛОТА= СОЛЬ + Н2О (р. обмена) 4. Реагируют с основаниями – реакция нейтрализации
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H2O ( р. обмена) H3PO4 + 3NaOH = Na3PO4 + 3H2O
5. Реагируют с солями слабых, летучих кислот - если образуется кислота, выпадающая в осадок или выделяется газ:
2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl↑ ( р. обмена)
Видео "Взаимодействие кислот с солями" 6. Разложение кислородсодержащих кислот при нагревании ( искл. H2SO4 ; H3PO4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения )
Запомните! Неустойчивые кислоты (угольная и сернистая) – разлагаются на газ и воду: H2CO3 ↔ H2O + CO2↑ H2SO3 ↔ H2O + SO2↑ Сероводородная кислота в продуктах выделяется в виде газа: СаS + 2HCl = H2S↑ + CaCl2 ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ №1. Составьте уравнения реакций: Ca + HCl Na + H2SO4 Al + H2S Ca + H3PO4 №2. Составьте уравнения реакций, назовите продукты: Na2O + H2CO3 ZnO + HCl CaO + HNO3 Fe2O3 + H2SO4 №3. Составьте уравнения реакций взаимодействия кислот с основаниями и солями: KOH + HNO3 NaOH + H2SO3 Ca(OH)2 + H2S Al(OH)3 + HF HCl + Na2SiO3 H2SO4 + K2CO3 HNO3 + CaCO3 Назовите продукты реакции. |