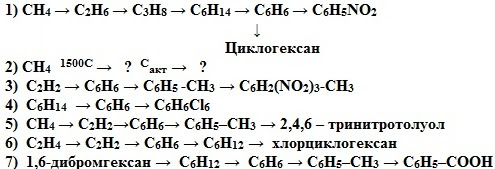Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com Тетрадь привезете, когда перейдем на очную форму обучения.)
Моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
СПРАВА НАХОДИТСЯ АРХИВ- ТАМ СМОТРИМ ДАТУ И ГРУППЫ
РАСПИСАНИЕ ЗАНЯТИЙ НА НЕДЕЛЮ: 13.03.23г. - 17.03.23г.
Пн.13.03: 306, 401, 401, 403
Вт. 14.03:508, 505, 505, 501
Ср. 15..03: 406, 403, 401, 501
Чт. 16.03: .., 501, 306, 508
Пт. 17.03: 505, ..., 501
ГРУППА 508 ХИМИЯ 34,35
Органическая химия – наука о жизненно-важных веществах. Углеводороды имеют большое значение для современных отраслей промышленности, техники, повседневной жизни. Каждый день синтезируются все новые и новые вещества. И наша задача на уроке рассмотреть основные закономерности превращения органических веществ на примере углеводородов, Классификация углеводородов и их генетическая связь поможет нам сформировать целостное представление о представителях класса углеводородах и понять основные закономерности, которые применяются в превращении органических веществ.
Разнообразный мир углеводородов можно разделить на три группы: предельные, непредельные, циклические. А какие представители этих групп Вам известны? Основные физические свойства? (демонстрация коллекции)
К предельным углеводородам относятся алканы, к непредельным – алкены, алкадиены, алкины, к циклическим – циклоалканы, арены.
А какое практическое значение имеют эти вещества?
Углеводороды играют важнейшую роль в нашей жизни: служат сырьем для получения пластмасс, резины, лекарств, волокон, средств бытовой химии, несут в наши дома свет и тепло.
Обратите внимание на схему «Генетическая связь углеводородов». Оказывается, все углеводороды связаны между собой. Это видно на схеме.
Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
1 2 3 4
а) C2H6 ---- C2H4 ---- C2H2---- С6H6 ------C6H5Cl
1 2 3 4
б) CH4 ---- CH3Br ---- C2H6 ---- C2H4 ---- C2H3Cl
С помощью каких реакций, мы можем осуществить переход от одного вещества к другому? (реакции гидрирования - присоединения и дегидрирования-отщепления).
ГЕНЕТИЧЕСКАЯ СВЯЗЬ АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ С ДРУГИМИ КЛАССАМИ УГЛЕВОДОРОДОВ
Вывод: Сегодня на уроке – на примере генетической связи органических веществ разных гомологических рядов мы увидели и доказали с помощью превращений – единство материального мира.
ГРУППА 505 ХИМИЯ 38,39
ТЕМА :Основания и их свойства.
Испытание растворов щелочей индикаторами. Взаимодействие щелочей с солями. Разложение нерастворимых оснований.
Основания как электролиты, их классификация по различным признакам.
Химические свойства оснований в свете теории электролитической диссоциации.
ПЛАН
1) Определение оснований.
a) Исходя из состава,
b) Как электролита.
2) Классификация оснований.
a) По растворимости в воде,
b) По силе электролита
c) По числу гидроксильных групп,
3) Химические свойства оснований.
a) Действие на индикаторы,
b) Взаимодействие с кислотными оксидами,
c) Взаимодействие с кислотами,
d) Разложение при нагревании,
e) Взаимодействие с солями.
Основания – это сложные вещества, в молекулах которых атомы металла соединены с одной или несколькими гидроксильными группами.
Основания – это электролиты, которые при диссоциации образуют в качестве анионов только гидроксид-ионы.
NaOH ® Na+ + OH-
Ca(OH)2 ® CaOH+ + OH- ® Ca2+ + 2OH- -
Существует несколько признаков классификации оснований:
- В зависимости от растворимости в воде основания делят на щёлочи и нерастворимые. Щелочами являются гидроксиды щелочных металлов ( Li, Na, K, Rb, Cs) и щелочноземельных металлов ( Ca, Sr, Ba ). Все остальные основания являются нерастворимыми.
- В зависимости от степени диссоциации основания делятся на сильные электролиты ( все щёлочи ) и слабые электролиты ( нерастворимые основания ).
- В зависимости от числа гидроксильных групп в молекуле основания делятся на однокислотные ( 1 группа ОН ), например, гидроксид натрия, гидроксид калия, двухкислотные ( 2 группы ОН ), например, гидроксид кальция, гидроксид меди(2), и многокислотные.
Химические свойства.
Ионы ОН- в растворе определяют щелочную среду.
- Растворы щелочей изменяют окраску индикаторов:
Фенолфталеин: бесцветный ® малиновый,
Лакмус: фиолетовый ® синий,
Метилоранж : оранжевый ® жёлтый.
- Растворы щелочей взаимодействуют с кислотными оксидами с образованием солей тех кислот, которые соответствуют реагирующим кислотным оксидам. В зависимости от количества щёлочи образуются средние или кислые соли. Например, при взаимодействии гидроксида кальция с оксидом углерода(IV) образуются карбонат кальция и вода:
Ca(OH)2 + CO2 = CaCO3? + H2O
Ca2+ + 2OH- + CO2 = CaCO3 + H2O
А при взаимодействии гидроксида кальция с избытком оксида углерода(IV) образуется гидрокарбонат кальция:
Ca(OH)2 + CO2 = Ca(HCO3)2
Ca2+ + 2OH- + CO2 = Ca2+ + 2HCO32-
- Все основания взаимодействуют с кислотами с образованием соли и воды, например: при взаимодействии гидроксида натрия с соляной кислотой образуются хлорид натрия и вода:
NaOH + HCl = NaCl + H2O
Na+ + OH- + H+ + Cl- = Na+ + Cl- + H2O
OH- + H+ = H2O.
Гидроксид меди(II) растворяется в соляной кислоте с образованием хлорида меди(II) и воды:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Cu(OH)2 + 2H+ + 2Cl- = Cu2+ + 2Cl- + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2О.
Реакция между кислотой и основанием называется реакцией нейтрализации.
- Нерастворимые основания при нагревании разлагаются на воду и соответствующий основанию оксид металла, например:
t0 t0
Cu(OH)2 = CuO + H2 2Fe(OH)3 = Fe2O3 + 3H2O
- Щёлочи вступают во взаимодействие с растворами солей, если выполняется одно из условий протекания реакции ионного обмена до конца ( выпадает осадок), например: при взаимодействии гидроксида натрия с раствором сульфата меди(II) образуется осадок гидроксида меди(II).
2NaOH + CuSO4 = Cu(OH)2? + Na2SO4
2OH- + Cu2+ = Cu(OH)2
Реакция протекает за счёт связывания катионов меди с гидроксид-ионами.
При взаимодействии гидроксида бария с раствором сульфата натрия образуется осадок сульфата бария.
Ba(OH)2 + Na2SO4 = BaSO4? + 2NaOH
Ba2+ + SO42- = BaSO4
Реакция протекает за счёт связывания катионов бария и и сульфат-анионов
ТЕМА:Основания как электролиты, их классификация по различным признакам.
Химические свойства оснований в свете теории электролитической диссоциации.
Основания как электролиты, их классификация по различным признакам.
Химические свойства оснований в свете теории электролитической диссоциации.
Разложение нерастворимых в воде оснований. Основные способы получения оснований.
Основания – это сложные вещества, состоящие из атомов металлов и одной или нескольких гидроксогрупп (ОН-).
С точки зрения теории электролитической диссоциации это электролиты (вещества, растворы или расплавы которых проводят электрический ток), диссоциирующие в водных растворах на катионы металлов и анионы только гидроксид - ионов ОН-.
Растворимые в воде основания называются щелочами. К ним относятся основания, которые образованы металлами 1-й группы главной подгруппы (LiOH, NaOH и другие) и щелочноземельными металлами (Са(ОН)2, Sr(ОН)2, Ва(ОН)2). Основания, образованные металлами других групп периодической системы в воде практически не растворяются. Щелочи в воде диссоциируют полностью:
NaOH ® Na+ +
Многокислотные основания в воде диссоциируют ступенчато:
Ba(OH)2 ® BaOH+ +
Ba(OH)+ Ba2+ +
Cтупенчатой диссоциацией оснований объясняется образование основных солей.
Получение
1. Взаимодействие активного металла с водой:
2Na + 2H2O → 2NaOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Mg + 2H2O Mg(OH)2 + H2
2. Взаимодействие основных оксидов с водой (только для щелочных и щелочноземельных металлов):
Na2O + H2O → 2NaOH,
CaO + H2O → Ca(OH)2.
3. Промышленным способом получения щелочей является электролиз растворов солей:
2NaCI + 4H2O 2NaOH + 2H2
+ CI2
4. Взаимодействие растворимых солей со щелочами, причем для нерастворимых оснований это единственный способ получения:
Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4
MgSO4 + 2NaOH → Mg(OH)2 + Na2SO4.
Нерастворимые основания
Определение Нерастворимые основания ― основания, в составе которых нет активных металлов (подгруппы Ia и IIа ниже магния).
Получение • Способ получения нерастворимых оснований ― соль + щелочь: Fe(NO3)3 + 3NaOH → Fe (OH)3↓ + 3NaNO3 Fe3+ + 3OH- → Fe(OH)3 • Нерастворимые основания нельзя получить из соответствующего оксида и воды ― они не реагируют (искл.оксид магния). MeO + H2O — не реагирует Неактивный Классификация нерастворимых оснований • основные • амфотерные нерастворимые основания основные амфотерные формула MeOH +1; +2 (кр. искл) MeOH +3; +4; (+2) искл. разлагаются при повышении температуры Cu(OH)2 → CuO + H2O синий черный во влажном состоянии Zn(OH)2 → ZnO + H2O реагируют с кислотами Mg(OH)2 + 2HCl → MgCl2 +2H2O Mg(OH)2 + 2H+ → Mg2+ + 2H2O Be(OH)2 + 2HCl → BeCl2 + 2H2O Be(OH)2 + 2H+ → Be2+ + 2H2O реагирует со щелочами в растворе NaOH + Al(OH)3 → Na[Al(OH)4] OH- + Al(OH)3 → [Al(OH)
ТЕМА :Развитие жизни в Мезозое.
ГРУППА 501 БИОЛОГИЯ 37,38
- увеличение численности особей;
- расширение ареала;
- увеличение числа таксонов (популяций, подвидов, видов и т. д.).

- двусторонняя симметрия тела;
- сквозной кишечник;
- трахейное дыхание у членистоногих;
- лёгочное дыхание у позвоночных;
- альвеолярные лёгкие;
- четырёхкамерное сердце;
- два круга кровообращения;
- теплокровность.
- возникновение фотосинтеза;
- формирование тканей;
- возникновение листа, стебля, корня;
- появление семени;
- образование цветка и плода.
- разные типы листьев и стеблей у растений;
- разное строение цветков у растений;
- видоизменения побега растений;
- разные клювы у птиц;
- разная форма тела и окраска рыб;
- разные типы ротовых аппаратов насекомых.

- упрощение нервной системы и органов чувств у паразитических червей;
- редукция пищеварительной системы у ленточных червей;
- редукция головы у двустворчатых моллюсков;
- исчезновение крыльев у некоторых паразитических насекомых;
- редукция листьев у паразитических растений.


- снижение численности особей в систематических группах;
- сужение ареала;
- уменьшение числа таксонов (популяций, подвидов, видов и т. д.).
Лабораторная работа № 3 по биологии .
Тема: Ароморфозы (у растений) и идиоадаптации (у насекомых).
Цель: сформировать умение выявлять ароморфозы и идиоадаптации у растений и животных, объяснять их значение.
Оборудование: гербарные материалы водорослей, мхов, папоротникообразных, цветковых растений, веточки сосны или ели, коллекции насекомых.
Ход работы
1. Рассмотрите растения: водоросль, мох, папоротник, веточку сосны или ели, цветковое растение — назовите имеющиеся у них органы и заполни Таблицу 1. Выявите черты усложнения в строении растений этих отделов и раскройте их значение. Определите, по какому направлению шла эволюция растений от водорослей до покрытосеменных.
2.Рассмотрите насекомых разных отрядов (чешуекрылые, прямокрылые, двукрылые и др.), выявите в их строении черты сходства и различия и заполни Таблицу 2. Сделайте вывод о направлении эволюции насекомых.
Таблица 1. Ароморфозы растений
растение | Органы растения |
Ламинария | Слоевище, ризоиды. |
Папоротник орляк | Корень, стебель, листья, споры. |
Сосна крымская | Корень, стебель, листья, семена. |
Лютик ползучий | Корень, стебель, листья, цветки, семена. |
Ароморфозы – это существенные эволюционные изменения, повышающие уровень организации организмов.
Ароморфозы растений:
- появление корня;
- разделение тела на стебель и листообразные пластинки;
- возникновение оплодотворения, не связанного с водой;
- возникновение семенных зачатков;
- возникновение семени;
- возникновение хвои;
- появление шишки – видоизменённого побега;
- появление в цветках половых органов – мужских (антеридии) и женских (архегонии);
- появление способности к опылению насекомыми.
Вывод: эволюция растений от водорослей до покрытосеменных шла по направлению ароморфозов. В результате ароморфозов повышался уровень организации растений, образовывались новые классы растений, у растений появлялись значительные преимущества в борьбе за выживание и возможность перехода в другую среду обитания.
Таблица 2. Идиоадаптации у насекомых
Отряд насекомых | Части тела | Конечности | Крылья | Ротовой аппарат |
двукрылые | Голова, грудь, брюшко. | 3 пары ног | 2 пары крыльев: передняя пара хорошо развита, задняя пара - жужжальца | Лижуще-сосущий (муха), колюще-сосущий (комар). |
чешуекрылые | Голова, грудь, брюшко. | 3 пары ног | 2 пары крыльев, покрытых чешуйками | Сосущий (бабочка), грызущий (моль). |
прямокрылые | Голова, грудь, брюшко. | 3 пары ног | 2 пары крыльев: передняя пара – надкрылья, задняя пара – широкие перепончатые крылья. | Грызущий (кузнечик). |
Идиоадаптации – это прогрессивные, но незначительные эволюционные изменения.
Идиоадаптации у насекомых проявляются в различном строении ротовых аппаратов. Появление большого разнообразия видов насекомых – следствие их эволюционного развития по пути идиоадаптаций.
Вывод: в результате идиоадаптаций насекомые приспосабливались к среде обитания, образовывались новые виды, рода, семейства, отряды внутри класса. Уровень организации организмов не изменялся.



- абиогенный синтез органических веществ;
- образование биополимеров;
- формирование мембранных структур и появление самовоспроизведения.