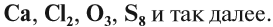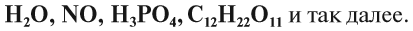ТЕМА: Зависимость растворимости газов, жидкостей и твердых веществ от различных факторов. Это интересно. ( Сообщения учащихся ) Наш организм состоит на 65 % из воды, если перевести проценты в литры то получиться , что в человеке массой 65 кг. Содержится 40 литров воды. Из них 25 л. Внутри клеток, 15 – в составе внеклеточных жидкостей. Мы выделяем 1,5 л слюны, 2,5 л желудочного сока, 0,7 сока поджелудочного и 3л кишечных соков. Мозг человека содержит -81%, Почва -20 %, Вода –это распределитель солнечной энергии на земле, главнейший творец климата, аккумулятор тепла .Рисунок 1
II. Вода- универсальный растворитель. Она растворяет многие газообразные (демонстрируем- минеральную газированную воду), жидкие (уксусная кислота), твердые (сахар) вещества. Но разве все растворы нам полезны. Так ,дождевая вода, растворяя содержащиеся в воздухе оксиды серы (II), углерода, азота, выпадает в виде кислотных дождей. Влияние условий на растворимостьДля определения качественной растворимости часто используется эмпирическое правило «подобное растворяется в подобном». Это правило разные источники объясняют немного по-разному: полярные вещества растворяются в полярных растворителях, вещества имеющие гидроксильные группы хорошо растворяются в растворителях с гидроксильными группами и т. п. Растворимость зависит от - растворяемого вещества,
- растворителя,
- температуры,
- давления,
- наличия в растворителе других веществ.
Растворимость большинства газов растет с ростом давления и уменьшается с ростом температуры. Для твёрдых и жидких веществ влияние давления на растворимость менее значимо, чем для газов. Температура имеет различное влияние на различные системы «растворяемое вещество — растворитель», но в большинстве случаев при увеличении температуры растёт растворимость (обратной зависимостью обладают, например, многие соли кальция). Так как растворяемое вещество часто увеличивает температуру кипения растворителя, растворимость при атмосферном давлении может быть измерена и выше температуры кипения растворителя. При повышенном давлении и температуре растворимость может сильно увеличиваться (например, в воде при высоком давлении и температуре относительно хорошо растворяются углеводороды и кварц, которые почти нерастворимы при обычных условиях). Наличие в растворителе других веществ может сильно влиять на растворимость. Примеры: - добавление солей в водный раствор неполярных веществ может привести к выделению неполярного вещества в осадок, за счет эффекта высаливания,
- наличие растворённого кислорода сильно влияет на растворимость ртути в воде за счет эффектов поверхностного окисления,
- наличие небольшого количества влаги в абсолютном этаноле может сильно изменить растворимость неполярных веществ.
Закрепление изученного материала .№1«Тест» 1. Какое из веществ является практически нерастворимым? а) нитрат серебра; б) сульфат бария; в) гидроксид кальция; г) хлорид натрия. 2. Как изменяется растворимость гидроксида кальция в воде при повышении температуры? а) понижается; б) остается постоянной; в) повышается; г) сначала повышается, а затем понижается. 3. Увеличение растворимости газообразных веществ, как правило, не зависит от: а) температуры и природы растворяемого вещества; б) температуры и давления; в) природы растворяемого вещества и давления; г) перемешивания и освещения. 4. С понижением температуры растворимость какого вещества возрастает? а) HCl, б) KI; в) Cu(OH)2; г) AgNO3. 5. Все растворимые вещества перечислены в ряду: а) CuSO4, AgNO3, Cu(OH)2; б) KI, Мg(NO3)2, FeCl3; в) Cа(OH)2, FeCl2, AgCl; г) AgI, KNO3, Cа(OH)2. 6. Растворимость веществ с повышением температуры возрастает в ряду: а) КОН и О2; б) Н2S и KNO3; в) NaCl и НI; г) Na2CO3 и N2. Задание №2 «Выбери меня» – Из веществ, формулы которых NaI, BaSO4, HI, KOH, Fe(OH)3, Na2CO3, выберите - растворимые вещества; - нерастворимые вещества. ГРУППА 106 ТЕМА: Решение генетических задач. На предыдущих уроках мы с вами изучали законы Менделя. А для чего же изучаются вообще законы?
( Чтобы объяснить какие-то явления природы; чтобы использовать их на практике).
А как мы можем использовать законы Менделя?
( прогнозировать признаки будущих потомков, понимать свою родословную, в наблюдениях, в решении генетических задач.)
А вам нравится решать задачи?
( Да )
Итак, сегодня мы с вами будем решать генетические задачи. В книге Е. Пчелова “Романовы. История династии” с. 436 говорится: “Царевич унаследовал гемофилию от матери - Александры Фёдоровны. Эта болезнь передаётся только через женщин, которые сами не болеют, но являются носителями вируса. А поражает гемофилия исключительно мужчин”. Хотите узнать, допустил ли ошибки автор? (Ответ: Гемофилия не вирусное заболевание, женщины могут болеть гемофилией; если мать носитель гемофилии, а отец здоров, в этом случае вероятность рождения дочери равна 25 %.)
Вспомним основные традиционные обозначения, применяемые в генетике. Знаком «зеркало Венеры» обозначают женский пол. Знаком «копьё Марса» – мужской. Крестик обозначает скрещивание. Буквой P (от латинского parentibus) – родительские формы. Гибридное потомство – буквой F (от латинского filios). Цифра с буквой указывает на порядковый номер поколения гибридов. Например, F1 – гибриды первого поколения.
Буквой G обозначают гаметы. Записываются они в кружках. 
Итак, начнём с самого простого. Задачи на определение типов гамет. Задача 1. Дано: сколько и какие типы гамет может образовывать организм с генотипом AABBccDD? Решение: гаметы имеют гаплоидный набор хромосом. Значит, в каждой из них будет по одному аллельному гену из каждой пары. Поскольку в условии нам предложен гомозиготный организм (доминантная гомозигота по первому и второму признаку, рецессивная гомозигота по третьему и доминантная гомозигота по четвёртому), аллельные гены у которого одинаковые, то и все гаметы будут одинаковыми. Ответ: данный организм будет образовывать один тип гамет: ABcD. Обратите внимание. Организм даёт не одну гамету, а один тип. Самих гамет может быть разное количество. Самка луна-рыбы, например, вымётывает до 300 миллионов икринок. Задача 2. Дано: сколько и какие типы гамет будет образовывать организм с генотипом AABbccDD? Решение: мы видим, что этот организм гетерозиготен по второму признаку, а значит в его гаметах может оказаться как ген B, так и ген b. Получаем два варианта их распределения с остальными генами: ABcD и AbcD. Но это самый простой пример. Если гетерозиготных аллелей (пар) несколько, то при расчёте, чтобы не перебирать все возможные варианты, пользуются несложной формулой 2n, где n – количество гетерозиготных аллелей (пар). В нашем примере с организмом AABbccDD – одна гетерозиготная аллель – Bb. Подставляем в формулу число 1. Получаем 21 и ответ: два типа гамет. Разберём более сложный пример.
Задача 3. Дано: сколько и какие типы гамет может образовывать организм с генотипом AaBBCcDD? Генотип содержит две гетерозиготные аллели (пары). Подставляем в формулу 2n их количество и получаем 22. Значит, данный организм может давать четыре типа гамет.
Поскольку разные аллели могут попасть в гаметы в разных сочетаниях, перебираем их все. Главное здесь быть внимательными и не запутаться.
Вначале возьмём доминантные аллельные гены из каждой гетерозиготной пары: ABCD. А дальше, отталкиваясь от этого варианта, поочерёдно заменяем доминантные аллели рецессивными: aBCD, ABcD и вариант с двумя рецессивными аллелями: aBcD.
Ответ: четыре типа гамет: ABCD, aBCD, ABcD, aBcD. Задачи на моногибридное скрещивание.
Полное доминирование. Задача 1. Дано: кареглазый мужчина женился на голубоглазой женщине. У них родился голубоглазый ребёнок. Определите генотипы родителей и вероятность рождения ребёнка с карими глазами. Решение: в задаче идёт речь об одном признаке – цвете глаз. Значит, это задача на моногибридное скрещивание. Выбираем буквенные обозначения для разного состояния генов, то есть для каждого цвета глаз. При этом учитываем, что ген кареглазости доминантный, а ген, обуславливающий голубой цвет глаз рецессивный.
Пускай А обозначает карие глаза, а ген а – голубые.
Записываем ход скрещивания условными обозначениями.
Родители Р (ставим точку и двоеточие). Обратите внимание и запомните – на первом месте всегда записывается генотип женской особи. Если поставите мужскую – это будет ошибкой. Итак, женщина голубоглазая, значит у нас может быть только один вариант генотипа – аа. То есть, женский организм – рецессивная гомозигота по данному признаку. Кареглазый мужчина может быть, как доминантной гомозиготой, так и гетерозиготой. Но так как по условию задачи у этой пары рождается голубоглазый ребёнок, значит у мужчины в гаметах будет рецессивный ген а. Записываем гетерозиготу – Аа.
Далее определяем гаметы, которые будут давать родительские формы: у матери все они будут содержать а, так как гомозиготы не дают расщепления в потомстве. Будьте здесь внимательны. Записывать нужно только тип гамет. У нас он один. А у гетерозиготного отца образуется два типа гамет: одни будут содержать А – ген кареглазости, другие – а – ген, обуславливающий голубой цвет глаз.
Определяем возможные генотипы и фенотипы детей. При слиянии сперматозоида, содержащего доминантный ген А и яйцеклетки, содержащей рецессивный ген а, развивается гетерозиготный ребёнок по данному признаку с карими глазами. Это один вариант. При слиянии половых клеток с одинаковыми рецессивными генами, будет развиваться гомозиготный ребёнок по данному признаку с голубым цветом глаз. Это второй вариант. Других генотипов у гибридов первого поколения быть не может. Значит в потомстве получаем расщепление, обусловленное гетерозиготностью отца. 50% кареглазых и 50% голубоглазых детей. 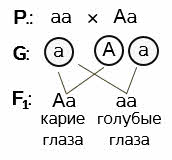
Ответ: мужчина гетерозиготен по данному признаку. Женщина - рецессивная гомозигота. Вероятность рождения в семье ребёнка с карими глазами – 50%. Задача 2. Полидактилия у человека является доминантным признаком, а нормальное строение кистей рук – признак рецессивный. От брака мужчины, имеющего нормальное строение рук с гетерозиготной шестипалой женщиной, родились два ребёнка: пятипалый и шестипалый. Каков генотип этих детей? Решение: обозначаем буквами доминантный и рецессивный признаки. А – полидактилия, а – нормальное строение кистей рук.
Записываем генотипы родителей. По условию задачи, женщина гетерозиготна. У мужчины известен только фенотип. Но, поскольку он имеет нормальное строение кистей рук, а ген, отвечающий за такое строение рецессивен, делаем вывод о том, что в генотипе мужчины отсутствует доминантный ген шестипалости и он является рецессивной гомозиготой по данному признаку.
Поскольку мать гетерозиготна – она даёт два типа гамет: А и а. Гомогаметный отец – один тип гамет – а.
Рассматриваем варианты слияния гамет. А и а – в результате шестипалый гетерозиготный ребёнок. Вариант а и а даст начало развитию ребёнка с нормальным строением кистей рук. Его генотип – рецессивная гомозигота. Проверяем, соблюдается ли условие задачи. Соблюдается. 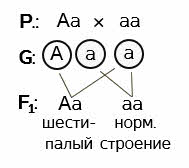
Ответ: пятипалый ребёнок – рецессивная гомозигота по данному признаку, шестипалый – гетерозиготен. Задача 3. От скрещивания комолого быка айширской породы с рогатыми коровами в первом поколении получили 18 комолых (безрогих) телят. Во втором поколении гибридов родилось 96 телят. Часть из них безрогие, а часть рогатые. Определите количество комолых телят во втором поколении и запишите ход скрещивания. Решение: ген комолости доминирует над геном рогатости. Даже если нам это неизвестно – такой вывод можно сделать из условия задачи. В первом поколении наблюдается единообразие гибридов. А во втором происходит расщепление с проявлением признака, кодируемого рецессивным геном (второй закон Менделя). Делаем вывод о том, что ген комолости – доминантный, а ген, определяющий наличие рогов – рецессивный.
Записываем условие. Рогатые коровы могут иметь только один генотип – рецессивные гомозиготы. Комолые быки могут быть как гомозиготными, так и гетерозиготными. Но поскольку в первом поколении гибридов рецессивный признак не проявляется (18 телят – достаточное количество, чтобы это предположить с большой долей вероятности), значит мужская особь – доминантная гомозигота.
Гомозиготы дают по одному типу гамет.
В результате оплодотворения образуется единообразное потомство. 100% гетерозигот. 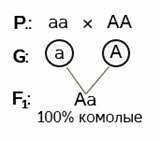
Скрещиваем между собой гибридов первого поколения. Родительские особи дают по два типа гамет. Для того, чтобы рассмотреть все варианты их слияния – построим решётку Пеннета. Помните? Женские гаметы записываются вертикально, а мужские горизонтально. Заполняем решётку.
Получаем расщепление по фенотипу в соотношении три к одному. Три части комолых и одна часть рогатых телят. Так как по условию, общее количество телят 96, то три части от этого количества составит 72 телёнка. 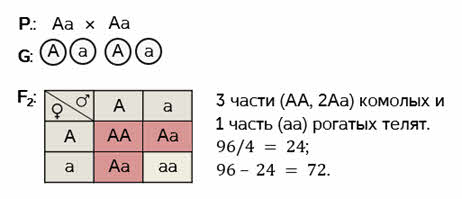
Если бы в условии задачи не было задания записать ход скрещивания, её можно было бы решить, опираясь только на второй закон Менделя. Согласно его формулировке во втором поколении гибридов наблюдается расщепление: три части особей с доминантным признаком и одна часть с рецессивным. Всё те же 72 телёнка. Ответ: 72 телёнка. Неполное доминирование. Задача 1. У земляники красная окраска ягод неполно доминирует над белой. Какое потомство следует ожидать от скрещивания двух растений с розовыми ягодами? Запишите генотипы и фенотипы гибридов. Решение: обозначим доминантный ген буквой А, а рецессивный – а. Отметим, что доминантные гомозиготы будут иметь красные ягоды, рецессивные гомозиготы – белые, а гетерозиготы – розовые.
Записываем ход скрещивания. Обе родительские формы – гетерозиготы. Так как по условию они имеют розовые ягоды. Гетерозиготы дают два типа гамет.
Строим решётку Пеннета. Определяем генотипы и фенотипы первого поколения гибридов. Обратите внимание, что при неполном доминировании (промежуточном характере наследования) расщепление по фенотипу совпадает с расщеплением по генотипу. 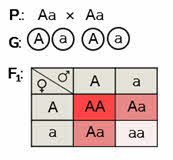
Ответ: 25 % доминантных гомозигот с красными ягодами, 50 % гетерозигот с промежуточной окраской плодов – розовой и 25 % рецессивных гомозигот с белыми ягодами. ГРУППА 305 Тема: Основные понятия химии. Вещество. Атом. Молекула.
Химический элемент. Аллотропия. Тема:Простые и сложные вещества. Качественный и
количественный состав веществ. (прочитайте, составьте небольшой конспект по темам) Простейшие понятия: вещество, молекула, атом, химический элементЧто такое химия? Где мы встречаемся с химическими явлениями? Везде. Сама жизнь — это бесчисленное множество разнообразных химических реакций, благодаря которым мы дышим, видим голубое небо, ощущаем изумительный запах цветов… Что изучает химия? Химия изучает вещества, а также химические процессы, в которых участвуют эти вещества. Что такое вещество — понятно: это то, из чего состоит окружающий нас мир и мы сами. Но что такое химический процесс (явление)? К химическим явлениям относятся процессы, в результате которых изменяется состав или строение молекул, образующих данное вещество. Изменились молекулы — изменилось вещество (оно стало другим!), — изменились его свойства: - свежее молоко стало кислым;
- зелёные листья стали жёлтыми;
- сырое мясо при обжаривании изменило запах.
Все эти изменения — следствие сложных и многообразных химических процессов. Итак, химия — это наука о веществах и их превращениях. При этом исследуются не всякие превращения, а только такие, при которых - обязательно изменяется состав или строение молекул;
- никогда не изменяется состав и заряд ядер атомов.
В этом определении встречаются такие понятия, как «вещество», «молекула», «атом». Разберём их подробнее. Вещество — это то, из чего состоят окружающие нас предметы. Каждому абсолютно чистому веществу (таких в природе, кстати, не существует) приписывают определённую химическую формулу, которая отражает его состав, например: - Н2О — вода;
- Na8[(AlSiO4)6SO4] — лазурит.
Выше приведены молекулярные формулы двух веществ. Следует отметить, что далеко не все вещества состоят из молекул, так как существуют вещества, которые состоят из атомов или ионов. Например, алмаз состоит из атомов углерода, а обычная поваренная соль — из ионов Na+ и ионов Cl– (условная «молекула» — NaСl). Наименьшая частица вещества, которая отражает его качественный и количественный состав, называется молекулой. Молекулы состоят из атомов. Атомы в молекуле соединены при помощи химических связей. Каждый атом обозначается при помощи символа (химического знака): - Н — атом водорода;
- О — атом кислорода.
Число атомов в молекуле обозначают при помощи индекса: 
Примеры: - О2 — это молекула вещества кислорода, состоящая из двух атомов кислорода;
- Н2О — это молекула вещества воды, состоящая из двух атомов водорода и одного атома кислорода.
Но! Если атомы не связаны химической связью, то их число обозначают при помощи коэффициента: 
Аналогично изображают число молекул: - 2Н2 — две молекулы водорода;
- 3Н2О — три молекулы воды.
Почему атомы водорода и кислорода имеют разное название, разный символ? Потому что это атомы разных химических элементов. Химический элемент — это частицы с одинаковым зарядом ядер их атомов. Что такое ядро атома? Почему заряд ядра является признаком принадлежности атома к данному химическому элементу? Чтобы ответить на эти вопросы, следует уточнить: изменяются ли атомы в химических реакциях? Из чего состоит атом*? * Подробнее о строении атома будет рассказано в уроке 3.
Атом не имеет заряда, хотя и состоит из положительно заряженного ядра и отрицательно заряженных электронов: 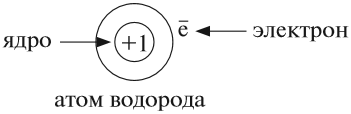
В ходе химических реакций число электронов любого атома может изменяться, но заряд ядра атома в химических реакциях НЕ МЕНЯЕТСЯ! Поэтому заряд ядра атома — своеобразный «паспорт» химического элемента. Все атомы с зарядом ядра +1 принадлежат химическому элементу под названием «водород». Атомы с зарядом ядра +8 составляют химический элемент «кислород». Каждому химическому элементу присвоен химический символ (знак), порядковый номер в таблице Менделеева (порядковый номер равен заряду ядра атома); определённое название и, для некоторых химических элементов, особое прочтение символа в химической формуле (табл. 1). 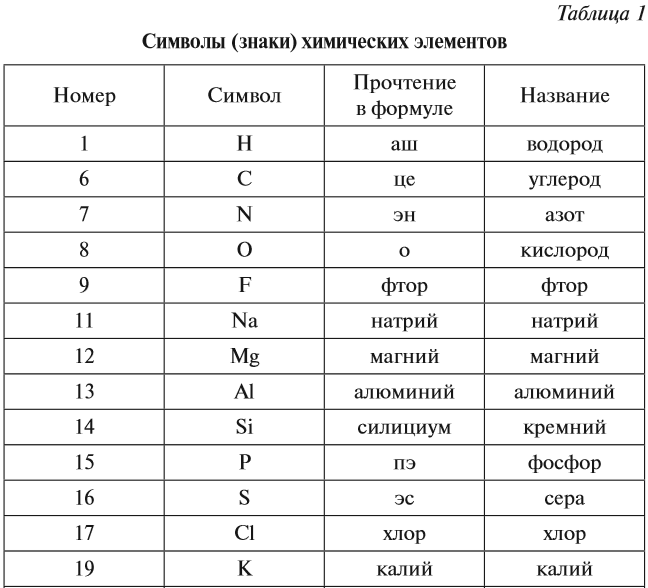 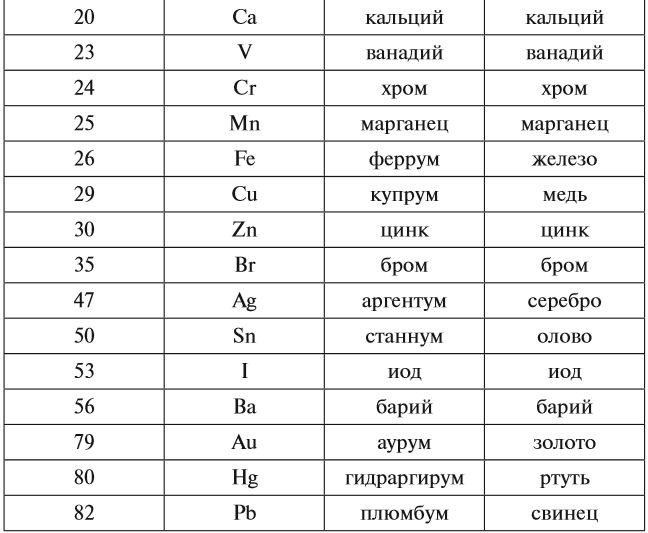
Подведём итог. Вещества состоят из молекул, молекулы состоят из атомов, атомы с одинаковым зарядом ядра относятся к одному и тому же химическому элементу. Но, если вещество состоит из молекул, то любое изменение состава или строения молекулы приводит к изменению самого вещества, его свойств. Вопрос. Чем отличаются химические формулы веществ: Н2О и Н2О2? Хотя по составу молекулы этих веществ отличаются на один атом кислорода, сами вещества по свойствам сильно отличаются друг от друга. Воду Н2О мы пьём и жить без неё не можем, а Н2О2 — перекись водорода, пить нельзя, а в быту её используют для обесцвечивания волос. Вопрос. А чем отличаются химические формулы веществ: 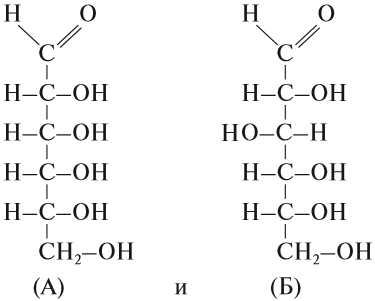
Состав этих веществ — аллозы (А) и глюкозы (Б) — одинаков — С6Н12О6. Отличаются они строением молекул, в данном случае — расположением групп ОН в пространстве. Глюкоза — универсальный источник энергии для большинства живых организмов, а аллоза практически не встречается в природе и не может быть источником энергии.  Тема: Простые и сложные вещества. Валентность Тема: Простые и сложные вещества. ВалентностьВещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, — это простое вещество: 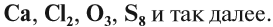
Если в состав вещества входят атомы только одного химического элемента — это простое вещество. Причём некоторые химические элементы образуют несколько простых веществ. Так, химический элемент кислород образует простое вещество «кислород» О2 и простое вещество «озон» О3*. * В 2002 г. появилось сообщение о существовании ещё одного простого вещества кислорода — O4.
А химический элемент углерод образует четыре простых вещества, причём ни одно из них не называется «углерод». Эти вещества отличаются пространственным расположением атомов: 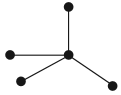
- Алмаз — атомы углерода находятся в вершинах воображаемых тетраэдров;
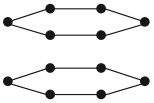
- Графит — атомы углерода находятся в одной плоскости;

- Карбин — атомы углерода образуют «нити».
В четвертой модификации «углерода» — фуллерене — атомы углерода образуют сферу, т. е. молекулы фуллерена напоминают мячик. Существование элемента в виде нескольких простых веществ называется аллотропией. Алмаз, графит, карбин, фуллерен — аллотропные модификации элемента «углерод», а кислород и озон — аллотропные модификации элемента «кислород». Таким образом, не следует путать эти понятия: «химический элемент» и «простое вещество», а также «молекула» и «атом». Очень часто в письменных записях слова «молекула» или «атом» заменяют соответствующими символами, но не всегда правильно. Так, нельзя писать: «В состав воды входит Н2», так как речь здесь идёт о химическом элементе водороде — Н. Нужно писать: «В состав воды входит (Н)». Аналогично, правильной будет запись: «При действии металла на раствор кислоты выделится Н2», т. е. вещество водород, молекула которого двухатомна. Молекулы сложных веществ состоят из атомов разных химических элементов: 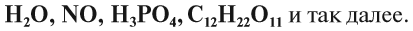
Как известно, в состав сложных веществ входят атомы разных химических элементов. Эти атомы соединяются между собой химическими связями: ковалентными, ионными, металлическими. Способность атома образовывать определённое число ковалентных химических связей называется валентностью. (Подробнее см. урок 4 «Химическая связь».) Правильнее всего определять валентность по графическим или структурным формулам: 
В таких формулах одна чёрточка обозначает одну ковалентную связь, т. е. «одну валентность». На практике чаще всего валентность определяют по молекулярной формуле, хотя здесь правильнее говорить о степени окисления элемента (см. урок 7). Иногда результат определения степени окисления соответствует реальному значению валентности, но бывают и неодинаковые результаты. |