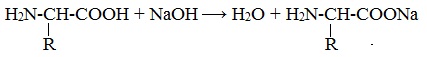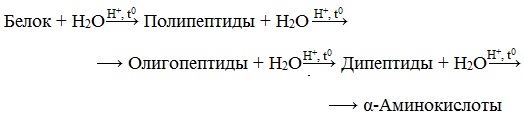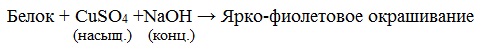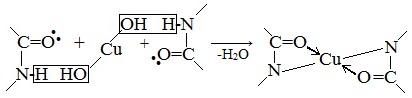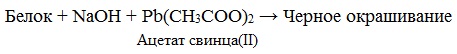26.12.22г. ПОНЕДЕЛЬНИК 506,406,405
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 506 ХИМИЯ 19,20
ТЕМА 19: Агрегатные состояния веществ и водородная связь. Твердое, жидкое и газообразное состояния веществ. Переход вещества из одного агрегатного состояния в другое. Водородная связь.
Агрегатные состояния веществ и водородная связь. Твердое, жидкое и газообразное состояния веществ. Переход вещества из одного агрегатного состояния в другое. Водородная связь.
Водородная связь. Образование водородной связи обусловлено спецификой водорода как элемента, атом которого состоит из протона и электрона. В соединениях водорода с атомами более электроотрицательных элементов на атоме водорода возникает частичный положительный заряд. Такой атом может взаимодействовать с неподеленными парами электронов атома электроотрицательного элемента соседней молекулы, в результате между молекулами возникает дополнительная межмолекулярная связь.
Водородная связь – это связь, которая образуется между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом сильно электроотрицательного элемента другой молекулы.
Чем больше электроотрицательность атома, с которым соединяется атом водорода, тем больше энергия водородной связи.
Водородная связь наиболее характерна для соединений фтора и кислорода, менее для соединений – азота. Образование водородной связи приводит к ассоциации (соединению) молекул.
Рассмотрим образование водородной связи между двумя молекулами воды. В молекуле воды связь О-Н сильно полярная. На атоме кислорода сосредоточен отрицательный заряд, а на атомах водорода – положительный. Это приводит к притяжению атома водорода одной молекулы воды к атому кислорода другой молекулы – возникает водородная связь.
В кристаллах льда, снега каждая молекула воды связана водородными связями с четырьмя соседними – за счет атомов водорода и двух неподеленных электронных пар атома кислорода. Следовательно, образование водородной связи обусловлено как электростатическим, так и донорно-акцепторным взаимодействием. В результате образуется ажурная (с большими пустотами) структура льда. Из-за этого плотность льда меньше, чем плотность воды.
Способностью к ассоциации обладают молекулы как неорганических, так и органических соединений (вода, аммиак, спирты и др.)
Водородная связь как и ковалентная, имеют направленность в пространстве и насыщаемость.
Длина водородной связи больше длины обычной ковалентной связи, энергия – в 10-20 раз меньше. В связи с этим водородные связи малоустойчивы и довольно легко разрываются (например, при таянии льда и кипении воды). Но на разрыв этих связей требуется дополнительная энергия, поэтому температуры плавления и кипения веществ, в которых молекулы ассоциированы, оказываются выше, чем у подобных веществ, но без водородных связей. Например, между молекулами фтороводорода и воды образуются водородные связи, а между молекулами хлороводорода и сероводорода – практически нет.
Водородная связь служит причиной некоторых важных особенностей воды – вещества, которое играет огромную роль в процессах, протекающих в живой и неживой природе. Она в значительной мере определяет свойства и таких биологически важных веществ, как белки и нуклеиновые кислоты, а поэтому имеет большое значение в химии жизненных процессов.
3. Газообразные, жидкие и твердые вещества.
Из курса физики и повседневной жизни вам известно, что в зависимости от условий окружающей среды, и в первую очередь от температуры и давления, вещества могут находиться в одном из трех основных агрегатных состояний: газообразном, жидком и твердом. Каждое агрегатное состояние отличается от другого расположением частиц друг относительно друга и характером их движения. При переходе вещества из одного состояния в другое состав его частиц не изменяется, изменяется лишь их взаимное расположение.
Газообразное состояние. В газообразном состоянии вещество не имеет собственной формы и объема. Оно занимает весь предоставленный ему объем и принимает форму сосуда. Газы обладают большой сжимаемостью и образуют однородные смеси. Эти свойства газов обусловлены тем, что расстояния между их молекулами в десятки раз превышают размер самих молекул. На таком расстоянии практически отсутствует межмолекулярное взаимодействие. Газообразное состояние характеризуется полной неупорядоченностью расположения молекул друг относительно друга. Молекулы в газах движутся хаотически. Если газы в смеси не реагируют между собой, то они сохраняют свою химическую индивидуальность, и поэтому многие физикохимические свойства таких систем могут быть выведены по правилу аддитивности: суммированием характеристик образующих их газов с учетом их мольных долей. Например, средняя молярная масса смеси газов X, Y, Z определяется так:
М(Х + Y + Z) = х(Х) • М(Х) + X(Y) • М(Y) + *(Z) • М(Z),
где х(Х), x(Y)> x(Z) — мольные доли газов X, Y, Z;
М(Х), М(Y), М(Z) — молярные массы газов X, Y, Z.
Четвертое агрегатное состояние — плазма, которая представляет собой ионизированный газ.
Жидкое состояние
В отличие от газов, в жидкостях молекулы расположены ближе друг к другу и удерживаются силами межмолекулярного взаимодействия (рис. 226). Это подтверждает, например, тот факт, что один объем воды образуется в результате конденсации 1300 объемов пара. Расстояние между частицами в жидкостях невелико, поэтому жидкости обладают незначительной сжимаемостью, при данной температуре им присущ определенный объем. Чтобы заметно уменьшить их объем, требуется очень большое давление. В то же время силы межмолекулярного притяжения в жидкостях недостаточно велики, чтобы придать им определенную форму. Молекулы в жидкости свободно перемещаются друг относительно друга, поэтому жидкости обладают текучестью и приобретают форму содержащего их сосуда.
Следовательно, жидкости по структуре и свойствам занимают промежуточное положение между газообразными и твердыми веществами. С повышением температуры жидкости усиливается беспорядок во взаимном расположении частиц, что приближает их к газам. При понижении температуры упорядоченность внутренней структуры возрастает, что сближает их с твердыми веществами.
Твердое состояние
В твердом агрегатном состоянии среднее расстояние между образующими вещество частицами сопоставимо с их размерами, а энергия взаимодействия значительно превышает их среднюю кинетическую энергию. Частицы, образующие твердое вещество, не могут свободно перемещаться друг относительно друга, они лишь совершают колебательные движения около положения равновесия. Этим объясняются наличие у твердых веществ определенного объема и формы, их механическая прочность и незначительная сжимаемость. В зависимости от строения и физических свойств твердые вещества подразделяют на аморфные и кристаллические.
Вещества в аморфном состоянии характеризуются некоторой упорядоченностью частиц, расположенных только в непосредственной близости друг от друга (так называемый ближний порядок), поэтому они изотропны, т. е. их физические свойства не зависят от направления. Проведем опыт. Нанесем на поверхность стекла тонкий ело расплавленного воска и дадим ему застыть. Коснемся застывшего вещества раскаленной иглой. Вокруг иглы воск расплавится. При этом пятно расплавленного воска примет форму круга. Следовательно, теплопроводность стекла не зависит от направления.
Аморфные вещества не имеют определенной температур плавления. При нагревании они постепенно размягчаются, начинают растекаться и, наконец, становятся жидкими. При охлаж- дении они так же постепенно затвердевают.
Аморфные вещества по структуре представляют собой переохлажденные жидкости. Подобно жидкостям они проявляют cвойства текучести, т. е. при длительном действии сравнительно не больших сил постепенно изменяют свою форму.
Примерами веществ в аморфном состоянии могут служить стекла, смолы, клеи, большинство полимеров и т. д.
Кристаллическое состояние
Большинство твердых веществ в окружающем нас мире являются кристаллическими. Для этого состояния характерно строго определенное расположение частиц во всем объеме кристалл (дальний порядок), поэтому в отличие от аморфных кристаллические вещества обладают анизотропией, т. е. их физические свойства (прочность, теплопроводность и т. д.) неодинако вы в различных направлениях. Так, если вышеописанный опыт проделать на гладкой поверхности гипса, то пятно расплавленного воска примет форму эллипса. Значит, теплопроводность гипса в одном направлении более высокая, чем в других.
Кристаллическое вещество в отличие от аморфного плавите; при строго определенной температуре, которую называют температурой плавления. Температура плавления — одно и важнейших физических свойств вещества, измеряя ее, можно определить чистоту данного вещества.
Тема 20:Чистые вещества и смеси. Понятие о смеси веществ. Гомогенные и гетерогенные смеси.
Чистое вещество содержит частицы только одного вида. Примерами могут служить серебро (содержит только атомы серебра), серная кислота и оксид углерода (IV) (содержат только молекулы соответствующих веществ). Все чистые вещества имеют постоянные физические свойства, например, температуру плавления (Тпл) и температуру кипения (Ткип).
Вещество не является чистым, если содержит какое-либо количество одного или нескольких других веществ – примесей.
Загрязнения понижают температуру замерзания и повышают температуру кипения чистой жидкости. Например, если в воду добавить соль, температура замерзания раствора понизится.
Смеси состоят из двух или более веществ. Почва, морская вода, воздух – все это примеры различных смесей. Многие смеси могут быть разделены на составные части – компоненты – на основании различия их физических свойств.
Различают гомогенные (однородные) и гетерогенные (неоднородные) смеси. Особенностью гомогенной смеси является то, что между компонентами такой смеси не наблюдается поверхности раздела. В этом случае говорят, что данная смесь является однофазной (фаза часть системы отделенная от других частей видимой поверхностью раздела). В пределах одной фазы физические свойства компонентов сохраняются постоянными. К гомогенным системам относятся истинные растворы (размер частиц растворенного вещества соотносится с размерами частиц растворителя и составляет ≤10-9м).
Особенностью гетерогенной смеси является то, что мы можем наблюдать поверхность раздела между ее компонентами. При переходе из одной фазы компонента в другую его свойства резко изменяются. Гетерогенные смеси иначе называются дисперсные системы. Дисперсные системы состоят из дисперсионной среды (растворитель, непрерывная фаза) и дисперсной фазы (растворенного вещества или прерывистой фазы)
К гетерогенным смесям относятся дисперсные системы (размер частиц растворенного вещества значительно превышает размер частиц растворителя и составляет ≥10-9м). Смеси, в которых размер частиц вещества составляет 10-7 -10-9 м, относятся к коллоидным системам.
К дисперсным системам относятся:
- суспензии, смесь, состоящая из твердой и жидкой фазы (обозначение Т/Ж; Т- дисперсная фаза, Ж – дисперсионная среда)
- эмульсии, смесь из 2-х и более несмешивающихся жидкостей (обозначение – Ж/Ж. Дисперсная фаза и дисперсионная среда жидкости различающиеся по плотности и температурам кипения).
Более подробно данные системы будут рассмотрены в теме растворы и дисперсные системы.
1.5. МЕТОДЫ РАЗДЕЛЕНИЯ СМЕСЕЙ
Традиционными методами, которые используются в лабораторной практике с целью разделения смесей на отдельные компоненты, являются:
фильтрование,
декантация (в химической лабораторной практике и химической технологии механическое отделение твёрдой фазы дисперсной системы (суспензии) от жидкой путём сливания раствора с осадка),
разделение с помощью делительной воронки,
центрифугирование,
выпаривание,
кристаллизация,
перегонка (в том числе фракционная перегонка),
хроматография,
возгонка и другие.
Фильтрование. Для отделения жидкостей от взвешенных в ней мелких твердых частиц применяют фильтрование (рис.37), т.е. процеживание жидкости через мелкопористые материалы – фильтры, которые пропускают жидкость и задерживают на своей поверхности твердые частицы. Жидкость, прошедшая через фильтр и освобожденная от находившихся в ней твердых примесей, называется фильтратом.
В лабораторной практике часто применяют гладкие и складчатые бумажные фильтры (рис.38), сделанные из непроклеенной фильтровальной бумаги.
Для фильтрования горячих растворов (например, с целью перекристаллизации солей), применяют специальную воронку для горячего фильтрования (рис.39) с электрическим или водяным обогревом).
Часто применяют фильтрование под вакуумом. Фильтрование под вакуумом используют для ускорения фильтрования и более полного освобождения твердой фазы от жидкой. Для этой цели собирают прибор для фильтрования под вакуумом (рис.40). Он состоит из колбы Бунзена, фарфоровой воронки Бюхнера, предохранительной склянки и вакуум-насоса (обычно водоструйного).
В случае фильтрования суспензии малорастворимой соли кристаллы последней могут быть промыты дистиллированной водой на воронке Бюхнера для удаления с их поверхности исходного раствора. Для этой цели используют промывалку (рис.41).
Декантация. Жидкости могут быть отделены от нерастворимых твердых частиц декантацией (рис.42). Этот метод можно применять, если твердое вещество имеет большую плотность, чем жидкость. Например, если речной песок добавить в стакан с водой, то при отстаивании он осядет на дно стакана, потому что плотность песка больше, чем воды. Тогда вода может быть отделена от песка просто сливанием. Такой метод отстаивания и последующего сливания фильтрата и называется декантацией.
Центрифугирование. Для ускорения процесса отделения очень мелких частиц, образующих в жидкости устойчивые суспензии или эмульсии, используют метод центрифугирования. Этим методом можно разделить смеси жидких и твердых веществ, различающихся по плотности. Разделение проводится в ручных или электрических центрифугах (рис.43).
Разделение двух несмешивающихся жидкостей, имеющих различную плотность и не образующих устойчивых эмульсий, можно осуществить с помощью делительной воронки (рис.44). Так можно разделить, например, смесь бензола и воды. Слой бензола (плотность = 0,879 г/см3) располагается над слоем воды, которая имеет большую плотность ( = 1,0 г/см3). Открыв кран делительной воронки, можно аккуратно слить нижний слой и отделить одну жидкость от другой.
Выпаривание (рис.45) – этот метод предусматривает удаление растворителя, например, воды из раствора в процессе нагревания его в выпарительной фарфоровой чашке. При этом выпариваемая жидкость удаляется, а растворенное вещество остается в выпарительной чашке.
Кристаллизация – это процесс выделения кристаллов твердого вещества при охлаждении раствора, например, после его упаривания. Следует иметь в виду, что при медленном охлаждении раствора образуются крупные кристаллы. При быстром охлаждении (например, при охлаждении проточной водой) образуются мелкие кристаллы.
Перегонка - метод очистки вещества основанный на испарении жидкости при нагревании с последующей конденсацией образовавшихся паров. Очистка воды от растворенных в ней солей (или других веществ, например, красящих) перегонкой называется дистилляцией, а сама очищенная вода – дистиллированной.
Фракционная перегонка (дистилляция) (рис.46) применяется для разделения смесей жидкостей с различными температурами кипения. Жидкость с меньшей температурой кипения закипает быстрее и раньше проходит через фракционную колонку (или дефлегматор). Когда эта жидкость достигает верха фракционной колонки, то попадает в холодильник, охлаждается водой и через аллонж собирается в приемник (колбу или пробирку).
Фракционной перегонкой можно разделить, например, смесь этанола и воды. Температура кипения этанола 780С, а воды 1000С. Этанол испаряется легче и первым попадает через холодильник в приемник.
Возгонка – метод применяется для очистки веществ, способных при нагревании переходить из твердого состояния в газообразное, минуя жидкое состояние. Далее пары очищаемого вещества конденсируются, а примеси, не способные возгоняться, отделяются.
ГРУППА 406 ХИМИЯ 36,37,38
ТЕМА 36 :Альдегиды. Понятие об альдегидах. Альдегидная группа как функциональная. Формальдегид и его свойства: окисление в соответствующую кислоту, восстановление в соответствующий спирт. Получение альдегидов окислением соответствующих спиртов. Применение формальдегида на основе его свойств.
Альдегиды - органические вещества, молекулы которых содержат карбонильную группу —![]() —, связанную с атомом водорода и углеводородным радикалом.
—, связанную с атомом водорода и углеводородным радикалом.
Общая формула альдегидов ![]() или R—CHO. Функциональная группа альдегидов (—CHO) называется альдегидной группой.
или R—CHO. Функциональная группа альдегидов (—CHO) называется альдегидной группой.
Альдегиды и кетоны называются карбонильными соединениями, их общая формула - CnH2nO.
Изомеры и гомологи
| г о м о л о г и | HCHO метаналь (формальдегид, муравьиный альдегид) | ||||||||||
| CH3CHO этаналь (ацетальдегид, уксусный альдегид) | |||||||||||
| CH3CH2CHO пропаналь (пропионовый альдегид) | CH3—CO—CH3 пропанон (ацетон) | ||||||||||
| CH3CH2CH2CHO бутаналь (масляный альдегид) | 2-метилпропаналь | бутанон (метилэтилкетон) | |||||||||
| и з о м е р ы В молекулах альдегидов, а тем более кетонов, в отличие от спиртов нет атомов водорода со значительным положительным частичным зарядом, поэтому между молекулами как альдегидов, так и кетонов нет водородных связей. Химические свойства Химические свойства альдегидов и кетонов в значительной степени обусловлены наличием в их молекулах сильно полярной карбонильной группы (связь
Он, в основном, используется в производстве смол — бакелита, галалита (в сочетании с мочевиной, меламином и фенолом), для дубления кож, протравливания зерна. Также из него синтезируют лекарственные средства (уротропин) используют как консервант биологических препаратов (благодаря способности свертывать белок). | |||||||||||
ТЕМА 37,38 :Карбоновые кислоты. Понятие о карбоновых кислотах. Карбоксильная группа как функциональная. Гомологический ряд предельных однооснóвных карбоновых кислот. Получение карбоновых кислот окислением альдегидов .Химические свойства уксусной кислоты: общие свойства с минеральными кислотами и реакция этерификации. Свойства уксусной кислоты, общие со свойствами минеральных кислот. Применение уксусной кислоты на основе свойств.
Карбоновые кислоты - органические вещества, молекулы которых содержат одну или несколько карбоксильных групп.
Карбоксильная группа ![]() (сокращенно —COOH) - функциональная группа карбоновых кислот - состоит из карбонильной группы и связанной с ней гидроксильной группы.
(сокращенно —COOH) - функциональная группа карбоновых кислот - состоит из карбонильной группы и связанной с ней гидроксильной группы.
По числу карбоксильных групп карбоновые кислоты делятся на одноосновные, двухосновные и т.д.
Общая формула одноосновных карбоновых кислот R—COOH. Пример двухосновной кислоты - щавелевая кислота HOOC—COOH.
По типу радикала карбоновые кислоты делятся на предельные (например, уксусная кислота CH3COOH), непредельные [например, акриловая кислота
Изомеры и гомологи
Одноосновные предельные карбоновые кислоты R—COOH являются изомерами сложных эфиров ![]() (сокращенно R'—COOR'') с тем же числом атомов углерода. Общая формула и тех, и других CnH2nO2.
(сокращенно R'—COOR'') с тем же числом атомов углерода. Общая формула и тех, и других CnH2nO2.
| г о м о л о г и | HCOOH метановая (муравьиная) | ||||
| CH3COOH этановая (уксусная) | HCOOCH3 метиловый эфир муравьиной кислоты | ||||
| CH3CH2COOH пропановая (пропионовая) | HCOOCH2CH3 этиловый эфир муравьиной кислоты | CH3COOCH3 метиловый эфир уксусной кислоты | |||
бутановая (масляная) | 2-метилпропановая | HCOOCH2CH2CH3 пропиловый эфир муравьиной кислоты | CH3COOCH2CH3 этиловый эфир уксусной кислоты | CH3CH2COOCH3 метиловый эфир пропионовой кислоты | |
| и з о м е р ы | |||||
Алгоритм составления названий карбоновых кислот
- Найдите главную углеродную цепь - это самая длинная цепь атомов углерода, включающая атом углерода карбоксильной группы.
- Пронумеруйте атомы углерода в главной цепи, начиная с атома углерода карбоксильной группы.
- Назовите соединение по алгоритму для углеводородов.
- В конце названия допишите суффикс "-ов", окончание "-ая" и слово "кислота".
В молекулах карбоновых кислот p-электроны атомов кислорода гидроксильной группы взаимодействуют с электронами ![]() -связи карбонильной группы, в результате чего возрастает полярность связи O—H, упрочняется
-связи карбонильной группы, в результате чего возрастает полярность связи O—H, упрочняется ![]() -связь в карбонильной группе, уменьшается частичный заряд (
-связь в карбонильной группе, уменьшается частичный заряд (![]() +) на атоме углерода и увеличивается частичный заряд (
+) на атоме углерода и увеличивается частичный заряд (![]() +) на атоме водорода.
+) на атоме водорода.

Последнее способствует образованию прочных водородных связей между молекулами карбоновых кислот.
Физические свойства предельных одноосновных карбоновых кислот в значительной степени обусловлены наличием между молекулами прочных водородных связей (более прочных, чем между молекулами спиртов). Поэтому температуры кипения и растворимость в воде у кислот больше, чем у соответствующих спиртов.
Химические свойства кислот
Упрочнение ![]() -связи в карбонильной группе приводит к тому, что реакции присоединения для карбоновых кислот нехарактерны.
-связи в карбонильной группе приводит к тому, что реакции присоединения для карбоновых кислот нехарактерны.
- Горение:CH3COOH + 2O2
 2CO2 + 2H2O
2CO2 + 2H2O - Кислотные свойства.
Из-за высокой полярности связи O-H карбоновые кислоты в водном растворе заметно диссоциируют (точнее, обратимо с ней реагируют):HCOOH HCOO- + H+ (точнее HCOOH + H2O
HCOO- + H+ (точнее HCOOH + H2O  HCOO- + H3O+)
HCOO- + H3O+)
Все карбоновые кислоты - слабые электролиты. С увеличением числа атомов углерода сила кислот убывает (из-за снижения полярности связи O-H); напротив, введение атомов галогена в углеводородный радикал приводит к возрастанию силы кислоты. Так, в рядуHCOOH CH3COOH
CH3COOH  C2H5COOH
C2H5COOH
сила кислот снижается, а в рядуCH3COOH 
CH2ClCOOH 
CHCl2COOH 
CCl3COOH уксусная кислота монохлоруксусная кислота дихлоруксусная кислота трихлоруксусная кислота
- возрастает.
Карбоновые кислоты проявляют все свойства, присущие слабым кислотам:Mg + 2CH3COOH (CH3COO)2Mg + H2
(CH3COO)2Mg + H2
CaO + 2CH3COOH (CH3COO)2Ca + H2O
(CH3COO)2Ca + H2O
NaOH + CH3COOH CH3COONa + H2O
CH3COONa + H2O
K2CO3 + 2CH3COOH 2CH3COOK + H2O + CO2
2CH3COOK + H2O + CO2
- Этерификация (реакция карбоновых кислот со спиртами, приводящая к образованию сложного эфира):



+ H2O муравьиная кислота этанол этиловый эфир
муравьиной кислоты
В реакцию этерификации могут вступать и многоатомные спирты, например, глицерин. Сложные эфиры, образованные глицерином и высшими карбоновыми кислотами (жирными кислотами) - это жиры.
+ 


+ 3H2O глицерин карбоновые кислоты триглицерид
Жиры представляют собой смеси триглицеридов. Предельные жирные кислоты (пальмитиновая C15H31COOH, стеариновая C17H35COOH) образуют твердые жиры животного происхождения, а непредельные (олеиновая C17H33COOH, линолевая C17H31COOH и др.) - жидкие жиры (масла) растительного происхождения. - Замещение в углеводородном радикале:
CH3—CH2—COOH + Cl2 
CH3—CHCl—COOH + HCl пропионовая кислота  -хлорпропионовая кислота
-хлорпропионовая кислота
Замещение протекает в -положение.
-положение.
Особенность муравьиной кислоты HCOOH состоит в том, что это вещество - двуфункциональное соединение, оно одновременно является и карбоновой кислотой, и альдегидом:
Поэтому муравьиная кислота кроме всего прочего реагирует и с аммиачным раствором оксида серебра (реакция серебряного зеркала; качественная реакция):HCOOH + Ag2O(аммиачный раствор) CO2 + H2O + 2Ag
CO2 + H2O + 2Ag
Получение карбоновых кислот
- Окисление альдегидов.
В промышленности: 2RCHO + O2 2RCOOH
2RCOOH
Лабораторные окислители: Ag2O, Cu(OH)2, KMnO4, K2Cr2O7 и др. - Окисление спиртов: RCH2OH + O2
 RCOOH + H2O
RCOOH + H2O - Окисление углеводородов: 2C4H10 + 5O2
 4CH3COOH + 2H2O
4CH3COOH + 2H2O - Из солей (лабораторный способ): CH3COONaкр. + H2SO4 конц.
 CH3COOH
CH3COOH + NaHSO4
+ NaHSO4
Белки в природе Белки – это молекулы жизни. Каждый живой организм содержит большое количество различных белковых молекул, при этом каждому виду присущи особые, свойственные только ему белки. Даже белки, выполняющие у различных видов одну и ту же функцию, отличаются друг от друга. Например, у всех позвоночных животных – рыб, птиц, млекопитающих – красные клетки крови содержат белок гемоглобин, переносящий кислород. Но гемоглобин у каждого вида животных свой, особенный. Молекула гемоглобина лошади отличается от соответствующего белка человека в 26 местах, свиньи – в 10 местах, а гориллы – всего лишь одной аминокислотой. Функции белков в организме очень разнообразны. Есть белки – переносчики веществ (молекул, ионов) и электронов; есть биокатализаторы, ускоряющие реакции в миллиарды раз и отличающиеся удивительной специфичностью, есть регуляторы различных биологических процессов в организме – гормоны, например, инсулин, вазопрессин, окситоцин. Белки защищают организм от инфекции, они способны узнавать и уничтожать чужеродные объекты: вирусы, бактерии, клетки. Контакты клетки с внешней средой также выполняют разнообразные белки, умеющие различать форму молекул, регистрировать изменение температуры, ничтожные примеси веществ, отличать один цвет от другого. Свойства белков Свойства белков весьма разнообразны и определяются их строением. 1. По растворимости в воде белки делятся на два класса: глобулярные белки – растворяются в воде или образуют коллоидные растворы; фибриллярные белки – в воде нерастворимы. 2. Денатурация. При нагревании, изменении кислотности среды происходит разрушение вторичной и третичной структуры белка с сохранением первичной. Это явление называют денатурацией. Денатурация — частичное или полное разрушение пространственной структуры белка (при сохранении им первичной структуры) под действием физических или химических факторов (нагревание, радиация, действие кислот, щелочей и т.д.). Денатурация происходит, например, при варке мяса или яиц. Пример денатурации – свертывание яичных белков при варке яиц. Денатурация бывает обратимой (при употреблении алкоголя, солёной пищи) и необратимой. Необратимая денатурация может быть вызвана высокими температурами, радиацией, при отравлении организма солями тяжелых металлов, спиртами, кислотами. ВИДЕО: Свертывание белков при нагревании Осаждение белков солями тяжелых металлов 3. Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот. Анализируя продукты гидролиза, можно установить количественный состав белков. Гидролиз белков происходит при нагревании с растворами кислот, щелочей или при действии ферментов по месту пептидных связей:  4. Для белков известно несколько качественных реакций. Качественные (цветные) реакции на белки
раствор белка + HN03 (конц) —> желтое окрашивание 3. Реакция с ацетатом свинца (II) (на содержание серы): раствор белка + Pb(CH3COO)2 + NaOH —> черный осадок 1. Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе. Эта реакция называется биуретовой. ВИДЕО: ВИДЕО: 2. Белки, содержащие остатки ароматических аминокислот (фенилаланин, тирозин) дают желтое окрашивание при действии концентрированной азотной кислоты – ксантопротеиновая реакция. ВИДЕО: ВИДЕО: Качественные реакции на белки: биуретовая и ксантопротеиновая Ксантопротеиновая реакция белков 5. Амфотерные свойства белков Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма. Молекулы белков содержат карбоксильные и аминогруппы, следовательно, они обладают амфотерными свойствами и образуют соли как с кислотами, так и с основаниями: |
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
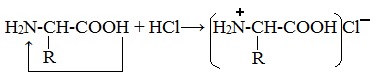
1. Амфотерные свойства белков
Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
При действии же кислот он выступает в форме катиона:
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
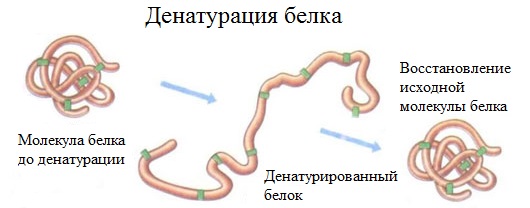
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
Необратимая денатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg2+, Pb2+, Си2+).
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-700С), теряя способность растворяться в воде.
Видеоопыт «Свертывание белков при нагревании»
Видеоопыт «Осаждение белков солями тяжелых металлов»
Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.
Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина: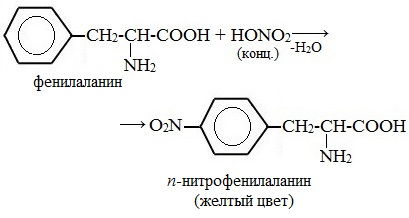
Видеоопыт «Ксантопротеиновая реакция на белки»
б) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.
Причина появления окраски – образование комплексных соединений с координационным узлом: 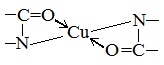
Видеоопыт «Биуретовая реакция белков»
Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Видеоопыт «Качественное определение азота в органических соединениях»
Белки входят в состав каждой клетки и составляют около 50% ее сухой массы. Они играют ключевую роль в обмене веществ, реализуют важнейшие биологические функции, лежащие в основе жизнедеятельности всех организмов.
Среди большого разнообразия функций, выполняемых белками, первостепенное значение имеют структурная, или пластическая, и каталитическая. Это универсальные функции, поскольку они присущи всем живым организмам.
Структурные белки формируют каркас внутриклеточных органелл и внеклеточных структур, а также участвуют в стабилизации клеточных мембран. Такие структурные белки, как коллаген и эластин составляют основу соединительной и костной тканей высших животных и человека. Структурными белками, в частности, являются кератины кожи, волос, ногтей, шерсти, когтей, рогов, копыт, перьев, клювов, а также фиброин шелка, паутины.
Каталитически активными белками являются ферменты. Они ускоряют химические реакции, обеспечивая тем самым необходимые скорости протекания обменных процессов в клетке.
Многие белки, присущие отдельным живым организмам, выполняют специфические функции, среди которых наиболее важными являются транспортная, регуляторная, защитная, рецепторная, сократительная, запасная и некоторые др.
Транспортные белки переносят различные молекулы и ионы внутри организма. Например: гемоглобин — кислород от легких к тканям; миоглобин — кислород внутри клеток; сывороточный альбумин с током крови — жирные кислоты, а также ионы некоторых металлов. Ту же функцию выполняют специфические белки, транспортирующие различные вещества через клеточные мембраны.
Регуляторные белки участвуют в регуляции обмена веществ как внутри клеток, так и в целом организме. Например, такие сложные процессы, как биосинтез белков и нуклеиновых кислот, протекают под строгим «контролем» множества регуляторных белков. Специфические белковые ингибиторы регулируют активность многих ферментов.
Защитные белки формируют защитную систему живых организмов. Например, иммуноглобулины (антитела) и интерфероны предохраняют организм от проникновения в его внутреннюю среду вирусов, бактерий, чужеродных соединений, клеток и тканей. Белки свертывающей системы крови — фибриноген, тромбин — препятствуют потере крови при повреждениях кровеносных сосудов.
Рецепторные белки воспринимают сигналы, поступающие из внешней среды, и воздействуют на внутриклеточные процессы. Например, белки-рецепторы, сосредоточенные на поверхности клеточных мембран, избирательно взаимодействуют с регуляторными молекулами (например, гормонами).
Рецепторными белками являются родопсин, участвующий в зрительном акте, вкусовой сладкочувствительный и обонятельный белки.
Сократительные белки способны преобразовывать свободную химическую энергию в механическую работу. Например, белки мышц миозин и актин обеспечивают мышечное сокращение.
Запасные белки представляют собой резервный материал, предназначенный для питания развивающихся клеток. Запасными белками являются яичный альбумин, глиадин пшеницы,
Казеин кукурузы, казеин молока и многие другие. Запасные белки — существенный источник пищевого белка для человека.
Некоторые организмы вырабатывают токсические белки. Таковы яды змей, дифтерийный токсин, рицин семян клещевины, лектины семян бобовых и др.