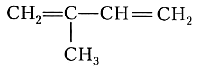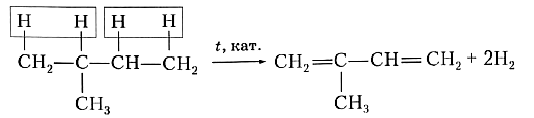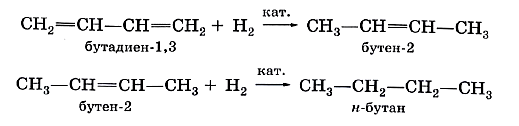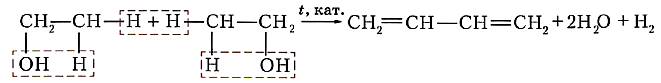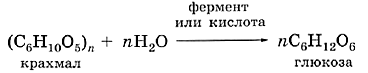ПОНЕДЕЛЬНИК, 15.11.21г. 306, 308, 208,301
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 306 ХИМИЯ 25,26
ТЕМА: Применение этилена на основе свойств.
ПРОСМОТРИТЕ ВИДЕО И ЗАПИШИТЕ КОНСПЕКТ СОГЛАСНО ТЕМЕ УРОКА, ОТВЕТЬТЕ НА ВОПРОС, ГДЕ ПРИМЕНЯЕТСЯ ЭТИЛЕН?
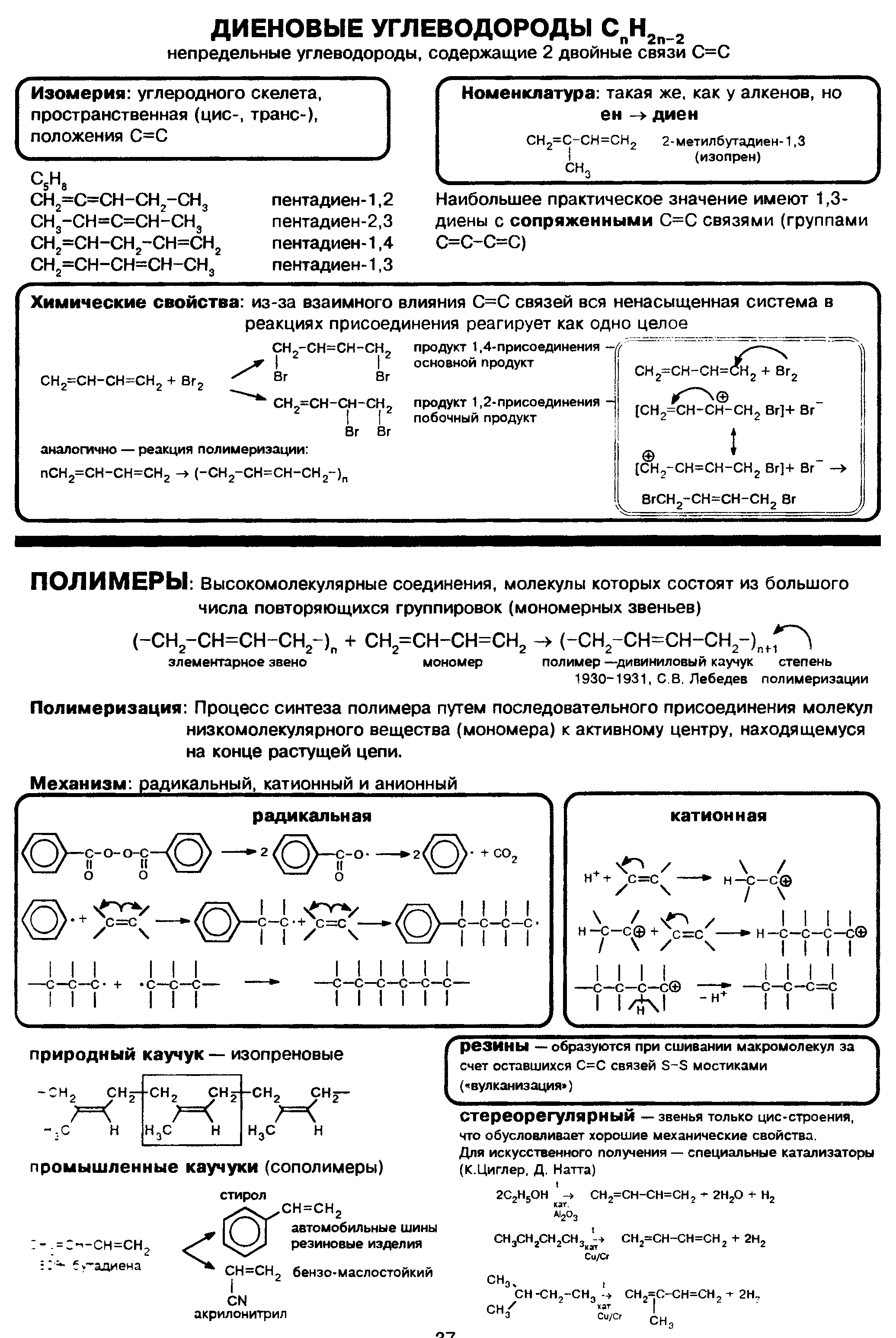
ТЕМА:Диены и каучуки. Понятие о диенах как углеводородах с двумя двойными связями. Сопряженные диены. Понятие о сопряжённых алкадиенахВ молекуле органического вещества может содержаться не только одна, но две и более двойные углерод-углеродные связи. Если вы правильно истолковали международное название класса алкадиены, то суффикс -ди- вы перевели как «два», а суффикс -ен- означает двойную связь С=С.
В соответствии с третьим положением теории химического строения даже незначительные изменения в структуре вещества могут существенно изменить его химические свойства, а следовательно, сделать незаменимым для производства жизненно необходимых материалов. Не будь углеводородов этого класса, нам пришлось бы обходиться без резины и каучука, а точнее без всего бесчисленного ассортимента изделий, изготовленных из этих материалов. Большое значение в производстве каучуков имеют диеновые углеводороды особого строения: в их молекулах две двойные связи разделены одной одинарной. Такие диены называют сопряжёнными диенами. Простейший сопряжённый диен — бутадиен-1,3 имеет формулу СН2=СН—СН=СН2. Как видите, в международных названиях алкадиенов указывают номера обоих атомов углерода, от которых начинаются двойные связи в молекуле. Ещё один важнейший диеновый углеводород — 2-метилбутадиен-1,3 (его чаще называют изопрен) имеет формулу
Способы получения алкадиеновДля получения диеновых углеводородов в промышленности используют реакцию дегидрирования, т. е. отщепления водорода. В качестве исходного вещества берут предельный углеводород с тем же строением углеродной цепи, что и у получаемого продукта. Понятно, что для образования двух двойных связей С=С алкан должен отдать четыре атома, т. е. две молекулы водорода. Например, для синтеза изопрена в качестве исходного вещества необходимо взять 2-метилбутан: или Рассмотренная реакция наглядно показывает, что в составе алкадиенов на четыре атома водорода меньше, чем в молекулах соответствующих предельных углеводородов, и на два атома водорода меньше, чем в молекулах соответствующих алкенов.  (с) Цитата из справочного издания «ХИМИЯ. Справочник в таблицах / М.: Издательство АЙРИС-пресс»
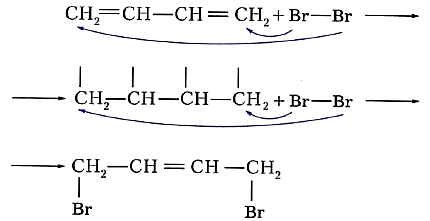
Алкадиены. Химические свойстваБудучи непредельными углеводородами, алкадиены, подобно алкенам, склонны к реакциям присоединения. Они так же, как алкены, обесцвечивают бромную воду и раствор перманганата калия. Особенность реакций присоединения диеновых углеводородов состоит в том, что две сопряжённые связи проявляют себя как единое целое. Присоединение галогена происходит не по одной двойной связи, а за счёт крайних атомов углерода сопряжённой системы двойных связей: или Продукт реакции 1,4-дибромбутен-2 также содержит двойную связь и, следовательно, тоже способен присоединять молекулу брома: Аналогичным образом диеновые углеводороды присоединяют водород (реакция гидрирования):
Каучук и продукты его вулканизацииСопряжённые диеновые углеводороды способны к реакциям полимеризации, в результате которых получают синтетические каучуки. Каучуки можно рассматривать как продукты полимеризации сопряжённых диенов или их производных. Каучуки относят к эластомерам. Такое название эти полимеры получили потому, что обладают эластичностью (от греч. elastikos — растяжимый), т. е. способностью обратимо изменять форму под действием внешних сил. Другие ценные свойства каучуков — водо- и газонепроницаемость — также широко используют в промышленном производстве. Природными источниками каучука служат растения, богатые млечным соком: гевея, фикусы, молочаи, одуванчики. В промышленных масштабах натуральный (природный) каучук получают из сока тропического дерева гевеи. Такой каучук можно рассматривать как продукт полимеризации изопрена, или 2-метилбутадиена-1,3. Чувствительность натурального каучука к перепадам температур и потерю при этом эластичности устраняет его вулканизация. Этот процесс заключается в «сшивании» полимерных цепей атомами серы при нагревании за счёт разрыва некоторой части двойных связей в этих цепях. Так получают резину. Если же «сшить» полимерные цепи каучука атомами серы за счёт разрыва подавляющего большинства двойных связей, то образуется эбонит, который уже не обладает эластичностью. Из него раньше изготавливали детали электрической арматуры, так как он хороший диэлектрик. Каучуконосы нашей страны (одуванчики кок-сагыз и тау-сагыз) содержат очень мало млечного сока, а потому не могут использоваться в качестве источника натурального каучука. Проблему получения синтетического каучука решил коллектив учёных под руководством академика С. В. Лебедева в 1931 г. Этот каучук назвали бутадиеновым каучуком, поскольку в качестве мономера для его получения был выбран бутадиен-1,3. В процессе полимеризации двойные связи алкадиена разрываются, за счёт освободившихся валентностей крайних углеродных атомов растёт полимерная цепь. Одновременно с этим между центральными атомами углерода образуется двойная связь: nСН2=СН—СН=СН2 → (—СН2—СН=СН—СН2—)„ Коллективом под руководством С. В. Лебедева был разработан также уникальный способ получения исходного диенового углеводорода — бутадиена-1,3 — на основе этилового спирта: или Эту реакцию называют реакцией Лебедева. Синтетический бутадиеновый каучук обладает такими ценными качествами, как газо- и водонепроницаемость, однако уступает натуральному в эластичности. В 60-х гг. прошлого столетия был получен эластичный синтетический каучук на основе изопрена — синтетический изопреновый каучук: По эластичности и износоустойчивости изопреновый каучук сходен с природным и так же, как бутадиеновый, используется для производства шин. Общая формула СnH2n-2 отражает состав не только алкадиенов, но и ацетиленовых углеводородов. Речь о них пойдёт в следующем конспекте.
Таблица «Диеновые углеводороды. Полимеры»
ГРУППА 308 ХИМИЯ 27,28 ТЕМА: 1. Крахмал, его строение, химические свойства, применение. 2.Целлюлоза, ее строение и химические свойства. ПОСМОТРИТЕ ВИДЕО И ЗАПИШИТЕ КОНСПЕКТ ПолисахаридыМогут ли соединяться друг с другом не два, а больше остатков моносахаридов? Да, причём сотни и даже тысячи. Такие вещества имеют полимерную природу; их называют полисахаридами. К полисахаридам, например, относят крахмал и целлюлозу. Природные полимеры, состоящие из большого числа повторяющихся остатков моносахаридов, называют полисахаридами. Крахмал представляет собой порошок белого цвета, зёрна которого набухают в горячей воде с образованием крахмального клейстера. Крахмал, как все ди- и полисахариды, подвергается гидролизу. Значит, крахмал представляет собой полимер, звенья молекулярной цепи которого — остатки молекул глюкозы. Тогда, «вычитая» из формулы глюкозы формулу воды, вы получите формулу крахмала: (С6Н10О5)n. Уравнение реакции гидролиза крахмала записывают следующим образом: Качественная реакция на крахмал — действие спиртового раствора йода, при котором появляется интенсивное синее окрашивание. Попробуйте обнаружить крахмал в картофеле, муке, хлебе, зёрнах бобовых, макаронных изделиях и других пищевых продуктах. Потребляемый с продуктами питания крахмал в организме человека под действием ферментов гидролизуется. Образующаяся глюкоза попадает в кровь и разносится по всему организму к клеткам. Другой представитель полисахаридов — целлюлоза — значительно труднее подвергается гидролизу. У травоядных животных в процессе пищеварения участвуют ферменты и бактерии, под влиянием которых происходит брожение, в результате чего целлюлоза разрушается до мономеров. Продуктом гидролиза целлюлозы также является глюкоза: Крахмал и целлюлоза — это изомерные полисахариды, молекулярная формула которых совпадает. Однако строение полимерных молекул этих углеводов несколько различается. Отсюда и такое различие в свойствах как физических, так и химических. Целлюлоза — полимер с линейными макромолекулами, поэтому для неё характерна волокнистая структура. Качественная реакция на крахмал отрицательная (не появляется ярко-синее окрашивание). Обработка целлюлозы азотной кислотой в присутствии концентрированной серной кислоты позволяет получать взрывчатые вещества (бездымный порох, или пироксилин), полимерную основу для производства нитрокрасок, лаков, эмалей. По названию легко догадаться, что целлофан — это полимерный материал на основе целлюлозы, его используют в качестве упаковочного материала. Огромные количества целлюлозы из еловой древесины расходуют на изготовление бумаги. Человек издавна использовал природные волокна целлюлозы для изготовления тканей, например хлопчатобумажных, льняных. Со временем химики научились обрабатывать полимерные цепи целлюлозы различными реагентами, получая химически модифицированные волокна — вискозу, ацетилцеллюлозу. Об этих волокнах пойдёт речь в параграфе, посвящённом искусственным полимерам. ГРУППА 208 химия 7 ВНИМАНИЕ! НЕ ЗАБЫВАЕМ ГОТОВИТЬСЯ К ЭКЗАМЕНУ! Тема: СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ,ЕЕ ЗАВИСИМОСТЬ ОТ РАЗЛИЧНЫХ ФАКТОРОВ. ЗАКОН ДЕЙСТВУЮЩИХ МАСС. ВНИМАТЕЛЬНО СМОТРИТЕ ВИДЕО , ЗАПИСЫВАЙТЕ КОНСПЕКТ, ЗАДАЧУ. ГОТОВИМСЯ СДАВАТЬ ЭКЗАМЕНЫ. |
ТЕМА: Алкены. Этилен и его получение (дегидрирование этана, дегидратация этанола). Химические свойства этилена (горение, качественные реакции), гидратация, полимеризация. Полиэтилен, его свойства, применение.
Алкены - ненасыщенные углеводороды с общей формулой CnH2n, в молекулах которых имеется одна двойная связь С=С.
Особенности строения молекул
В этилене углерод находится в состоянии sp2-гибридизации (в гибридизации участвуют одна s и 2 p-орбитали). У каждого атома углерода в молекуле этилена – 3 гибридные sp2-орбитали и по одной негибридной р-орбитали. Оси гибридных орбиталей располагаются в одной плоскости, а угол между ними равен 120°.Такие орбитали каждого атома углерода пересекаются с аналогичными другого атома углерода и s-орбиталями двух атомов водовода, образуя σ-связи С-С и С-Н.
Схема образования σ-связей в молекуле этилена

Две негибридных р-орбитали атомов углерода взаємно перекрываются в плоскости, которая расположена перпендикулярно к плоскости σ-связей, образуя одну π-связь.
Схема образования π-связи в молекуле этилена

Особенности номенклатуры алкенов
Принадлежность углеводорода к классу алкенов отражают суффиксом –ен:
С2Н4 CH2=CH2 этен (этилен)
С3Н6 CH2=CH2-СН3 пропен (пропилен)
С4Н8 CH2=CH2-СН2-СН3 бутен
и т.д.
Чтобы назвать алкен, соединение нумеруют, начиная с того конца, к которому ближе двойная связь.
Положение двойной связи указывают в конце названия номером того атома углерода, от которого она начинается.

Изомерия алкенов
Структурная изомерия.
Изомерия строения углеродной цепи.
Изомерия положения двойной связи.

Пространственная изомерия.
Геометрическая изомерия (цис-/транс-)

Физические свойства
C2H4 – C4H8 – газы, С5Н10 – С17Н34 – жидкости, С18Н36 и выше – твердые вещества.
Получение
В промышленности – из природного газа и при процессах крекинга и пиролиза нефти.
Дегидратация (отщепление воды) спиртов.

Дегидрирование алканов.

Из галогенпроизводных (дегидрогалогенирование)
 :
:
2-бромпропан пропен
Реакции дегидрогалогенирования и дегидратации идут по правилу Зайцева:
Водород отщепляется от соседнего менее гидрированного атома углерода.

И др.
Химические свойства
Реакции присоединения
Взаимодействие с галогенами
Качественная реакция на наличие двойных связей – обесцвечивание бромной воды!

Гидрирование.

kt – Ni, Pt, Pd.
Гидратация (присоединение воды)

Реакции гидратации идут в присутствии серной или ортофосфорной кислот.
1.4 Реакция с галогенводородами (гидрогалогенирование).


Реакции окисления.
Горение.
![]()
Реакция с раствором перманганата калия.
Обесцвечивание раствора перманганата калия (ярко-розовая окраска) – качественная реакция на двойную C=C связь!

Кроме раствора KMnO4, можно использовать другие мягкие оксилители.
Частичное оксиление кислородом воздуха.

Реакции полимеризации.

Катализаторы катионной полимеризации – кислоты, пероксиды, например – H2O2.
Реакция полимеризации – химический процесс соединения множества исходных молекул низкомолекулярного вещества (мономера) в крупные молекулы(макромолекулы) полимера.
Полимер – высокомолекулярное соединение, молекулы которого состоят из множества одинаковых структурных звеньев.
Применение этилена – сырье для производства горючего, пластмасс, взрывчатых веществ, антифризов, растворителей, ацетальдегида, этилового спирта, синтетического каучука, уксусной кислоты и др.
Применение полиэтилена – материал для изготовления медицинского оборудования, предметов домашнего обихода, тары, пленок, клейкой ленты, деталей и др.
САМОПРОВЕРКА.
Как получают этилен: а) в промышленности, б) в лаборатории.
По аналогии с этиленом напишите уравнения реакций получения пропена: а) из пропана, б) из пропанола-1.
С помощью каких реакций можно отличить этилен от этана?