ПОНЕДЕЛЬНИК. 02.11.20Г. 206, 303,308, 301,108.
Гр.206. Тема:
Диены и каучуки. Понятие о диенах как
углеводородах с двумя двойными связями. Сопряженные диены.Диеновые углеводороды (Алкадиены)Диеновые углеводороды или алкадиены - это непредельные углеводороды, содержащие две двойные углерод - углеродные связи. Общая формула алкадиенов CnH2n-2.
2) углеводороды с изолированными двойными связями, т.е разделенными двумя и более простыми связями. Например, пентадиен -1,4 CH2=CH-CH2-CH=CH2; 3) углеводороды с сопряженными двойными связями, т.е. разделенными одной простой связью. Например, бутадиен -1,3 или дивинил CH2=CH-CH=CH2, 2-метилбутадиен -1,3 или изопрен
Наибольший интерес представляют углеводороды с сопряженными двойными связями. Получение
CH3-CH2-CH2-CH3 --~600°С;Cr2O3,Al2O3® CH2=CH-CH=CH2 + 2H2
2CH3CH2OH --~450°С;ZnO,Al2O3® CH2=CH-CH=CH2 + 2H2O + H2
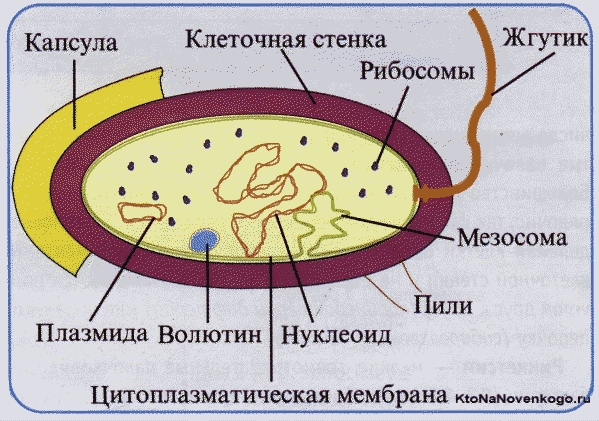
ТЕМА:ЯДРО. ПРОКАРИОТЫ.ЭУКАРИОТЫ. ПЛАЗМОЛИЗ. Задание, просмотрите видео, запишите лаб.работу., ответьте на вопросы.Лабораторная работа №1 Тема: плазмолиз и деплазмолиз в клетках кожицы лука Цель: сформировать умение проводить опыт по получению плазмолиза, закрепить умения работать с микроскопом, проводить наблюдение и объяснять полученные результаты. Оборудование: микроскопы, предметные и покровные стекла, стеклянные палочки, стаканы с водой, фильтровальная бумага, раствор поваренной соли, репчатый лук. Ход работы 1. Приготовьте препарат кожицы лука, рассмотрите клетки под микроскопом. Обратите внимание на расположение цитоплазмы относительно клеточной оболочки. 2. Удалите с микропрепарата воду, приложив фильтровальную бумагу к краю покровного стекла. Нанесите на предметное стекло каплю раствора поваренной соли. Наблюдайте за изменением положения цитоплазмы. 3. Фильтровальной бумагой удалите раствор поваренной соли. Капните на предметное стекло 2-3 капли воды. Наблюдайте за состоянием цитоплазмы. 4. Объясните наблюдаемое явление. Ответьте на вопросы: куда двигалась вода (в клетки или из них) при помещении ткани в раствор соли? Чем можно объяснить такое направление движения воды? Куда двигалась вода при помещении ткани в воду? Чем это объясняется? Как вы думаете, что бы могло произойти в клетках, если бы их оставили в растворе соли на длительное время? Можно ли использовать раствор соли для уничтожения сорняков? ТЕМА:прокариоты, эукариоты.(303 гр.) Термины «прокариоты» и «эукариоты» были предложены французским ботаником Э.Шаттоном в 1925 г. Деление организмов на прокариотические и эукариотические сохранялось довольно долго (до 1990-х гг.), пока американский микробиолог К.Вёзе не обнаружил, что в среде прокариотов находится большая группа особей с существенными генетическими различиями. В этой связи он предложил разделить прокариотов на бактерии и археи. В настоящий момент разделение живых организмов на эукариотов, бактерии и археи считается общепризнанным. Прокариоты — это...
Прокариоты – самая представительная форма жизни на Земле по количеству видов. Например, 1 грамм плодородной почвы может содержать порядка 10 млрд.бактериальных клеток.
У прокариотов молекула органического вещества не отделена от цитоплазмы, а прикреплена к клеточной мембране. У них, как правило, бесполый способ размножения, а ДНК имеет кольцевую форму. У большинства прокариотов геном (что это?) представлен одиночной хромосомой. 
Их можно обнаружить в океанических глубинах, на горных вершинах, во льдах Антарктиды и Арктики. В атмосфере споры бактерий присутствуют на высоте до 15 км, а в грунт они проникают на глубину более 4 км. По форме бактериальные клетки отличаются огромным разнообразием. Они могут быть в виде палочек (бациллы), округлыми (диплококи), шестиугольными, звездообразными, стебельковыми и т.д. Диплококки образуют пары, стрептококки – цепочки, стафилококки – скопления наподобие виноградных гроздей. Строение бактериальной клетки в упрощённом виде выглядит следующим образом:
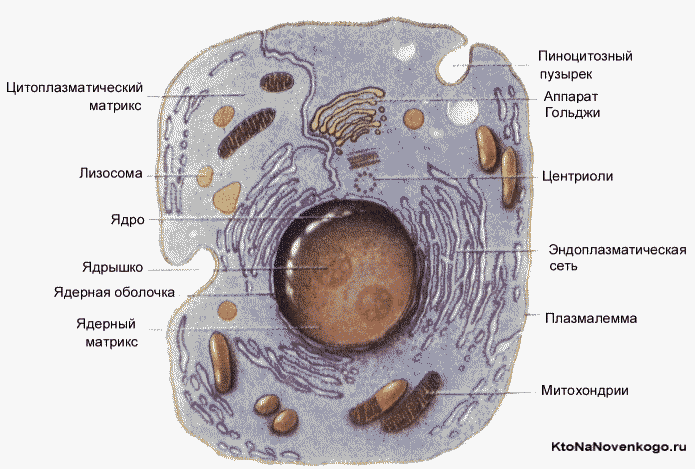
Эукариоты — это...
Они могут быть как одноклеточными, так и многоклеточными, однако строение клеток у них однотипное.
Клетки эукариот разделены системой мембран на отдельные отсеки, имеют схожий химический состав и однотипный обмен веществ. Генетический материал сконцентрирован, главным образом, в хромосомах, которые образованы цепочками ДНК и белковыми молекулами. В цитоплазме располагаются мембранные органоиды. 
В растительных клетках эта информация находится не только в ядре и митохондриях, но ещё и в пластидах. Объёмное соотношение между ядром и цитоплазмой называется ядерно-цитоплазматическим индексом, с помощью которого можно оценить уровень метаболизма (это что?). В состав клетки эукариот входят следующие основные компоненты:
ГРУППА 308 Тема: АТФ и другие органические молекулы клетки. Вопрос 1. Какое строение имеет молекула АТФ? Вопрос 2. Какую функцию выполняет АТФ? Вопрос 3. Какие связи называются макроэргическими? Вопрос 4. Какую роль выполняют в организме витамины? Группа 301 Тема: Контрольная работа №1 A1. Атом, на внешнем электронном уровне которого находится 3 электрона: А11. В результате физических явлений: ГРУППА 108 Тема: Реакции ионного обмена. Определение Реакции, протекающие между ионами в растворах электролитов называются реакциями ионного обмена (РИО). В ходе РИО не происходит изменение степеней окисления элементов, поэтому РИО не являются окислительно-восстановительными. Критерием необратимости реакций ионного обмена служит образование слабого электролита. Правило Бертолле Реакции ионного обмена протекают практически необратимо в случае, если один из образующихся продуктов реакции "уходит" из сферы реакции в виде:
Если в растворе нет ионов, образующих слабый электролит, реакция обратима и в таком случае ее уравнение не пишут, ставя знак "" Для записи ионных уравнений используют молекулярные (1), полные ионные (2) и краткие ионные формы уравнений (3,4):
Обратите внимание, что в кратком ионном уравнении коэффициенты должны быть минимальны. Поэтому в уравнении (3) все коэффициенты сокращаются на 2, и полученное уравнение (4) считается кратким ионным уравнением. При составлении РИО следует помнить, что
Алгоритм составления реакций ионного обмена
Пример 1 Взаимодействие оснований с кислотами. Запишите молекулярное, краткое и полное ионные уравнения взаимодействия гидроксида кальция и соляной кислоты. Рассчитайте суммарные коэффициенты в полной и сокращенной форме. 1. Молекулярное уравнение: 2. Полное ионное уравнение: Сумма коэффициентов равна (2+1+2+2+2+2+1+1)=13. 3. Краткое ионное уравнение: Сумма коэффициентов равна (1+2+1+1)=5. 4. Краткое ионное уравнение показывает, что при взаимодействии растворимых карбонатов (щелочных металлов) с сильными кислотами ( |