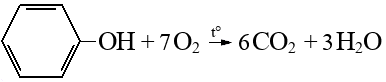09.09.22 г. Пятница. Гр.408, 405, 508,401
Здравствуйте, уважаемые студенты, заведите, пожалуйста тетрадь для конспектов по химии, другую- по биологии, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 408 химия 3,4
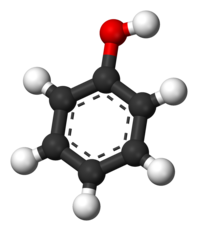
Тема :Строение, свойства и применение фенола. Взаимное влияние атомов в молекуле на примере молекулы фенола. Токсичность фенола и его соединений.
Строение, свойства и применение фенола.
СМОТРИМ ВИДЕО, КОНСПЕКТИРУЕМ, УЧИМ.
(из текста можете записать то, чего нет в видео.)
| Предложенное название | Фенол |
| Синонимы | Гидроксибензол Карболовая кислота |
| Классы | Одноатомные фенолы |
| Молярная масса | 94 г/моль |
| Брутто-формула | C6H6O |
| t°пл | 40,9 °C |
| t°кип | 182 °C |
| Плотность | 1,07 г/см3 |
| Бесцветные игольчатые кристаллы со специфическим запахомн.у. | |
| Изомеры | Показать 10 изомеров |
Простейший представитель фенолов (соединений с группой -OH при ароматическом ядре).
Растворимость в воде (6г на 100мл). Растворим в спирте, в ацетоне, в бензоле.
В природе содержится в каменноугольной смолеw.
Основной современный промышленный способ получения – «кумольный способ» (окисление кумола с получением фенола и ацетона). Ранее в основном выделялся из каменноугольной смолы.
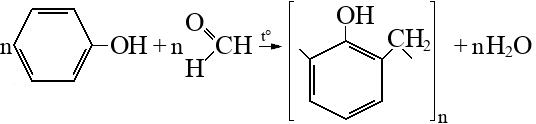
Фенол – сырье для получения важнейших полимеров (фенолформальдегидные смолы, нейлон, капрон, эпоксидные смолы и др). Также используется в производстве ПАВ, лекарств, антисептиков и др соединений.
Фенол – токсичное вещество, при попадании растворов на кожу вызывает раздражение или даже ожоги, при попадании внутрь организма поражает нервную систему.
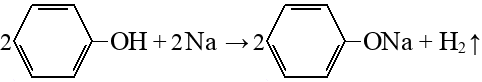
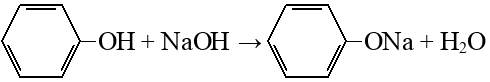
Гидрирование аренов
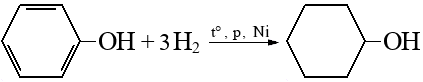
Подробнее: водород, циклогексанол (циклогексиловый спирт, кл.: Спирты).
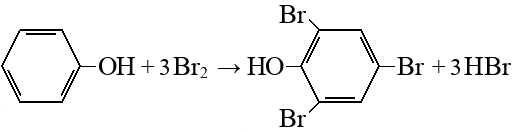
Подробнее: бром, 2,4,6-трибромфенол (2,4,6-трибром-1-гидроксибензол, кл.: Фенолы), бромоводород (бромоводородная кислота).
Сульфирование
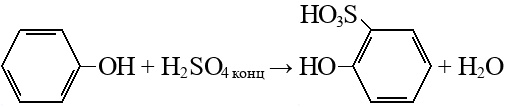
Подробнее: серная кислота, орто-сульфофенол (1-гидрокси-2-сульфобензол, кл.: Фенолы).
Реакция Кольбе_Шмитта
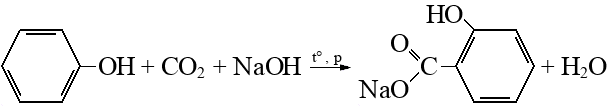
На первой стадии образуется фенолят натрия, он карбоксилируется до салицилата натрия,
а из него потом вытесняют салициловую кислоту более сильной кислотой.
Подробнее: углекислый газ, салицилат натрия (2-гидроксибензоат натрия, кл.: Соли карбоновых кислот).
ГРУППА 405 химия 7,8
Тема :КОНТРОЛЬНАЯ РАБОТА
(у меня в блоге смотрите закладку "Решаем задачи" там есть решенные аналогичные (и не только) задачи))
1.Задача. При пропускании сероводорода объемом 2,8 л (нормальные условия) через избыток раствора сульфата меди (II) образовался осадок массой 11,4г.
Определите выход продукта реакции.
Дано: V(H2S)=2,8 л; m(осадка)= 11,4 г; н.у.
Найти: η =?
2.Задача. Какую массу фосфора надо сжечь для получения оксида фосфора (V) массой 7,1 г?
Дано: m(P2O5)=7,1 г.
Найти: m(Р) =?
.ВЫПОЛНИТЕ ТЕСТЫ ( на бумаге и здесь)
Тема: Предмет органической химии. Природные, искусственные и синтетические органические вещества. Сравнение органических веществ с неорганическими.
Органические веществаС глубокой древности человек использовал в своих целях вещества живой и неживой природы. Из осколков камней наши предки изготавливали наконечники стрел, из руд выплавляли металлы, глину и известняк использовали для строительства жилищ, из мрамора высекали скульптуры. Вещества природного происхождения служили источником пищи, применялись для изготовления одежды, приготовления лекарств, ядов, красителей. Первые попытки классификации веществ были предприняты ещё в IX—X вв. Арабский алхимик Абу Бакр ар-Рази (865—925) впервые разделил вещества на представителей «минерального, растительного и животного царств». Такое разделение основывалось на том, что «растительные и животные» вещества обладают похожими свойствами: легко разрушаются при нагревании, горят, имеют невысокие температуры кипения и плавления, растворяются в спиртах и маслах. Эта классификация просуществовала почти тысячу лет! В начале XIX в. число веществ, которые были выделены из объектов живой природы, стало стремительно расти. По предложению выдающегося шведского химика Йёнса Якоба Берцелиуса вещества живой природы стали называть органическими в противоположность минеральным, т. е. неорганическим, веществам. Были замечены и другие общие особенности органических соединений. При горении все они в основном образуют углекислый газ, сажу, воду и некоторые другие соединения, а следовательно, обязательно содержат в своём составе углерод.
На ранних этапах развития химии учёные считали, что органические вещества могут образовываться только в живых организмах под действием некой «жизненной силы» (по-латыни vis vitalis). Учение о химическом родстве всех живых организмов получило название витализм. Сторонники витализма полагали, что жизненная сила представляет собой неотъемлемый атрибут живых существ и, следовательно, получить органические вещества вне организма, в пробирке или реакторе, невозможно. Однако ряд открытий, сделанных в середине XIX в., показал, что сторонники витализма глубоко заблуждались. В 1828 г. немецкий химик Фридрих Вёлер впервые получил органическое вещество — мочевину из неорганической соли (цианата аммония). В 1854 г. французский учёный Марселей Бертло синтезировал аналоги природных жиров, затем в 1861 г. русский химик Александр Михайлович Бутлеров — аналог природного сахара. В конечном счёте под давлением экспериментальных фактов витализм потерпел крах. Предмет органической химииПостепенно изучение состава и свойств органических веществ выделилось в самостоятельный раздел химической науки — органическую химию. Было обнаружено, что большое число органических веществ построено из атомов всего двух химических элементов — углерода и водорода. Такие соединения называют углеводородами. Состав углеводородов выражают общей формулой CхHу, где между индексами х и у существует строгое математическое соотношение. Углеводороды занимают особое место в органической химии, поскольку соединения всех остальных классов органических веществ можно рассматривать как их производные. Например, если в молекуле метана СН4 один атом водорода заместить карбоксильной группой —СООН, то получится молекула известной вам уксусной кислоты СН3СООН. Замена одного атома водорода в этане C2H6 на гидроксильную группу – ОН даст в результате молекулу этилового спирта С2Н5ОН. Таким образом, и карбоновые кислоты, и спирты (важнейшие классы органических соединений) можно считать производными углеводородов. Немецкий химик-органик Карл Шорлеммер более ста лет назад сформулировал классическое определение органической химии, не потерявшее своей актуальности до сих пор.
Природные, искусственные и синтетические органические веществаПоняв, как построены органические соединения, учёные научились не только получать их в лаборатории, но и химически модифицировать, т. е. изменять их строение. Мало того, химики смогли синтезировать соединения углерода, никогда не существовавшие в природе. Таким образом, по происхождению органические вещества можно разделить на три группы: природные, искусственные и синтетические. Природные органические вещества — это продукты жизнедеятельности любых живых организмов. Название веществ этой группы говорит о том, что в окружающей среде такие соединения существуют независимо от человека, их можно выделить из природных объектов, будь то полезные ископаемые (нефть, газ, каменный уголь, горючие сланцы), растения или животные. Искусственные органические вещества — это продукты химической модификации природных органических соединений, в результате которой происходит изменение состава и строения исходного вещества с целью придания ему требуемых свойств. Например, в результате химической обработки целлюлозы (основной составной части древесины) получают не существующие в природе волокна (ацетатное, медно-аммиачное, вискозное) и пластмассу (целлулоид). Синтетические органические вещества «рождаются» в пробирках учёных или в реакторах промышленных предприятий и никогда не встречаются в природе. Пожалуй, сегодня это самая многочисленная группа органических веществ, куда входят лекарства, средства бытовой химии, синтетические каучуки, ядохимикаты, пластмассы, красители и др. Многообразие органических веществОрганических веществ гораздо больше, чем неорганических: на сегодняшний день органических веществ насчитывают более 100 млн, а число неорганических не превышает 500 тысяч. Это во многом определяется особенностями строения органических соединений. Одна из причин уникальности углерода как родоначальника органических соединений была выяснена ещё в середине XIX в. Великий русский учёный Дмитрий Иванович Менделеев в учебнике «Основы химии» писал: «Углерод встречается в природе как в свободном, так и в соединительном состоянии, в весьма различных формах и видах… Способность атомов углерода соединяться между собой и давать сложные частицы проявляется во всех углеродистых соединениях… Ни в одном из элементов… способности к усложнению не развито в такой степени, как в углероде… Ни одна пара элементов не даёт столь много соединений, как углерод с водородом». Выдающуюся роль в решении вопроса о строении органических соединений сыграл русский химик А. М. Бутлеров. Об этом пойдёт речь в следующем конспекте. Основные выводы по теме конспекта:
|
ГРУППА 508 химия 3
Тема Основные положения теории химического строения органических веществ А.М.Бутлерова.
Предпосылки создания теории химического строения
По мере накопления химических знаний учёные овладели умением не только выделять органические вещества из природных объектов, но и проводить реакции с участием таких соединений. Так накапливались знания о свойствах органических веществ, расширялись области их практического применения.
В начале XIX в. учёными-химиками были разработаны методы определения качественного и количественного состава органических веществ. Стало возможным получить ответ на вопрос, какие химические элементы входят в состав этих соединений и каково их соотношение. Однако учёные тогда ещё не могли объяснить, как атомы соединяются в молекулы, не могли записывать качественный и количественный состав веществ с помощью формул; химические реакции описывали словами. Выдающийся немецкий химик того времени Ф. Вёлер писал: «Органическая химия может сейчас кого угодно свести с ума. Она кажется мне дремучим лесом, полным удивительных вещей, безграничной чащей, из которой нельзя выбраться, куда не осмеливаешься проникнуть…»
К середине XIX в. возникла необходимость осмысления, объяснения и обобщения накопившихся данных в области органической химии, т. е. создания научной теории, которая позволила бы систематизировать и объяснять строение и свойства органических веществ.
В первой половине XIX в. учёными разных стран были предприняты попытки создания подобной теории. Одни основывались на сходстве качественного и количественного состава родственных органических веществ, другие — на общности химических свойств. Однако подобно тому, как первые попытки классификации химических элементов не превратились в научную теорию, а стали лишь предтечей открытия Д. И. Менделеевым периодического закона, так и ранние попытки систематизации знаний об органических веществах явились предпосылками создания теории химического строения органических соединений.
Первое положение теории химического строения.
Структурные формулы
Первую научную теорию строения органических соединений, которой химики всего мира придерживаются до сих пор, предложил выдающийся русский учёный А. М. Бутлеров. Основные идеи новой теории впервые были высказаны им в 1861 г. в докладе «О химическом строении вещества» на съезде естествоиспытателей и врачей в немецком городе Шпайере.
Основой теории Бутлерова является положение о химическом строении как определённой последовательности химических связей между атомами в молекулах в строгом соответствии с их валентностью. Рассмотрим основные положения теории химического строения.
| Первое положение. Атомы в молекулах соединены друг с другом согласно их валентности, причём углерод в органических веществах всегда четырёхвалентен, а его атомы способны соединяться в цепи линейного, разветвлённого и замкнутого строения. |
Напомним, что валентность — это способность атомов химических элементов образовывать определённое число связей с другими атомами. Для соединений с ковалентными связями валентность равна числу общих электронных пар данного атома с соседними атомами.
Наглядно продемонстрировать валентность атомов в молекуле можно с помощью структурных формул. Структурная формула — это такое изображение молекулы, в котором каждая ковалентная химическая связь показана чёрточкой — валентным штрихом.
В органических соединениях углерод проявляет постоянную валентность, равную четырём. Например, структурная формула простейшего углеводорода метана СН4 имеет вид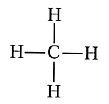
Атомы углерода обладают уникальной способностью образовывать связи не только с атомами других элементов, но и друг с другом; при этом возникают различные цепи — линейные, разветвлённые, замкнутые: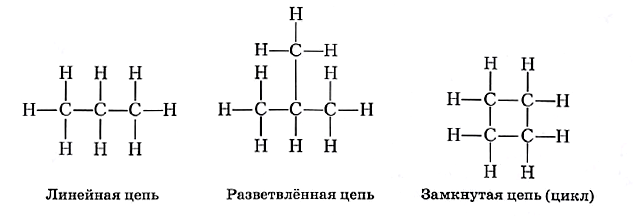
Атомы углерода во всех приведённых примерах четырёхвалентны и образуют между собой и с атомами водорода простые, или одинарные, связи.
Но этим уникальные особенности атомов углерода как химического элемента не исчерпываются. Два атома могут быть связаны между собой и с другими атомами не только простыми, но и кратными, т. е. двойными или даже тройными, связями, например: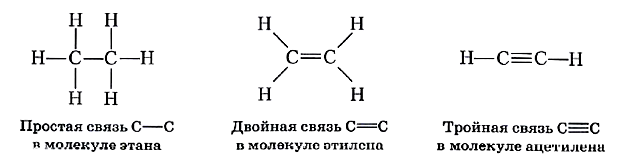
Теперь вам становится понятна одна из причин многообразия органических соединений. Она заключается в том, что атомы углерода способны образовывать между собой ковалентные химические связи (простые и кратные), соединяясь в цепи (неразветвлённые, разветвлённые, циклические).
Второе положение теории
химического строения. Изомерия
| Второе положение. Свойства органических веществ определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т. е. химическим строением. |
Чтобы описать свойства какого-либо органического вещества, например имеющего формулу C2H2О, недостаточно информации о качественном и количественном составе вещества. Необходимо знать, в каком порядке атомы соединены в молекуле. Подобно тому, как из одного и того же набора кубиков можно сложить домики разной «архитектуры», так и из двух атомов углерода, шести атомов водорода и одного атома кислорода можно без нарушения валентности «построить» различные молекулы: 
Первое вещество — этиловый спирт и второе — диметиловый эфир имеют одинаковый состав, но их физические и химические свойства различны. Вы впервые встретились с очень распространённым в органической химии явлением — изомерией.
Вещества, имеющие одинаковый качественный и количественный элементный состав, но различное химическое строение, а следовательно, и различные свойства, называют изомерами. Явление существования изомеров называют изомерией.
А. М. Бутлеров не только впервые объяснил существование изомеров различием в химическом строении молекул, но и сумел предсказать существование изомеров для уже известных веществ, а затем и синтезировать их. В этом заключается выдающаяся предсказательная роль теории строения.
Таким образом, молекулярная формула отражает только качественный и количественный состав вещества. Информацию о химическом строении соединения несёт структурная формула, указывающая на порядок связи атомов в молекулах. Помимо полной структурной формулы наподобие тех, которые изображены выше, на практике чаще используют сокращённые структурные формулы, сворачивая близлежащие группы атомов, не записывая ненужные при этом валентные штрихи. Например, особенности строения этилового спирта и диметилового эфира вполне однозначно передают формулы:
СН3—СН2—ОН СН3—О—СН3
Более детальную информацию о химическом строении вещества, в частности о взаимном расположении атомов в пространстве, дают объёмные модели молекул — модели Стюарта—Бриглеба.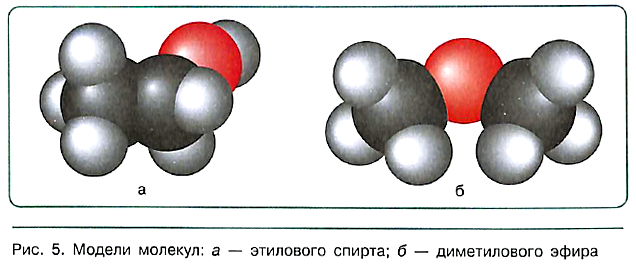
Явление изомерии — ещё одна причина многообразия органических соединений.
Третье положение теории химического строения
| Третье положение. Атомы в молекулах органических веществ оказывают влияние друг на друга. |
Нетрудно догадаться, что этот «особенный» атом, в отличие от пяти остальных, не соединён с углеродом непосредственно, а связан с ним через атом кислорода. Следовательно, атом кислорода влияет на соседний с ним атом водорода, облегчая его замещение атомом натрия.
В молекуле диметилового эфира все атомы водорода связаны только с атомами углерода. Становится понятно, почему, в отличие от этилового спирта, диметиловый эфир не способен реагировать с металлическим натрием.
Теория химического строения, предложенная А. М. Бутлеровым, сыграла в органической химии такую же огромную роль, как периодический закон и периодическая система элементов Д. И. Менделеева в неорганической химии. Она позволила систематизировать все накопленные сведения об органических веществах и объяснить причины их многообразия. Но самое главное — теория строения сделала осмысленным и целенаправленным синтез новых органических веществ и изучение их химических свойств. Она настолько многогранна и динамична, что и сегодня является основополагающим учением не только органической, но и всей современной химии.
Основные выводы по теме конспекта:
- Научной основой органической химии является современная теория химического строения органических соединений. Некоторые положения этой теории:
- атомы в молекулах соединены друг с другом согласно их валентности, причём углерод в органических веществах всегда четырёхвалентен;
- свойства веществ зависят не только от их качественного и количественного состава, но и от их строения (химического, электронного и пространственного);
- атомы в молекулах влияют друг на друга.
- Химическим строением называют порядок расположения атомов в молекуле согласно их валентности.
- Химическое строение отображают с помощью химических формул: молекулярных и структурных (полных или сокращённых).
- Материальные модели, отражающие состав и пространственное строение молекул органических соединений, бывают двух видов: шаростержневые и объёмные.
- Причины многообразия органических веществ — это: способность атомов углерода соединяться др
ГРУППА 401 химия 3,4
Тема :Химические свойства металлов.
Взаимодействие железа с кислотами. Получение гидроксида железа(II) и взаимодействие его с кислотами. Получение гидроксида железа(III) и взаимодействие его с кислотами. Получение гидроксида хрома (III) и исследование его свойств. Электрохимический ряд напряжений металлов. Металлотермия.
Химические свойства металлов.
Во всех реакциях простые вещества — металлы проявляют только восстановительные свойства.
- Металлы взаимодействуют с неметаллами, образуя бинарные соединения. По правилам ИЮПАК названия этих соединений образуются в соответствии со схемой:

Так, с очень активными неметаллами (галогенами, серой) металлы образуют соединения, которые молено рассматривать, как соли бескислородных кислот: 2Na + Сl2 = 2NaCl
Если металл проявляет переменные степени окисления, подобная соль имеет состав, который зависит от окислительных свойств неметалла. Например, железо энергично взаимодействует с хлором, образуя хлорид железа(III): 2Fe + 3Сl2 = 2FeCl3
При взаимодействии железа с серой, окислительная способность которой ниже, чем у галогенов, продуктом реакции является сульфид железа(II): Fe + S = FeS
- При взаимодействии металлов с кислородом образуются оксиды или пероксиды:
4Li + O2 = 2Li2O
2Na + O2 = Na2O2
Оксиды в этом случае имеют основный или амфотерный характер:
2Mg + O2 = 2MgO
4Аl + 3O2 = 2Аl2O3
Эти реакции сопровождаются выделением большого количества теплоты и очень ярким пламенем, поэтому применяются для изготовления сигнальных ракет, фейерверков, салютов и других пиротехнических средств. Поэтому обращение с ними требует строгого соблюдения правил техники безопасности.
Продуктом горения железа в кислороде является смешанный оксид ![]() :
:
3Fe + 2O2 = Fe3O4
- Металлы — простые вещества, образованные элементами IA– и IIА–групп, в полном соответствии с названием этих групп взаимодействуют с водой с образованием щёлочи и водорода. В общем виде эти реакции можно записать так:
2М + 2Н2O = 2МОН + Н2↑, где М — щелочной металл
М + 2Н2O = М(ОН)2 + H2↑, где М — Mg или щёлочноземельный металл.
Для характеристики химических свойств металлов важное значение имеет их положение в электрохимическом ряду напряжений:
К, Са, Na, Mg, Al, Zn, Fe, Sn, Pb, (H2), Cu, Hg, Ag, Au
Вспомните известные вам из курса основной школы два вывода:
- взаимодействие металлов с растворами кислот происходит, если металл находится в ряду напряжений левее водорода;
- взаимодействие металлов с растворами солей происходит, если металл находится в ряду напряжений левее металла соли.
Лабораторный способом получения водорода:
Zn + 2НСl = ZnCl2 + H2↑
Zn0 + 2H+ = Zn2+ + H20
Аналогично протекает реакция металлов и с органическими кислотами:
2СН3СООН + Zn —> (CH3COO)2Zn + Н2↑
2СН3СООН + Zn –> 2СН3СОO– + Zn2+ + Н20
Реакция между цинком и раствором сульфата меди(II) протекает согласно уравнению:
Zn + CuSO4 = ZnSO4 + Сu
Zn0 + Сu2+ = Zn2+ + Сu0
Подчеркнём, что в этом случае металл может находиться в ряду напряжений и после водорода, но не после металла соли. Например, реакция замещения серебра медью:
Cu + 2AgNO3 = Сu(NО3)2 + 2Ag
Cu0 + 2Ag+ = Cu2+ + 2Ag0
В завершение рассмотрим ещё одно характерное не для всех металлов свойство, которое называется металлотермия. Такие активные металлы, как алюминий, кальций, магний, литий, способны взаимодействовать с оксидами других металлов. Для того чтобы началась такая реакция, смесь активного металла и оксида металла (её называют термитной) необходимо поджечь. После этого процесс сопровождается выделением большого количества теплоты и света (отсюда и название процесса). Металлотермию применяют для получения и более ценных металлов: 2Аl + Сr2О3 = Al2O3 + 2Сг
Химия металлов (таблица)