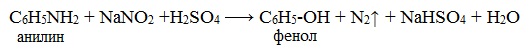СПРАВА НАХОДИТСЯ АРХИВ БЛОГА-СМОТРИТЕ ДАТУ И СВОИ УРОКИ
РАСПИСАНИЕ ЗАНЯТИЙ НА НЕДЕЛЮ: 30.01.23г.-03.02.23г.
Ср. 01.02: 406, 505, 401, ----
Пт. 03.02: 401, 505, ----, 501
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com Тетрадь привезете, когда перейдем на очную форму обучения.)Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы.
Моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 406 ХИМИЯ 45,46
ТЕМА 45,46:Анилин, как органическое основание. Получение анилина из нитробензола. Применение анилина на основе свойств.
Ароматические амины
Анилин


Токсическое действие анилина
Анилин ядовит, действует на центральную нервную систему, вызывает в крови образование метгемоглобина и дегенеративные изменения эритроцитов, гемолиз, следствием чего является кислородное голодание организма.
Анилин проникает в организм через органы дыхания в виде паров, а также при всасывании через кожу и слизистые оболочки, которое особенно усиливается при повышении температуры воздуха и приёме алкоголя. Возможны острые и хронические (анилизм) отравления анилином. При лёгком отравлении анилином наблюдаются слабость, головокружение, головная боль, синюшность губ, ушных раковин, ногтей. При отравлениях средней тяжести присоединяется тошнота, иногда рвота, появляется шатающаяся походка; пульс учащён. Тяжёлые случаи отравления встречаются крайне редко. При хронических отравлениях — токсический гепатит, нервно-психические нарушения, расстройство сна, снижение памяти и т. д.
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
I. Основные свойства
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот.
Анилин более слабое основание, чем предельные амины и аммиак.
Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида, а его водный раствор не окрашивает лакмус в синий цвет.
Анилин с водой не реагирует и не изменяет окраску индикатора!!!
Видеоопыт «Изучение среды раствора анилина»
Соли анилина, в отличие от анилина, хорошо растворимы в воде.
II. Особые свойства анилина
Реакции с участием аминогруппы
1. Взаимодействие с кислотами (образование солей)
Анилин реагирует с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но не растворимы в неполярных органических растворителях: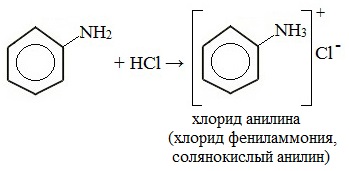
Видеоопыт «Взаимодействие анилина с соляной кислотой»
Анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси.
Солянокислый анилин хорошо растворим в воде. Если к такому раствору добавить достаточное количество щелочи, то анилин снова выделится в свободном виде:
Реакции с участием бензольного ядра
Аминогруппа как заместитель I рода облегчает реакции замещения в бензольном ядре, при этом заместители становятся в орто- и пара-положения к аминогруппе.
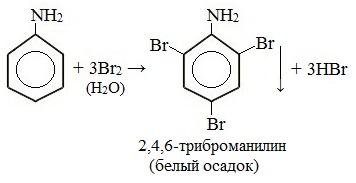
При бромировании анилин легко образует 2, 4, 6 — тризамещенные продукты реакции. По той же причине анилин легко окисляется.
1. Галогенирование
Анилин энергично реагирует с бромной водой с образованием белого осадка 2,4,6-триброманилина. Эта реакция может использоваться для качественного и количественного определения анилина:
Качественная реакция на анилин!
Видеоопыт «Бромирование анилина»
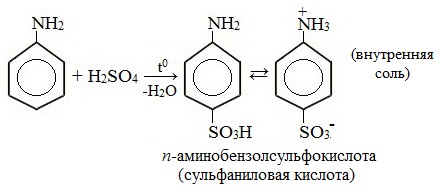
Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов).
III. Окисление анилина
Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении.
При действии хлорной извести Ca (Cl) OCl на водный раствор анилина появляется интенсивное фиолетовое окрашивание.
Качественная реакция на анилин!
Видеоопыт «Окисление анилина раствором хлорной извести – качественная реакция»
При взаимодействии анилина с хромовой известью (смесь концентрированной серной кислоты и дихромата калия К2Cr2O7) образуется черный осадок, называемый черным анилином (краситель «анилиновый черный»).
Черный анилин применяется как прочный краситель (для окраски тканей и меха в черный цвет). Обычно ткань сначала пропитывают раствором окислителя. Образующийся черный анилин откладывается в порах волокна. Он не растворим в воде и устойчив к мылу и свету.
Видеоопыт «Окисление анилина раствором дихроматом калия – получение красителей»
IV. Диазотирование анилина
Практическое значение имеет реакция взаимодействия анилина с азотистой кислотой при пониженной температуре (около 0°С). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений.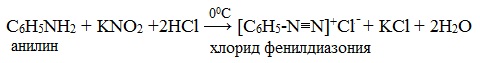
При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины.
Анилин широко применяется в производстве синтетических красителей. Он также входит в состав типографских красок и красителей для тканей.
Используется в производстве лекарственных средств (сульфаниламидные препараты), смол, лаков, духов, кремов для обуви, фотографических химикалий, взрывчатых веществ, гербицидов и фунгицидов.
Анилин находит применение в качестве вулканизатора каучука, антиоксиданта и антиозонового средства.
ТЕМА 46: Аминокислоты.Белки. Первичная, вторичная, третичная структуры белков.


- Последовательность аминокислот в составе полипептидной цепи — это первичная структура белка. Она уникальна для любого типа белка и определяет форму его молекулы, его свойства и функции.
- Длинная молекула белка сворачивается и приобретает сначала вид спирали в результате образования водородных связей между —СО и —NН группами разных аминокислотных остатков полипептидной цепи (между углеродом карбоксильной группы одной аминокислоты и азотом аминогруппы другой аминокислоты). Эта спираль — вторичная структура белка.
- Третичная структура белка — трёхмерная пространственная «упаковка» полипептидной цепи в виде глобулы (шарика). Прочность третичной структуры обеспечивается разнообразными связями, возникающими между радикалами аминокислот (гидрофобными, водородными, ионными и дисульфидными S–S связями).
- Некоторые белки (например, гемоглобин крови человека) имеют четвертичную структуру. Она возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс. Четвертичная структура удерживается непрочными ионными, водородными и гидрофобными связями.


ГРУППА 505 ХИМИЯ 16,17
ТЕМА 16:Ионная связь, как связь между катионами и анионами за счет электростатического притяжения. Классификация ионов: по составу, знаку заряда, наличию гидратной оболочки.
Ионная связь, как связь между катионами и анионами за счет электростатического притяжения. Классификация ионов: по составу, знаку заряда, наличию гидратной оболочки
Просмотрите видео, прочитайте текст, Выполните необходимые( по вашему мнению) записи, приведите примеры ионных соединений.
Примером связи между атомами типичного металла и типичного неметалла можно назвать связь атомов в хлориде натрия (поваренная соль).
Составляющие ее элементы – натрий и хлор находятся в третьем периоде периодической системы.

Их относительные электроотрицательности соответственно равны у натрия – 1,1, у хлора – 2,8. На внешнем электронном слое у атома натрия находится один неспаренный s-электрон, у атома хлора из 7 внешних электронов один р-электрон неспаренный. За счет неспаренных электронов между атомами натрия и хлора может образоваться химическая связь. Из-за большой разницы электроотрицательности способ ее образования будет иной: за счет отдачи и присоединения электронов.
Отдав свой электрон атому хлора, атом натрия приобретает устойчивую оболочку инертного газа неона и превращается в положительно заряженную частицу – ион Na+. Атом хлора, приобретая электрон натрия, достраивает внешний электронный слой до устойчивой структуры инертного газа аргона – приобретает отрицательный заряд, превращаясь в ион Cl-.
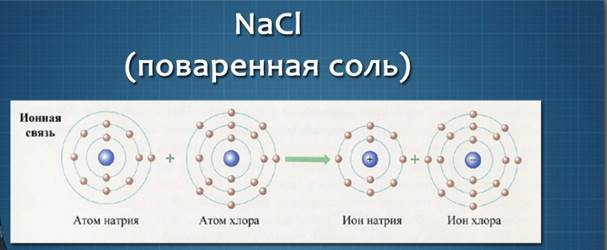
Ионы (от греческого ion – «идущий») – электрически заряженные частицы, которые образуются в результате потери или присоединения электронов атомами или группами атомов. Положительно заряженные ионы называют катионами, а отрицательно заряженные ионы – анионами.

Между ними возникают силы электростатического притяжения. За счет этих сил разноименно заряженные ионы связываются между собой, образуя ионное соединение, например, катионы натрия и хлорид-анионы образуют ионное соединение хлорид натрия.
Следует учитывать, что чем левее и ниже находится в периодической системе элемент, тем легче его атомы переходят в катионы (отдают электроны). А также, чем правее и выше расположен в периодической системе элемент, тем сильнее проявляют его атомы тенденцию переходить в анионы (принимать электроны).
При переходе нейтральных атомов в ионы размер и свойства их меняются.
Связь атомных частиц в ионном соединении объясняется не повышенной плотностью двухэлектронного облака (общей электронной пары), а силами электростатического притяжения ионов.
Химическая связь между ионами, осуществляемая силами их электростатического притяжения, называется ионной связью, а соединения, которые образовались вследствие притяжения ионов, называются ионными.
Ионы в природе существуют вокруг нас. Много разнообразных ионов в морской воде, прибрежный воздух также ионизирован и поэтому весьма полезен для здоровья. Ионы активны, результатом их взаимодействия часто бывают негативные явления: насыщение почв нитрат-анионом NО3-, разрушение мраморных изделий сульфат-анионом SO42-, кислотные дожди, приводящие к появлению в атмосфере катионов водорода, сульфат-анионов, нитрат-анионов, хлорид-анионов, загрязнение воды токсичными катионами металлов.
Важнейшими свойствами ионной связи являются ее прочность, ненасыщенность, ненаправленностъ.
Ионная связь весьма прочная.

Так, например, энергия разрыва связи К–Сl равна 426,1 кДж/моль, связи Li-F – 577,3 кДж/моль, Nа–Сl – 411,3 кДж/моль.
Ненасыщенность ее объясняется тем, что вокруг заряженной частицы – иона создается сферическое электромагнитное поле.
Притяжение противоположно заряженных ионов в сферическом поле происходит во всех направлениях, поэтому ионная связь является ненаправленной.
Мы познакомились с ковалентной (неполярной и полярной) и ионной химическими связями. Природа их одинакова – электрическая. Она связана с электрическим взаимодействием электронов и ядер атомов.
Соединения ионного и ковалентного полярного типа образованы атомами разных элементов с разной электроотрицательностью.
В этих соединение электронные пары, связывающие атомы, смещены к более электроотрицательному элементу. Наиболее полное смещение электронной пары или пар происходит в ионных соединениях. Экспериментальные исследования доказывают, что полного перехода электронов от атомов металлов к атомам неметаллов при образовании ионной связи не происходит.
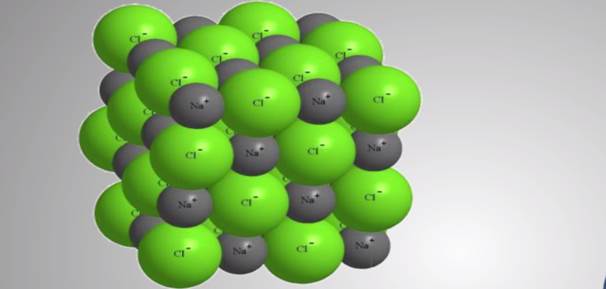
Поэтому в хлориде натрия (Na+Cl-) заряды его ионов не равны единице, а имеют в действительности заряды на ионах, равные +0,8 и –0,8. Реальные заряды на ионах называются эффективными зарядами.
Чем больше разность между значениями относительной электроотрицательности атомов, тем выше степень ионности их соединения. Связи с разностью относительной электроотрицательности больше 2,1 можно отнести к ионным.
Ионную связь можно рассматривать как предельный случай полярности ковалентной связи.
Чисто ионной связи практически не существует. Отсюда деление химической связи на типы – ковалентная и ионная также условно.
ТЕМА 17. Ионные кристаллические решетки. Свойства веществ с ионным типом кристаллической решетки.
Ионная решетка
Эту решетку образуют все вещества с ионным типом связи — соли, щелочи, бинарные соединения активных металлов с активными неметаллами (оксиды, галогениды, сульфиды), алкоголяты, феноляты, соли аммония и аминов. Примеры: КОН, СаСО

Свойства ионных кристаллов:
- твердые, но хрупкие;
- отличаются высокими температурами плавления;
- нелетучи, не имеют запаха;
- расплавы ионных кристаллов обладают электропроводностью;
- многие растворимы в воде. При растворении в воде диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
ГРУППА 401 ЭКОЛОГИЯ 27
ТЕМА 27:Саморазвитие экосистем.