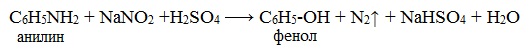ПЯТНИЦА, 28.01.22г. 401, 208, 301ИНСТРУКЦИЯ ДЛЯ ТЕХ, КТО НЕ МОЖЕТ НАЙТИ СВОЮ ГРУППУ:
СПРАВА ЕСТЬ АРХИВ. В АРХИВЕ ПО-ПОРЯДКУ РАСПОЛОЖЕНЫ ДНИ НЕДЕЛИ. ТАМ ЖЕ ВИДНЫ ДАТЫ И НОМЕРА ГРУПП. ВЫБИРАЕТЕ ДЕНЬ СО СВОЕЙ ГРУППОЙ, И ОН ОТКРОЕТСЯ. УРОКИ ВЫЛОЖЕНЫ ПО РАСПИСАНИЮ. НА ОДНОЙ СТРАНИЦЕ ВЫЛОЖЕН ОДИН ДЕНЬ . ВНИМАНИЕ!!! На выполнение задания отводится 1 неделя. Моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
Критерии оценивания: Для получения отличной оценки обучающийся должен: -соблюдать отведенное время; - разборчиво и правильно выполнить работу. Если работа будет прислана после указанного срока , оценка будет снижаться.
ГРУППА 401 ХИМИЯ 30,31
ТЕМА: Механизмы электролитической диссоциации для веществ с различными типами химической связи. Гидратированные и негидратированные ионы.
Электролитическая диссоциация
Понятие электролитов впервые ввел М. Фарадей в первой половине XIX века. Согласно его определению:
Электролитами называют вещества, водные растворы или расплавы которых проводят электрический ток.
Опустим в стакан с водой графитовые стержни, присоединенные к источнику тока и связанные цепью с электрической лампой. При включении рубильника никаких видимых изменений не происходит. Это означает, что вода не проводит электрический ток, то есть не является электролитом. Внесем в стакан с водой поваренную соль – хлорид натрия,
Атомы и группы атомов, несущие электрический заряд, называют ионами. Положительно заряженные ионы называют катионами, отрицательно заряженные ионы - анионами.
Проведя дополнительный опыт, можно убедиться, что сухая поваренная соль не проводит электрический ток. Таким образом, можно сделать вывод, что свободные ионы появляются в расплаве и при растворении соли в воде.
Рассмотрим на атомарном уровне, что происходит с кристаллом поваренной соли при попадании его в воду. Соль – вещество с ионной кристаллической решеткой, в узлах которой расположены катионы натрия и анионы хлора. Они удерживаются друг около друга благодаря силам электростатического притяжения.
Молекула воды представляет собой диполь, так как на атомах водорода локализованы частичные положительные заряды, на на атоме кислорода – отрицательный.

В молекуле воды атомные орбитали кислорода находятся в
Для объяснения свойств водных растворов электролитов С. Аррениус в 1887 году предложил теорию электролитической диссоциации. Эта теория объясняла, почему растворы некоторых веществ проводят электрический ток, но не отвечала на вопрос, почему одни вещества являются электролитами, а другие - нет. Более подробно особенности поведения веществ в растворах описал Д.И. Менделеев, который экспериментально доказал, что при растворении электролитов происходит химическое взаимодействие между молекулами растворенного вещества и молекулами растворителя. Сущность процесса электролитической диссоциации было объяснено на основании природы химической ионной связи.
Согласно теории Д.И. Менделеева, электролитическая диссоциация молекул электролитов протекает в три стадии. Рассмотрим эти стадии на примере поваренной соли NaCl.
1. При попадании в воду, молекулы воды окружают кристаллы поваренной соли, притягиваясь к катионам натрия своими отрицательно заряженными концами, а к анионам хлора - положительно заряженными. Эта стадия называется ассоциация.
2. За счет электростатического взаимодействия, молекулы воды "растаскивают" молекулу электролита, связь между ионами в кристалле ослабевает и разрывается, то есть происходит непосредственно диссоциация (распад) молекул.
3. Диполи воды полностью окружают образовавшиеся при распаде ионы, катионы и анионы, образуя гидратную оболочку. Гидратированные ионы переходят в раствор.

В неводных растворах в качестве диполей может выступать не вода, а другой полярный растворитель, например, этанол. В таком случае ионы окружены молекулами растворителя (образуют сольватную оболочку) и называются сольватированными.
Ионы в водном растворе окружены молекулами воды, то есть имеют гидратную оболочку, и называются гидратированными.

Таким образом, описанный выше процесс можно описать уравнением:
где
В большинстве случаев этот процесс записывают упрощенно, не указывая гидратированное состояние ионов:
Процесс распада вещества на ионы при растворении в воде или расплавлении называют электролитической диссоциацией.
Электролитическая диссоциация состоит из двух одновременно протекающих обратных процессов: из диссоциации (распад молекул на ионы) и ассоциации (процесс образования молекул из ионов). Поэтому в уравнении электролитической диссоциации всегда ставят знак
В водных растворах диссоциации подвержены кислоты, сильные основания и растворимые соли:
При диссоциации происходит резкое увеличение числа частиц в растворе – это отличает растворы электролитов от растворов неэлектролитов. Именно поэтому растворы солей замерзают при более низкой температуре, чем растворы неэлектролитов.
Особенно сильно гидратирован ион водорода
Основные положения Теории электролитической диссоциации
Согласно теории электролитической диссоциации С. Аррениуса и Д. И. Менделеева можно сформулировать основные положения теории электролитической диссоциации (ТЭД):
- При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
- Электролитическая диссоциация - процесс обратимый (обратная реакция называется ассоциацией).
Степень электролитической диссоциации
Основываясь на теории электролитической диссоциации можно дать определения важнейшим классам неорганических соединений
| Название | Определение | Уравнение диссоциации |
| Оксиды | Неэлектролиты, состоят из атомов элемента и кислорода | Не диссоциируют в водных растворах |
| Кислоты | Электролиты, при диссоциации образуют катионы водорода | |
| Основания | Электролиты, при диссоциации образуют гидроксид-анионы.Растворимые в воде основания называют щелочами | |
| Соли | Электролиты, при диссоциации образуют катионы металла и анионы кислотного остатка | |
ТЕМА:Степень электролитической диссоциации.
Степень электролитической диссоциации.
Механизмы электролитической диссоциации для веществ с различными типами химической связи. Гидратированные и негидратированные ионы.Степень электролитической диссоциации.
Теорию электролитической диссоциации предложил шведский ученый С. Аррениус в 1887 году.
Электролитическая диссоциация – это распад молекул электролита с образованием в растворе положительно заряженных (катионов) и отрицательно заряженных (анионов) ионов.
Например, уксусная кислота диссоциирует так в водном растворе:
CH3COOH⇄H++CH3COO-.
Диссоциация относиться к обратимым процессам. Но различные электролиты диссоциируют по-разному. Степень зависит от природы электролита, его концентрации, природы растворителя, внешних условий (температуры, давления).
Степень диссоциации α – отношение числа молекул, распавшихся на ионы, к общему числу молекул:
α=v´(x)/v(x).
Степень может варьироваться от 0 до 1 (от отсутствия диссоциации до ее полного завершения). Обозначается в процентах. Определяется экспериментальным путем. При диссоциации электролита происходит увеличение числа частиц в растворе. Степень диссоциации показывает силу электролита.
Различают сильные и слабые электролиты.
Сильные электролиты – это те электролиты, степень диссоциации которой превышает 30%.
Электролиты средней силы – это те, степень диссоциации которой делит в пределах от 3% до 30%.
Слабые электролиты – степень диссоциации в водном 0,1 М растворе меньше 3%.
Примеры слабых и сильных электролитов.
Сильные электролиты | Слабые электролиты |
Практически все соли и кислоты: HBr, KOH, NaOH, Ca(OH)2, HNO3, HClO4. | Большинство кислот и оснований: H2S. H2CO3. Al(OH)3, NH4OH. |
Сильные электролиты в разбавленных растворах нацело распадаются на ионы, т.е. α = 1. Но эксперименты показывают, что диссоциация не может быть равна 1, она имеет приближенное значение, но не равна 1. Это не истинная диссоциация, а кажущаяся.
Например, пусть у некоторого соединения α = 0,7. Т.е. по теории Аррениуса в растворе «плавает» 30% непродиссоцииовавших молекул. А 70% образовали свободные ионы. А электролстатическая теория дает другое определение этому понятию: если α = 0,7, то все молекулы диссоциированы на ионы, но ионы свободны лишь на 70%, а оставшиеся 30% - связаны электростатическими взаимодействиями.
КАЖУЩАЯСЯ СТЕПЕНЬ ДИССОЦИАЦИИ.

Степень диссоциации зависит не только от природы растворителя и растворяемого вещества, но и от концентрации раствора и температуры.
Уравнение диссоциации можно представить в следующем виде:
AK ⇄ A- + K+.
И степень диссоциации можно выразить так:

С увеличением концентрации раствора степень диссоциации электролита падает. Т.е. значения степени для конкретного электролита не является величиной постоянной.
Причины и механизм диссоциации электролитов объясняются химической теорией раствора Д. И. Менделеева и природой химической связи. Как известно, электролитами являются вещества с ионной или ковалентной сильно полярной связями. Растворители, в которых происходит диссоциация, состоят из полярных молекул. Например, вода — полярный растворитель. Диссоциация электролитов с ионной и полярной связями протекает различно. Рассмотрим механизм диссоциации электролитов в водных растворах.
I. Механизм диссоциации электролитов с ионной связью.
При растворении в воде ионных соединений, например хлорида натрия NaCl, дипольные молекулы воды ориентируются вокруг ионов натрия и хлорид-ионов. При этом положительные полюсы молекул воды притягиваются к хлорид-ионам Сl—, отрицательные полюсы — к положительным ионам Na+ .
В результате этого взаимодействия между молекулами растворителя и ионами электролита притяжение между ионами в кристаллической решетке вещества ослабевает. Кристаллическая решетка разрушается, и ионы переходят в раствор. Эти ионы в водном растворе находятся не в свободном состоянии, а связаны с молекулами воды, т. е. являются гидратированными ионами.
II. Механизм диссоциации электролитов, которые состоят из полярных молекул
При растворении в воде веществ с полярной ковалентной связью происходит взаимодействие дипольных молекул электролита с дипольными молекулами воды. Например, при растворении в воде хлороводорода происходит взаимодействие молекул НСl с молекулами Н2O.
Для простоты в химических уравнениях ионы изображают без молекул воды: Н+ , Ag+, Mg2 +, F—, SO42- и т. д.
Источник: https://himya.ru/elektroliticheskaya-dissociaciya.html
ГРУППА 208 ХИМИЯ 36,37,38
ВНИМАНИЕ! Экзамен в МАРТЕ!
См. вкладку "Экзамен 208"и "Решаем задачи"и ещё
ТЕМА: Окислительные свойства азотной и серной кислот.
Серная кислота. В реакциях разбавленной серной кислоты с металлами, находящимися в ряду стандартных электродных потенциалов (ряд Бекетова) до водорода, окислителями являются ионы водорода, например:
Zn+H2SO4 = ZnSO4 + H2
Взаимодействие концентрированной серной кислоты с металлами протекает более сложно.
- До -2 серу могут восстановить только очень активные металлы — в ряду напряжений до алюминия включительно.
Реакции будут идти вот так:
8Li + 5H2SO4(конц.) → 4Li2SO4 + 4H2O + H2S↑
4Mg + 5H2SO4(конц.) → 4MgSO4 + 4H2O + H2S↑
8Al + 15H2SO4(конц.) (t)→ 4Al2(SO4)3 + 12H2O + 3H2S↑
- при взаимодействии H2SO4 (конц) с металлами в ряду напряжений после алюминия, но до железа, то есть с металлами со средней активностью сера восстанавливается до 0:
3Mn + 4H2SO4(конц.) → 3MnSO4 + 4H2O + S↓
2Cr + 4H2SO4(конц.) (t)→ Cr2(SO4)3 + 4H2O + S↓
- все остальные металлы, начиная с железа в ряду напряжений (включая те, что после водорода, кроме золота и платины, конечно), могут восстановить серу только до +4. Так как это малоактивные металлы:
2Fe + 6H2SO4(конц.) (t)→ Fe2(SO4)3 + 6H2O + 3SO2↑
(обратите внимание, что железо окисляется до +3, до максимально возможной, высшей степени окисления, так как оно имеет дело с сильным окислителем)
2Ag + 2H2SO4(конц.) → Ag2SO4 + 2H2O + SO2↑
В этих реакциях окислителем является сера в степени окисления +6.
Уравняйте реакции методом электронного баланса:
Cu + H2SO4 (конц.) = CuSO4 + SO2 + H2O
Zn + H2SO4 (конц.) = ZnSO4 + S + H2O
H2SO4 (конц) окисляет некоторые неметаллы (которые проявляют восстановительные свойства), как правило, до максимальной — высшей степени окисления (образуется оксид этого неметалла). Сера при этом тоже восстанавливается до SO2:
2P + 5H2SO4(конц.) → P2O5 + 5H2O + 5SO2↑
Свежеобразованный оксид фосфора (V) реагирует с водой, получается ортофосфорная кислота. Поэтому реакцию записывают сразу:
2P + 5H2SO4(конц) → 2H3PO4 + 2H2O + 5SO2↑
То же самое с бором, он превращается в ортоборную кислоту:
2B + 3H2SO4(конц) → 2H3BO3 + 3SO2↑
Очень интересны взаимодействие серы со степенью окисления +6 (в серной кислоте) с «другой» серой (находящейся в другом соединении). В рамках ЕГЭ рассматривается взаимодействие H2SO4 (конц) с серой (простым веществом) и сероводородом.
Начнем с взаимодействия серы (простого вещества) с концентрированной серной кислотой. В простом веществе степень окисления 0, в кислоте +6. В этой ОВР сера +6 будет окислять серу 0.
H2SO4(конц.) + H2S → S↓ + SO2↑ + 2H2O
Уравняйте реакции методом электронного баланса
S+H2SO4 (конц.) = SO2 + H2O
C + H2SO4 (конц.) = SO2 + CO2 + H2O
Железо, алюминий и хром концентрированной серной кислотой пассивируются, т. е. реакция не идёт. В связи с этим безводную серную кислоту можно хранить в железной или алюминиевой таре и перевозить в стальных цистернах.
H2SO4 (конц) , так или иначе, взаимодействует с галогенидами. С фторидами и хлоридами ОВР не протекает, проходит обычный ионно-обменный процесс, в ходе которого образуется газообразный галогеноводород:
CaCl2 + H2SO4(конц.) → CaSO4 + 2HCl↑
CaF2 + H2SO4(конц.) → CaSO4 + 2HF↑
А вот галогены в составе бромидов и иодидов (как и в составе соответствующих галогеноводородов) окисляются ей до свободных галогенов. Только вот сера восстанавливается по-разному: иодид является более cильным восстановителем, чем бромид. Поэтому иодид восстанавливает серу до сероводорода, а бромид до сернистого газа:
2H2SO4(конц.) + 2NaBr → Na2SO4 + 2H2O + SO2↑ + Br2
H2SO4(конц.) + 2HBr → 2H2O + SO2↑ + Br2
5H2SO4(конц.) + 8NaI → 4Na2SO4 + 4H2O + H2S↑ + 4I2↓
H2SO4(конц.) + 8HI → 4H2O + H2S↑ + 4I2↓
Хлороводород и фтороводород (как и их соли) устойчивы к окисляющему действию H2SO4 (конц).
Для концентрированной серной кислоты уникально то, что она обладает водоотнимающим свойством.
Это позволяет использовать концентрированную серную кислоту самым разным образом:
Во-первых, осушение веществ. Концентрированная серная кислота забирает воду от вещества и оно «становится сухим».
Во-вторых, катализатор в реакциях, в которых отщепляется вода (например, дегидратация и этерификация):
H3C–COOH + HO–CH3 (H2SO4(конц.))→ H3C–C(O)–O–CH3 + H2O
H3C–CH2–OH (H2SO4(конц.))→ H2C=CH2 + H2O
Азотная кислота. Концентрированная азотная кислота не взаимодействует с золотом и платиной, а также пассивирует железо, алюминий и хром — на их поверхности образуется защитная плёнка. С другими металлами она взаимодействует, при этом образуются соответствующие нитраты и выделяется оксид азота(IV):
Уравняйте реакции методом электронного баланса:
Mg + HNO3 = Mg(NO3)2 +NO2+H2O
Hg + HNO3 = Hg(NO3)2 +NO2+H2O
Разбавленная азотная кислота взаимодействует с металлами по-разному в зависимости от степени разбавления.
Подумайте какой элемент в реакции магния с концентрированной азотной кислотой служит окислителем:
1)Mg+2 2)H+ 3)Mg 0 4)N+5
Рассмотрим уравнение реакции Mg и концентрированной HNO3:
Mg + 4HNO3 = Mg(NO3)2 +2NO2+H2O
Мы видим, что магний отдаёт два электрона и приобретает степень окисления +2, следовательно, он восстановитель. В ходе реакции азот в степени окисления +5 превращается в азот в степени окисления +4; значит, он принимает один электрон и служит окислителем. Соответственно окислителем служит N+5
Смесь соляной и азотной кислот называется “царской водкой”. Она способна растворять платину и золото.
HNO3+4HCl+Au→H[AuCl4 ]+NO↑+2H2O
4HNO3+18HCl+Pt→3H2 [PtCl6 ]+4NO↑+8H2O
С помощью азотной кислоты получают взрывчатые вещества:
Тринитротолуол (тротил) получают с помощью смеси азотной и серной кислот (серная кислота выступает в роли водоотнимающего средства):
Закончите уравнения химических реакций:
С6Н5-СН3 + HNO3
Тринитроглицерин получают с помощью смеси азотной и серной кислот (серная кислота выступает в роли водоотнимающего средства):
Составьте уравнение реакции:
Глицерин + азотная кислота (H2SO4 (конц.)) =
Тринитроцеллюлозу (пироксилин) получают с помощью смеси азотной и концентрированной серной кислот (серная кислота выступает в роли водоотнимающего средства):
С6Н7О2 (ОН)3 + 3nHNO3. H2SO4 (конц.) С6Н7О2 (ОNO2)3 +3nH2O
ТЕМА: Решение качественных и расчетных задач, схем превращений.
СКОЛЬКО ЛИТРОВ ВОДОРОДА ВЫДЕЛИТСЯ ПРИ РАЗЛОЖЕНИИ ЭЛЕКТРИЧЕСКИМ ТОКОМ ВОДЫ МАССОЙ 72 Г?
Решение:
- M (H2O) = 1 • 2 + 16 = 18 г/моль
- Находим количество вещества воды по условию задачи:
n = m / M = 72 г : 18 г/моль = 4 моль - Записываем над уравнением реакции имеющиеся данные, а под уравнением — число моль согласно уравнению (равно коэффициенту перед веществом):
4 моль x моль
2H2O = 2H2↑ + O2↑
2 моль 2 моль - Составляем пропорцию:
4 моль — x моль
2 моль — 2 моль
(или с пояснением:
из 4 моль воды получится x моль водорода,
а из 2 моль — 2 моль) - Находим x:
x = 4 моль • 2 моль / 2 моль = 4 моль - Находим объем водорода:
v = 22,4 л/моль • 4 моль = 89,6 л
Ответ: 89,6 л.
| Осуществите ряд химических превращений: S→H2S→SO2→SO3→H2SO4. | |
| Решение | Получение сероводорода из серы осуществляют путем её восстановления водородом: S + H2 = H2S. Оксид серы (IV) из сероводорода получают путем его окисления кислородом: 2H2S + 3O2 = 2SO2 + 2H2O. Чтобы получить оксид серы (VI) из оксида серы (IV) необходимо окислить оксид серы (IV) кислородом: 2SO2 + O2 = 2SO3. Оксид серы (VI) типичный кислотный оксид, который при взаимодействии с водой образует кислоту, поэтому, для того, чтобы получить серную кислоту из оксида серы (VI) необходимо пропустить его через воду: SO3 + H2O = H2SO4. |
ТЕМА :Проверочная работа по теме: «Неметаллы».
1. Высший оксид состава ЭО3 образует элемент с электронной конфигурацией внешнего электронного слоя
1) ns2np1 2) ns2np3 3) ns2np4 4) ns2np6
2. В основном состоянии три неспаренных электрона имеет атом
1) кремния 3) серы
2) фосфора 4) хлора
3. В ряду элементов Mg – Al – Si характер оксида меняется следующим
образом:
1) кислотный, основный, амфотерный
2) амфотерный, кислотный, основный
3) основный, кислотный, амфотерный
4) основный, амфотерный, кислотный
4. Степень окисления фосфора равна +5 в соединении
1) P4O6
2) H4P2O7
3) H3PO3
4) PH3
5. Простое вещество, которое реагирует с раствором щелочи при
обычных условиях
медь 2) углерод 3) хлор 4) кислород
6. Оксид, который при нагревании может взаимодействовать и с
кислородом, и с водородом
1) CO2
2) SO3
3) SiO2
4) CO
7. Окислительно-восстановительная реакция с участием углекислого
газа
1) CO2 + C = 2CO
2) CO2 + Ca(OH)2 = CaCO3 + H2O
3) CO2 + NaOH = NaHCO3
4) CO2 + H2O + CaCO3 = Ca(HCO3)2
8. Верны ли следующие суждения о водороде и его соединениях?
А. Водород в соединениях проявляет как положительные, так и
отрицательные степени окисления.
Б. Водород выделяется при действии азотной кислоты на
металлы.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
9. Оксид серы (VI) реагирует с каждым из двух веществ:
1) HCl, HNO3
2) H2, O2
3) CO2, NO2
4) H2O, KOH
10. Верны ли следующие суждения о сере и ее соединениях?
А. Сера растворяется в концентрированных кислотах-окислителях.
Б. Оксиды серы проявляют только кислотные свойства.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
ЧастьВ
1. Установите соответствие между простым веществом и сложными
веществами, с каждым из которых оно может взаимодействовать.
ПРОСТОЕ ВЕЩЕСТВО СЛОЖНЫЕ ВЕЩЕСТВА
А) Cu 1) SO2, NH3, ZnS
Б) O2 2) CuO, C2H4, CO
В) H2 3) AgNO3, HNO3, FeCl3
Г) S 4) HCl, CuSO4, Ba(OH)2
5) KOH, H2SO4, HNO3
6) NaNO3, CO2, NaCl
2. Установите соответствие между формулой вещества и классом (группой)
соединений, к которому(-ой) оно принадлежит.
ФОРМУЛА НЕОРГАНИЧЕСКОГО
ВЕЩЕСТВА
КЛАСС (ГРУППА)
СОЕДИНЕНИЙ
А) HNO2 1) кислота
Б) CO2 2) основание
В) Na2ZnO2 3) кислотный оксид
Г) Fe(OH)2 4) основной оксид
5) амфотерный оксид
6) соль .
Часть С
1. Составьте уравнение окислительно-восстановительной реакции,
используя метод электронного баланса.
P2O3 + H2SO4 + … = SO2 + …
Укажите окислитель и восстановитель.
2. Смешали 200 мл раствора карбоната калия с массовой долей 11%
(плотностью 1,04 г/мл) и 250 мл раствора хлорида бария с массовой долей
15% (плотностью 1,07 г/мл). Определите массовую долю хлорида бария в
образовавшемся растворе.
ГРУППА 301 ХИМИЯ 47,48
ТЕМА: Анилин, как органическое основание. Получение анилина из нитробензола. Применение анилина на основе свойств.
Ароматические амины
Анилин


Токсическое действие анилина
Анилин ядовит, действует на центральную нервную систему, вызывает в крови образование метгемоглобина и дегенеративные изменения эритроцитов, гемолиз, следствием чего является кислородное голодание организма.
Анилин проникает в организм через органы дыхания в виде паров, а также при всасывании через кожу и слизистые оболочки, которое особенно усиливается при повышении температуры воздуха и приёме алкоголя. Возможны острые и хронические (анилизм) отравления анилином. При лёгком отравлении анилином наблюдаются слабость, головокружение, головная боль, синюшность губ, ушных раковин, ногтей. При отравлениях средней тяжести присоединяется тошнота, иногда рвота, появляется шатающаяся походка; пульс учащён. Тяжёлые случаи отравления встречаются крайне редко. При хронических отравлениях — токсический гепатит, нервно-психические нарушения, расстройство сна, снижение памяти и т. д.
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
I. Основные свойства
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот.
Анилин более слабое основание, чем предельные амины и аммиак.
Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида, а его водный раствор не окрашивает лакмус в синий цвет.
Анилин с водой не реагирует и не изменяет окраску индикатора!!!
Видеоопыт «Изучение среды раствора анилина»
Соли анилина, в отличие от анилина, хорошо растворимы в воде.
II. Особые свойства анилина
Реакции с участием аминогруппы
1. Взаимодействие с кислотами (образование солей)
Анилин реагирует с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но не растворимы в неполярных органических растворителях: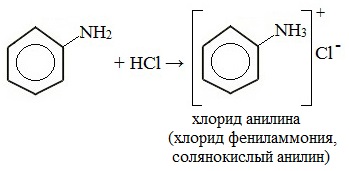
Видеоопыт «Взаимодействие анилина с соляной кислотой»
Анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси.
Солянокислый анилин хорошо растворим в воде. Если к такому раствору добавить достаточное количество щелочи, то анилин снова выделится в свободном виде:
Реакции с участием бензольного ядра
Аминогруппа как заместитель I рода облегчает реакции замещения в бензольном ядре, при этом заместители становятся в орто- и пара-положения к аминогруппе.
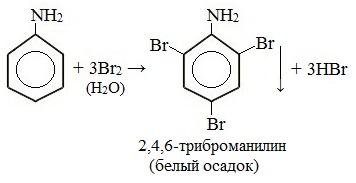
При бромировании анилин легко образует 2, 4, 6 — тризамещенные продукты реакции. По той же причине анилин легко окисляется.
1. Галогенирование
Анилин энергично реагирует с бромной водой с образованием белого осадка 2,4,6-триброманилина. Эта реакция может использоваться для качественного и количественного определения анилина:
Качественная реакция на анилин!
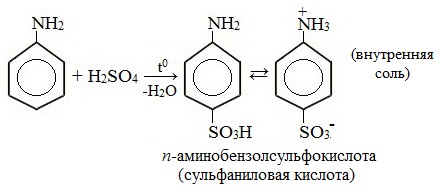
Видеоопыт «Бромирование анилина»
Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов).
III. Окисление анилина
Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении.
При действии хлорной извести Ca (Cl) OCl на водный раствор анилина появляется интенсивное фиолетовое окрашивание.
Качественная реакция на анилин!
Видеоопыт «Окисление анилина раствором хлорной извести – качественная реакция»
При взаимодействии анилина с хромовой известью (смесь концентрированной серной кислоты и дихромата калия К2Cr2O7) образуется черный осадок, называемый черным анилином (краситель «анилиновый черный»).
Черный анилин применяется как прочный краситель (для окраски тканей и меха в черный цвет). Обычно ткань сначала пропитывают раствором окислителя. Образующийся черный анилин откладывается в порах волокна. Он не растворим в воде и устойчив к мылу и свету.
Видеоопыт «Окисление анилина раствором дихроматом калия – получение красителей»
IV. Диазотирование анилина
Практическое значение имеет реакция взаимодействия анилина с азотистой кислотой при пониженной температуре (около 0°С). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений.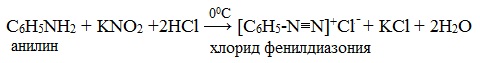
При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины.
Анилин широко применяется в производстве синтетических красителей. Он также входит в состав типографских красок и красителей для тканей.
Используется в производстве лекарственных средств (сульфаниламидные препараты), смол, лаков, духов, кремов для обуви, фотографических химикалий, взрывчатых веществ, гербицидов и фунгицидов.
Анилин находит применение в качестве вулканизатора каучука, антиоксиданта и антиозонового средства.
В состав белков входят углерод, водород, азот, кислород, сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.

Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот — различное. Пептиды — органические вещества, состоящие из остатков аминокислот, соединенных пептидной связью.
Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом).

Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.

Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).



Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков.На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.

Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин.