08.11.22 г. ВТОРНИК. Гр.405, 308
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи (ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать!) После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)
Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы.
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 405 химия 30,31
ТЕМА 30: Межклассовая изомерия с алкадиенами |
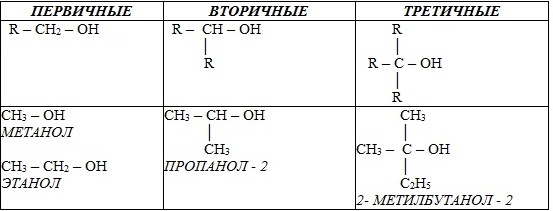
ПРОВЕРЬТЕ СЕБЯ, ПРОЙДИТЕ ТЕСТ (С ПОДСКАЗКАМИ) ЗДЕСЬ: https://studarium.ru/article-test/184 Тема 31:Спирты. Получение этанола брожением глюкозы и гидратацией этилена. Гидроксильная группа как функциональная. Понятие о предельных одноатомных спиртах. Химические свойства этанола: взаимодействие с натрием, образование простых и сложных эфиров, окисление в альдегид. Применение этанола на основе свойств. Алкоголизм, его последствия и предупреждение. Спирты. Получение этанола брожением глюкозы и гидратацией этилена. Гидроксильная группа как функциональная. Понятие о предельных одноатомных спиртах. Химические свойства этанола: взаимодействие с натрием, образование простых и сложных эфиров, окисление в альдегид. Применение этанола на основе свойств. Алкоголизм, его последствия и предупреждение. а группа -ОН) Например, СH3 – OH метанол, CH3 – CH2 – OH этанол o многоатомные (две и более групп -ОН). Современное название многоатомных спиртов - полиолы (диолы, триолы и т.д). Примеры: двухатомный спирт – этиленгликоль (этандиол) HO–СH2–CH2–OH трехатомный спирт – глицерин (пропантриол-1,2,3) HO–СH2–СН(ОН)–CH2–OH Двухатомные спирты с двумя ОН-группами при одном и том же атоме углерода R–CH(OH)2 неустойчивы и, отщепляя воду, сразу же превращаются в альдегиды R–CH=O. Спирты R–C(OH)3 не существуют. 2. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты o первичные R–CH2–OH, o вторичные R2CH–OH, o третичные R3C–OH. Например: В многоатомных спиртах различают первично-, вторично- и третичноспиртовые группы. Например, молекула трехатомного спирта глицерина содержит две первичноспиртовые (HO–СH2–) и одну вторичноспиртовую (–СН(ОН)–) группы. 3. По строению радикалов, связанных с атомом кислорода, спирты подразделяются на o предельные (например, СH3 – CH2–OH) o непредельные (CH2=CH–CH2–OH) o ароматические (C6H5CH2–OH) Непредельные спирты с ОН-группой при атоме углерода, соединенном с другим атомом двойной связью, очень неустойчивы и сразу же изомеризуются в альдегиды или кетоны. Например, виниловый спирт CH2=CH–OH превращается в уксусный альдегид CH3–CH=O Предельные одноатомные спирты 1. Определение ПРЕДЕЛЬНЫЕ ОДНОАТОМНЫЕ СПИРТЫ – кислородсодержащие органические вещества, производные предельных углеводородов, в которых один атом водорода замещён на функциональную группу (-OH)
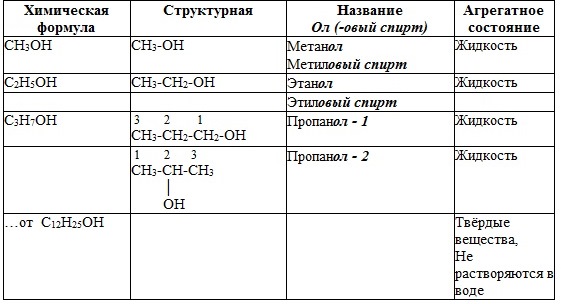
2. Гомологический ряд 3. Номенклатура спиртов Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если это необходимо). Например:
Цифра, отражающая местоположение ОН-группы, в русском языке обычно ставится после суффикса "ол". По другому способу (радикально-функциональная номенклатура) названия спиртов производят от названий радикалов с добавлением слова "спирт". В соответствии с этим способом приведенные выше соединения называют: метиловый спирт, этиловый спирт, н-пропиловый спирт СН3-СН2-СН2-ОН, изопропиловый спирт СН3-СН(ОН)-СН3. 4. Изомерия спиртов Для спиртов характерна структурная изомерия: · изомерия положения ОН-группы (начиная с С3); · углеродного скелета (начиная с С4); · межклассовая изомерия с простыми эфирами этиловый спирт СН3CH2–OH и диметиловый эфир CH3–O–CH3 Возможна также пространственная изомерия – оптическая. Например, бутанол-2 СH3CH(OH)СH2CH3, в молекуле которого второй атом углерода (выделен цветом) связан с четырьмя различными заместителями, существует в форме двух оптических изомеров. 5. Строение спиртов Строение самого простого спирта — метилового (метанола) — можно представить формулами: Из электронной формулы видно, что кислород в молекуле спирта имеет две неподеленные электронные пары. Свойства спиртов и фенолов определяются строением гидроксильной группы, характером ее химических связей, строением углеводородных радикалов и их взаимным влиянием. Связи О–Н и С–О – полярные ковалентные. Это следует из различий в электроотрицательности кислорода (3,5), водорода (2,1) и углерода (2,4). Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода: Атому кислорода в спиртах свойственна sp3-гибридизация. В образовании его связей с атомами C и H участвуют две 2sp3-атомные орбитали, валентный угол C–О–H близок к тетраэдрическому (около 108°). Каждая из двух других 2 sp3-орбиталей кислорода занята неподеленной парой электронов. Подвижность атома водорода в гидроксильной группе спирта несколько меньше, чем в воде. Более "кислым" в ряду одноатомных предельных спиртов будет метиловый (метанол). 6. Физические свойства МЕТАНОЛ (древесный спирт) – жидкость (tкип=64,5; tпл=-98; ρ = 0,793г/см3), с запахом алкоголя, хорошо растворяется в воде. Ядовит – вызывает слепоту, смерть наступает от паралича верхних дыхательных путей. ЭТАНОЛ (винный спирт) – б/цв жидкость, с запахом спирта, хорошо смешивается с водой. Первые представители гомологического ряда спиртов — жидкости, высшие — твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде падает. Высшие спирты практически нерастворимы в воде. Видео-опыт: Физические свойства спиртов Особенности строения спиртов – спирты образуют водородные связи (обозначают точками) за счёт функциональной группы (-ОН) Вывод: 1) В результате у всех спиртов более высокая температура кипения, чем у соответствующих углеводородов, например, Т. кип. этанола +78° С, а Т. кип. этана –88,63° С; Т. кип. бутанола и бутана соответственно +117,4° С и –0,5° С. 2) Способность спиртов образовывать межмолекулярные водородные связи не только влияет на их температуры кипения, но и увеличивает их растворимость в воде. Все алканы нерастворимы в воде, а низкомолекулярные спирты (метиловый, этиловый, н-пропиловый и изопропиловый) растворяются в воде неограниченно. 3) Отсутствие газов в гомологическом ряду предельных одноатомных спиртов. ГРУППА 308 ХИМ ИЯ 36,37,38 Тема 36:Окислительные свойства азотной и серной кислот. Серная кислота. В реакциях разбавленной серной кислоты с металлами, находящимися в ряду стандартных электродных потенциалов (ряд Бекетова) до водорода, окислителями являются ионы водорода, например: Zn+H2SO4 = ZnSO4 + H2 Взаимодействие концентрированной серной кислоты с металлами протекает более сложно.
Реакции будут идти вот так: 8Li + 5H2SO4(конц.) → 4Li2SO4 + 4H2O + H2S↑
4Mg + 5H2SO4(конц.) → 4MgSO4 + 4H2O + H2S↑
8Al + 15H2SO4(конц.) (t)→ 4Al2(SO4)3 + 12H2O + 3H2S↑
3Mn + 4H2SO4(конц.) → 3MnSO4 + 4H2O + S↓
2Cr + 4H2SO4(конц.) (t)→ Cr2(SO4)3 + 4H2O + S↓
2Fe + 6H2SO4(конц.) (t)→ Fe2(SO4)3 + 6H2O + 3SO2↑
(обратите внимание, что железо окисляется до +3, до максимально возможной, высшей степени окисления, так как оно имеет дело с сильным окислителем) 2Ag + 2H2SO4(конц.) → Ag2SO4 + 2H2O + SO2↑ В этих реакциях окислителем является сера в степени окисления +6. Уравняйте реакции методом электронного баланса: Cu + H2SO4 (конц.) = CuSO4 + SO2 + H2O Zn + H2SO4 (конц.) = ZnSO4 + S + H2O H2SO4 (конц) окисляет некоторые неметаллы (которые проявляют восстановительные свойства), как правило, до максимальной — высшей степени окисления (образуется оксид этого неметалла). Сера при этом тоже восстанавливается до SO2: 2P + 5H2SO4(конц.) → P2O5 + 5H2O + 5SO2↑ Свежеобразованный оксид фосфора (V) реагирует с водой, получается ортофосфорная кислота. Поэтому реакцию записывают сразу: 2P + 5H2SO4(конц) → 2H3PO4 + 2H2O + 5SO2↑ То же самое с бором, он превращается в ортоборную кислоту: 2B + 3H2SO4(конц) → 2H3BO3 + 3SO2↑ Очень интересны взаимодействие серы со степенью окисления +6 (в серной кислоте) с «другой» серой (находящейся в другом соединении). В рамках ЕГЭ рассматривается взаимодействие H2SO4 (конц) с серой (простым веществом) и сероводородом. Начнем с взаимодействия серы (простого вещества) с концентрированной серной кислотой. В простом веществе степень окисления 0, в кислоте +6. В этой ОВР сера +6 будет окислять серу 0. H2SO4(конц.) + H2S → S↓ + SO2↑ + 2H2O Уравняйте реакции методом электронного баланса S+H2SO4 (конц.) = SO2 + H2O C + H2SO4 (конц.) = SO2 + CO2 + H2O Железо, алюминий и хром концентрированной серной кислотой пассивируются, т. е. реакция не идёт. В связи с этим безводную серную кислоту можно хранить в железной или алюминиевой таре и перевозить в стальных цистернах. H2SO4 (конц) , так или иначе, взаимодействует с галогенидами. С фторидами и хлоридами ОВР не протекает, проходит обычный ионно-обменный процесс, в ходе которого образуется газообразный галогеноводород: CaCl2 + H2SO4(конц.) → CaSO4 + 2HCl↑ CaF2 + H2SO4(конц.) → CaSO4 + 2HF↑ А вот галогены в составе бромидов и иодидов (как и в составе соответствующих галогеноводородов) окисляются ей до свободных галогенов. Только вот сера восстанавливается по-разному: иодид является более cильным восстановителем, чем бромид. Поэтому иодид восстанавливает серу до сероводорода, а бромид до сернистого газа: 2H2SO4(конц.) + 2NaBr → Na2SO4 + 2H2O + SO2↑ + Br2 H2SO4(конц.) + 2HBr → 2H2O + SO2↑ + Br2 5H2SO4(конц.) + 8NaI → 4Na2SO4 + 4H2O + H2S↑ + 4I2↓ H2SO4(конц.) + 8HI → 4H2O + H2S↑ + 4I2↓ Хлороводород и фтороводород (как и их соли) устойчивы к окисляющему действию H2SO4 (конц).
Для концентрированной серной кислоты уникально то, что она обладает водоотнимающим свойством. Это позволяет использовать концентрированную серную кислоту самым разным образом: Во-первых, осушение веществ. Концентрированная серная кислота забирает воду от вещества и оно «становится сухим». Во-вторых, катализатор в реакциях, в которых отщепляется вода (например, дегидратация и этерификация): H3C–COOH + HO–CH3 (H2SO4(конц.))→ H3C–C(O)–O–CH3 + H2O H3C–CH2–OH (H2SO4(конц.))→ H2C=CH2 + H2O Азотная кислота. Концентрированная азотная кислота не взаимодействует с золотом и платиной, а также пассивирует железо, алюминий и хром — на их поверхности образуется защитная плёнка. С другими металлами она взаимодействует, при этом образуются соответствующие нитраты и выделяется оксид азота(IV): Уравняйте реакции методом электронного баланса: Mg + HNO3 = Mg(NO3)2 +NO2+H2O Hg + HNO3 = Hg(NO3)2 +NO2+H2O Разбавленная азотная кислота взаимодействует с металлами по-разному в зависимости от степени разбавления. Подумайте какой элемент в реакции магния с концентрированной азотной кислотой служит окислителем: 1)Mg+2 2)H+ 3)Mg 0 4)N+5 Рассмотрим уравнение реакции Mg и концентрированной HNO3: Mg + 4HNO3 = Mg(NO3)2 +2NO2+H2O Мы видим, что магний отдаёт два электрона и приобретает степень окисления +2, следовательно, он восстановитель. В ходе реакции азот в степени окисления +5 превращается в азот в степени окисления +4; значит, он принимает один электрон и служит окислителем. Соответственно окислителем служит N+5 Смесь соляной и азотной кислот называется “царской водкой”. Она способна растворять платину и золото. HNO3+4HCl+Au→H[AuCl4 ]+NO↑+2H2O 4HNO3+18HCl+Pt→3H2 [PtCl6 ]+4NO↑+8H2O С помощью азотной кислоты получают взрывчатые вещества: Тринитротолуол (тротил) получают с помощью смеси азотной и серной кислот (серная кислота выступает в роли водоотнимающего средства): Закончите уравнения химических реакций: С6Н5-СН3 + HNO3 Тринитроглицерин получают с помощью смеси азотной и серной кислот (серная кислота выступает в роли водоотнимающего средства): Составьте уравнение реакции: Глицерин + азотная кислота (H2SO4 (конц.)) = Тринитроцеллюлозу (пироксилин) получают с помощью смеси азотной и концентрированной серной кислот (серная кислота выступает в роли водоотнимающего средства): С6Н7О2 (ОН)3 + 3nHNO3. H2SO4 (конц.) С6Н7О2 (ОNO2)3 +3nH2O Тема 37:Решение качественных и расчетных задач, схем превращений. СКОЛЬКО ЛИТРОВ ВОДОРОДА ВЫДЕЛИТСЯ ПРИ РАЗЛОЖЕНИИ ЭЛЕКТРИЧЕСКИМ ТОКОМ ВОДЫ МАССОЙ 72 Г?Решение:
Ответ: 89,6 л.
Тема 38:Проверочная работа по теме: «Неметаллы». 1. Высший оксид состава ЭО3 образует элемент с электронной конфигурацией внешнего электронного слоя 1) ns2np1 2) ns2np3 3) ns2np4 4) ns2np6 2. В основном состоянии три неспаренных электрона имеет атом 1) кремния 3) серы 2) фосфора 4) хлора 3. В ряду элементов Mg – Al – Si характер оксида меняется следующим образом: 1) кислотный, основный, амфотерный 2) амфотерный, кислотный, основный 3) основный, кислотный, амфотерный 4) основный, амфотерный, кислотный 4. Степень окисления фосфора равна +5 в соединении 1) P4O6 2) H4P2O7 3) H3PO3 4) PH3 5. Простое вещество, которое реагирует с раствором щелочи при обычных условиях
6. Оксид, который при нагревании может взаимодействовать и с кислородом, и с водородом 1) CO2 2) SO3 3) SiO2 4) CO 7. Окислительно-восстановительная реакция с участием углекислого газа 1) CO2 + C = 2CO 2) CO2 + Ca(OH)2 = CaCO3 + H2O 3) CO2 + NaOH = NaHCO3 4) CO2 + H2O + CaCO3 = Ca(HCO3)2 8. Верны ли следующие суждения о водороде и его соединениях? А. Водород в соединениях проявляет как положительные, так и отрицательные степени окисления. Б. Водород выделяется при действии азотной кислоты на металлы. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 9. Оксид серы (VI) реагирует с каждым из двух веществ: 1) HCl, HNO3 2) H2, O2 3) CO2, NO2 4) H2O, KOH 10. Верны ли следующие суждения о сере и ее соединениях? А. Сера растворяется в концентрированных кислотах-окислителях. Б. Оксиды серы проявляют только кислотные свойства. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны ЧастьВ 1. Установите соответствие между простым веществом и сложными веществами, с каждым из которых оно может взаимодействовать. ПРОСТОЕ ВЕЩЕСТВО СЛОЖНЫЕ ВЕЩЕСТВА А) Cu 1) SO2, NH3, ZnS Б) O2 2) CuO, C2H4, CO В) H2 3) AgNO3, HNO3, FeCl3 Г) S 4) HCl, CuSO4, Ba(OH)2 5) KOH, H2SO4, HNO3 6) NaNO3, CO2, NaCl 2. Установите соответствие между формулой вещества и классом (группой) соединений, к которому(-ой) оно принадлежит. ФОРМУЛА НЕОРГАНИЧЕСКОГО ВЕЩЕСТВА КЛАСС (ГРУППА) СОЕДИНЕНИЙ А) HNO2 1) кислота Б) CO2 2) основание В) Na2ZnO2 3) кислотный оксид Г) Fe(OH)2 4) основной оксид 5) амфотерный оксид 6) соль . Часть С 1. Составьте уравнение окислительно-восстановительной реакции, используя метод электронного баланса. P2O3 + H2SO4 + … = SO2 + … Укажите окислитель и восстановитель. 2. Смешали 200 мл раствора карбоната калия с массовой долей 11% (плотностью 1,04 г/мл) и 250 мл раствора хлорида бария с массовой долей 15% (плотностью 1,07 г/мл). Определите массовую долю хлорида бария в образовавшемся растворе. |