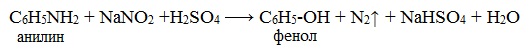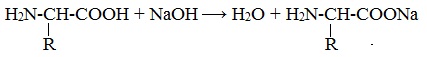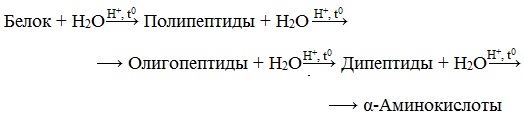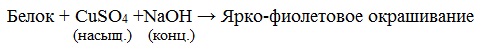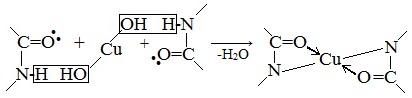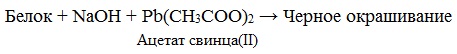СРЕДА 22.12.21Г. 306,403,408,306
Ароматические амины
Анилин


Токсическое действие анилина
Анилин ядовит, действует на центральную нервную систему, вызывает в крови образование метгемоглобина и дегенеративные изменения эритроцитов, гемолиз, следствием чего является кислородное голодание организма.
Анилин проникает в организм через органы дыхания в виде паров, а также при всасывании через кожу и слизистые оболочки, которое особенно усиливается при повышении температуры воздуха и приёме алкоголя. Возможны острые и хронические (анилизм) отравления анилином. При лёгком отравлении анилином наблюдаются слабость, головокружение, головная боль, синюшность губ, ушных раковин, ногтей. При отравлениях средней тяжести присоединяется тошнота, иногда рвота, появляется шатающаяся походка; пульс учащён. Тяжёлые случаи отравления встречаются крайне редко. При хронических отравлениях — токсический гепатит, нервно-психические нарушения, расстройство сна, снижение памяти и т. д.
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
I. Основные свойства
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот.
Анилин более слабое основание, чем предельные амины и аммиак.
Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида, а его водный раствор не окрашивает лакмус в синий цвет.
Анилин с водой не реагирует и не изменяет окраску индикатора!!!
Видеоопыт «Изучение среды раствора анилина»
Соли анилина, в отличие от анилина, хорошо растворимы в воде.
II. Особые свойства анилина
Реакции с участием аминогруппы
1. Взаимодействие с кислотами (образование солей)
Анилин реагирует с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но не растворимы в неполярных органических растворителях: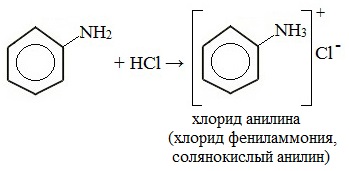
Видеоопыт «Взаимодействие анилина с соляной кислотой»
Анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси.
Солянокислый анилин хорошо растворим в воде. Если к такому раствору добавить достаточное количество щелочи, то анилин снова выделится в свободном виде:
Реакции с участием бензольного ядра
Аминогруппа как заместитель I рода облегчает реакции замещения в бензольном ядре, при этом заместители становятся в орто- и пара-положения к аминогруппе.
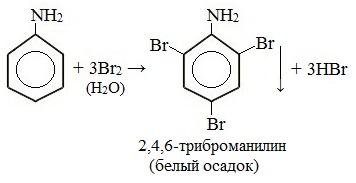
При бромировании анилин легко образует 2, 4, 6 — тризамещенные продукты реакции. По той же причине анилин легко окисляется.
1. Галогенирование
Анилин энергично реагирует с бромной водой с образованием белого осадка 2,4,6-триброманилина. Эта реакция может использоваться для качественного и количественного определения анилина:
Качественная реакция на анилин!
Видеоопыт «Бромирование анилина»
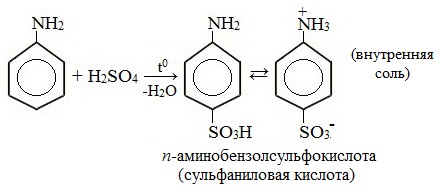
Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов).
III. Окисление анилина
Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении.
При действии хлорной извести Ca (Cl) OCl на водный раствор анилина появляется интенсивное фиолетовое окрашивание.
Качественная реакция на анилин!
Видеоопыт «Окисление анилина раствором хлорной извести – качественная реакция»
При взаимодействии анилина с хромовой известью (смесь концентрированной серной кислоты и дихромата калия К2Cr2O7) образуется черный осадок, называемый черным анилином (краситель «анилиновый черный»).
Черный анилин применяется как прочный краситель (для окраски тканей и меха в черный цвет). Обычно ткань сначала пропитывают раствором окислителя. Образующийся черный анилин откладывается в порах волокна. Он не растворим в воде и устойчив к мылу и свету.
Видеоопыт «Окисление анилина раствором дихроматом калия – получение красителей»
IV. Диазотирование анилина
Практическое значение имеет реакция взаимодействия анилина с азотистой кислотой при пониженной температуре (около 0°С). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений.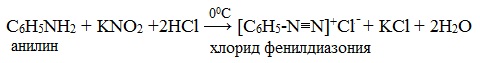
При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины.
Анилин широко применяется в производстве синтетических красителей. Он также входит в состав типографских красок и красителей для тканей.
Используется в производстве лекарственных средств (сульфаниламидные препараты), смол, лаков, духов, кремов для обуви, фотографических химикалий, взрывчатых веществ, гербицидов и фунгицидов.
Анилин находит применение в качестве вулканизатора каучука, антиоксиданта и антиозонового средства.
В состав белков входят углерод, водород, азот, кислород, сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.

Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот — различное. Пептиды — органические вещества, состоящие из остатков аминокислот, соединенных пептидной связью.
Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом).

Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.

Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).



Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков.На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.

Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин.
Тема: Одомашнивание как начальный этап селекции.
Теория:
- повышение продуктивности организмов;
- улучшение качества продукции (вкуса, внешнего вида, химического состава);
- улучшение хозяйственно важных физиологических свойств (устойчивости к болезням и вредителям, отзывчивости на удобрения или корм).

Название центра | Примеры культурных растений |
| Южноазиатский тропический | Рис, сахарный тростник, цитрусовые, огурец, баклажан |
| Восточноазиатский | Соя, просо, гречиха, слива, вишня, яблоня |
| Юго-Западноазиатский | Пшеница, лён, рожь, горох, репа, чечевица, чеснок, виноград, морковь |
| Средиземноморский | Капуста, свекла, петрушка, маслины, лук |
| Абиссинский | Твёрдая пшеница, ячмень, кофейное дерево, банан, арбуз |
| Центральноамериканский | Кукуруза, какао, перец, фасоль, хлопчатник, тыква |
| Южноамериканский | Картофель, табак, ананас |

ОДОМАШНИВАНИЕ КАК НАЧАЛЬНЫЙ ЭТАП СЕЛЕКЦИИ
Одомашнивание как начальный этап селекции |
ТЕМА:Успехи селекции.
Увеличение производства сельскохозяйственной продукции как в мире, так и в нашей стране базируется на использовании потенциала сортов растений и пород животных, полученных в процессе селекции. Другими словами, наше благополучие напрямую связано с уровнем развития и эффективностью селекции, что и определяет ее особую значимость для человечества.
Хотя человек и освоил под сельское хозяйство всего 10% суши нашей планеты, но увеличить значительно долю пахотных земель сегодня невозможно, так как все доступные на сегодня резервы пригодных для сельского хозяйства земель фактически исчерпаны. Остается одно — значительно увеличить отдачу используемых земель, резко повысить продуктивность растений и животных.
За последние 100 лет селекция достигла поразительных успехов. Урожайность зерновых повысилась на порядок. Сегодня в развитых странах получают до 100 ц/га пшеницы, риса, кукурузы. По новым сортам картофеля зарегистрирован рекордный урожай почти в 1000 ц/га, т. е. в четыре раза выше среднего по возделываемым сортам.
Подобная картина наблюдается и по другим культурам. Сравнение средних и рекордных урожаев свидетельствует лишь о тех резервах, которые заложены в новых сортах и могут быть реализованы при совершенствовании технологий возделывания растений. Это также свидетельствует о том, что селекция имеет огромные перспективы в деле наращивания продовольственного потенциала.
Мощное развитие животноводства за последние десятилетия привело к появлению выдающихся пород животных. Продуктивность молочного скота у некоторых пород достигла 8—10 тыс. кг молока в год. Новый сибирский тип российской мясошерстной породы овец отличается высокой мясной и шерстной продуктивностью. Средняя масса баранов составляет 110—130 кг, средний настриг шерсти в чистом волокне 6—8 кг. Лучшие породы кур дают по 400 яиц в год на несушку, а бройлерные цыплята достигают массы 2,5—3 кг за семь недель.
Комплекс селекционных приемов, используемых в молочном скотоводстве, называется крупномасштабной селекцией. Она включает сбор всей селекционно-генетической информации, составление оптимальной стратегии селекционной работы, оценку генотипов лучших животных, создание банков замороженной спермы от элитных быков, отбор и эффективное использование лучших коров. Методы гормональных воздействий и трансплантации позволяют получать от лучших коров десятки зигот в год и выращивать их в коровах, имеющих более низкую племенную ценность. Вся система управляется из единого информационного центра. Такая широкомасштабная селекция позволяет повышать продуктивность породы на 1—2% в год. Это очень высокий показатель для таких медленно размножающихся животных, как крупный рогатый скот.
Селекционер, создающий новые сорта растений и породы животных, — это прежде всего ученый, в совершенстве владеющий знаниями генетики, систематики, физиологии и многих других наук. Кроме того, это, образно говоря, художник, создающий вначале абстрактный образ будущего сорта растений или породы животных и только после этого приступающий к его реальному воплощению. Сочетание таких двух качеств в одном человеке является довольно редким явлением, поэтому выдающихся селекционеров, создавших лучшие сорта растений или породы животных, знают повсеместно. Наиболее известные российские селекционеры-растениеводы: А. П. Шехурдин и В. Н. Мамонтова — по яровой пшенице, И. В. Мичурин — по плодовым растениям, П. П. Лукьяненко и В. Н. Ремесло — по озимой пшенице, М. И. Хаджинов и Г. С. Галеев — по кукурузе, В. С. Пустовойт — по подсолнечнику, М. Ф. Иванов, Н. С. Батурин, В. А. Струнников внесли крупный вклад в создание новых пород животных.
ГРУППА 408 БИОЛОГИЯ 21
ТЕМА: БИОСИНТЕЗ БЕЛКА. РЕШЕНИЕ ЗАДАЧ НА ТРАНСЛЯЦИЮ.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- Один шаг это полный виток спирали ДНК–поворот на 360o
- Один шаг составляют 10 пар нуклеотидов
- Длина одного шага – 3,4 нм
- Расстояние между двумя нуклеотидами – 0,34 нм
- Молекулярная масса одного нуклеотида – 345 г/моль
- Молекулярная масса одной аминокислоты – 120 г/мол
- В молекуле ДНК: А+Г=Т+Ц (Правило Чаргаффа: ∑(А) = ∑(Т), ∑(Г) = ∑(Ц), ∑(А+Г) =∑(Т+Ц)
- Комплементарность нуклеотидов: А=Т; Г=Ц
- Цепи ДНК удерживаются водородными связями, которые образуются между комплементарными азотистыми основаниями: аденин с тимином соединяются 2 водородными связями, а гуанин с цитозином тремя.
- В среднем один белок содержит 400 аминокислот;
- вычисление молекулярной массы белка:
ТЕМА:Растворение белков в воде. Обнаружение белков в молоке и в мясном
бульоне. Изучение свойств белков. |
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
1. Амфотерные свойства белков
Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
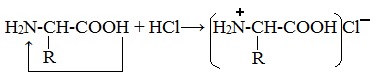
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
При действии же кислот он выступает в форме катиона:
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
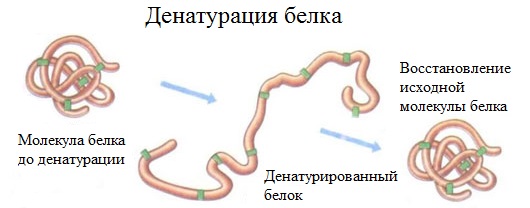
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
Необратимая денатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg2+, Pb2+, Си2+).
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-700С), теряя способность растворяться в воде.
Видеоопыт «Свертывание белков при нагревании»
Видеоопыт «Осаждение белков солями тяжелых металлов»
Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.
Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина: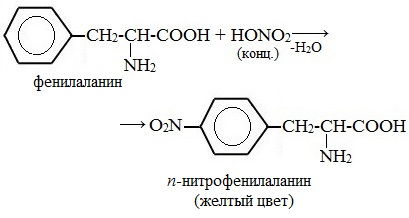
Видеоопыт «Ксантопротеиновая реакция на белки»
б) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.
Причина появления окраски – образование комплексных соединений с координационным узлом: 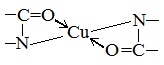
Видеоопыт «Биуретовая реакция белков»
Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Видеоопыт «Качественное определение азота в органических соединениях»