17.10.22г. ПОНЕДЕЛЬНИК 501,408,406,405
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 501 БИОЛОГИЯ 5,6
(ТЕОРИЯ (не пишите):Пероксид водорода – ядовитое вещество, образующееся в клетке в процессе жизнедеятельности. Принимая участие в обезвреживании ряда токсических веществ, он может вызвать самоотравление (денатурацию белков, в частности, ферментов). Накоплению Н2О2 препятствует фермент каталаза, распространенный в клетках, способных существовать в кислородной атмосфере. Фермент каталаза, расщепляя Н2О2 на воду и кислород, играет защитную роль в клетке. Фермент функционирует с очень большой скоростью, одна его молекула расщепляет за 1с 200 000 молекул Н2О2:2 Н2О2 2 Н2О2 + О2 )
Цель: наблюдать проявление активности фермента каталаза в растительных и животных тканях. Сделать вывод о различии активности фермента в живых и мёртвых тканях.
Оборудование: таблетка гидроперита 1,5 г; стакан с водой 15 мл; ложечка; кусочки сырого и варёного картофеля; кусочки сырого и варёного мяса.
Ход работы.
Добавьте таблетку гидроперита в стакан с водой, чтобы получить свежий 3% - ный раствор пероксида водорода. Помешивая раствор ложечкой, дождитесь полного растворения таблетки в воде.
Добавляйте понемногу раствор пероксида водорода к образцам животных и растительных тканей.
Наблюдайте происходящие процессы в тканях.
Опишите наблюдаемые явления.
Объясните наблюдаемые явления, используя знания о белковой природе ферментов.
Результаты занесите в таблицу::( ПОДСКАЗКА- КАРТОФЕЛЬ И МЯСО-АНАЛОГИЧНО ЗАПОЛНЯЕМ)
Образцы тканей | Наблюдаемые явления | Объяснение наблюдаемых явлений |
Сырой картофель | выделяются пузырьки | образовался кислород из перекиси водорода |
Варёный картофель | ничего не происходит | фермент разрушен, перекись водорода не расщепляется |
Сырое мясо | ||
Варёное мясо | |
Нуклеиновые кислоты.
СНАЧАЛА ВНИМАТЕЛЬНО ПОСМОТРИТЕ ВИДЕО. ЗАТЕМ ПРОЧИТАЙТЕ НИЖЕ ТЕКСТ, ЗАПИШИТЕ ГЛАВНОЕ.
Строение нуклеиновых кислот
В отличие от белков, углеводов и липидов, нуклеиновые кислоты никогда не накапливаются в клетке в больших количествах, и обнаружить их можно только с помощью специальных химических методов. Поэтому они были открыты только во второй половине XIX в., а по-настоящему изучить их роль в процессах жизнедеятельности удалось лишь во второй половине XX в. Так как первоначально они были обнаружены только в ядрах, им дали название нуклеиновые (от лат. nucleus — ядро).
Нуклеиновые кислоты — биологические полимеры, мономерами которым служат нуклеотиды. Связи между нуклеотидами легко подвергаются гидролизу (распаду при реакции с водой). Каждый нуклеотид состоит из остатков углевода, фосфорной кислоты и азотистого основания (рис. 1).

Рис. 1. Строение нуклеотида
Углеводный компонент представлен пентозами — рибозой (в РНК) или дезоксирибозой (в ДНК), у которой отсутствует кислород при втором атоме углерода (рис. 2).

Рис. 2. Пентозы
Остаток фосфорной кислоты образует сложноэфирную связь с гидроксилом при 5-м атоме углерода в сахаре. Соединение нуклеотидов в полимер происходит путем образования фосфатом одного нуклеотида второй эфирной связи с гидроксилом при 3-м углероде соседнего нуклеотида. Такая связь получила название фосфодиэфирной.
Таким образом, нуклеиновые кислоты представляют собой цепь из чередующихся остатков пентозы и фосфорной кислоты (рис. 3).
Кроме того, от первого атома углерода каждой пентозы отходит в бок азотистое основание. В этом нуклеиновые кислоты сходны с белками, в которых полимерная цепь образована пептидными группировками с отходящими от них боковыми радикалами аминокислот. Так же, как и у белков, в нуклеиновых кислотах два конца цепи неодинаковы. С одной стороны имеется не занятое связью пятое положение рибозы, этот конец называют 5’-концом. С противоположной стороны не занят связью третий гидроксил сахара, этот конец обозначают как 3’-конец. 5’-конец считается началом цепи, а 3’-конец — ее окончанием.

Рис. 3. Нуклеиновые кислоты
В одной молекуле нуклеиновой кислоты присутствует только один вид пентозы. Те молекулы, которые содержат рибозу, называют рибонуклеиновой кислотой, или сокращенно РНК. Нуклеиновую кислоту, содержащие дезоксирибозу, называют дезоксирибонуклеиновой кислотой, или ДНК.
Помимо пентозы, нуклеиновые кислоты отличаются азотистыми основаниями. Они представляют собой ароматические циклы, содержащие несколько атомов азота и заместители при определенных атомах углерода.
По структуре гетероциклов азотистые основания делятся на две группы.
Пиримидиновые азотистые основания: урацил, тимин и цитозин. Тимин отличается от урацила только наличием метильной группы, что незначительно меняет его свойства. В РНК встречаются урацил и цитозин, а в ДНК — тимин и цитозин.
Пуриновые основания: аденин и гуанин. Во всех нуклеиновых кислотах присутствуют оба пурина.

Рис. 4. Азотистые основания
За счет чередования различных нуклеотидов в цепи нуклеиновые кислоты могут достигать огромного многообразия (количество видов полимеров равно числу видов мономеров в степени, равной числу мономеров в цепи). И хотя число мономеров в нуклеиновых кислотах меньше, чем в белках, степень полимерности, особенно у ДНК, намного выше. Длина цепей ДНК, входящих в хромосомы разных организмов, составляет от миллионов до сотен миллионов нуклеотидов.
Молекулы РНК обычно короче, их длина — от нескольких десятков до нескольких десятков тысяч нуклеотидов. А при длине цепи 500 нуклеотидов количество возможных комбинаций составляет более 10 300.
принцип комплЕментарности
При анализе содержания азотистых оснований в ДНК из различных организмов Эрвин Чаргафф обнаружил определенные закономерности, позднее названные правилами Чаргаффа.
Молярное содержание аденина всегда равно молярному содержанию тимина, а молярное содержание гуанина — молярному содержанию цитозина.
Количество пуринов равнялось количеству пиримидинов, а отношение А+Т/Г+Ц было различным у разных видов живых организмов.
Это указывало на возможные взаимодействия оснований в ДНК между собой.
На основании правил Чаргаффа и предварительных результатов рентгеноструктурного анализа Джеймс Уотсон и Френсис Крик в 1953 г. предложили двуспиральную модель структуры ДНК.
Согласно этой модели молекула ДНК состоит из двух полинуклеотидных цепей, соединенных между собой азотистыми основаниями. При этом аденин одной цепи всегда взаимодействует с тимином в другой, и наоборот. Точно так же гуанин одной цепи всегда связан с цитозином в другой (рис. 6).

Рис. 5. Образование водородных связей между азотистыми основаниями
Такие пары оснований удерживаются за счет образования между основаниями водородных связей:
- пара А–Т образует 2 водородные связи;
- пара Г–Ц образует 3 водородные связи.
Главной особенностью пар А–Т и Г–Ц является их одинаковая геометрия. Это позволяет построить двуспиральную молекулу с постоянным расстоянием между цепями, построенными остатками сахара и фосфорной кислоты. Образование любых других пар приводит к нарушению правильной структуры.
Такое взаимодействие оснований, при котором они дополняют друг друга до определенной структуры, одинаковой для всех пар, получило название принципа комплементарности.
Пары аденин и тимин, гуанин и цитозин называются комплементарными парами, а две цепочки нуклеиновых кислот, в которых все основания образуют комплементарные пары — комплементарными цепочками. Таким образом, каждая молекула ДНК состоит из двух комплементарных цепочек полинуклеотидов (рис. 6).

Рис. 6. Принцип комплиментарности
Важной особенностью структуры двойной спирали ДНК является то, что комплементарные цепи направлены в противоположные стороны, т. е. 5’-конец одной цепи связан комплементарными основаниями с 3’-концом другой цепи, и наоборот. Основания плотно слипаются своими плоскостями, что делает связь между цепочками еще более прочной. Такое слипание получило название стэкинг-взаимодействия. В результате в центре молекулы ДНК находится как бы стержень, построенный из азотистых оснований, а по краям он обвит двумя нитями, состоящими из чередующихся остатков дезоксирибозы и фосфорной кислоты.
сравнение ДНК и РНК
| Нуклеиновая кислота | Строение | Функции | Особенности |
| ДНК | азотистое основание: аденин (А) тимин (Т) гуанин (Г) цитозин (Ц) углевод: дезоксирибоза остаток фосфорной кислоты | хранение и передача наследственной информации | двойная спираль (по принципу комплементарности); способность к репликации (самоудвоению) |
| РНК | азотистое основание: аденин (А) урацил (У) гуанин (Г) цитозин (Ц) углевод: рибоза остаток фосфорной кислоты | биосинтез белка | одинарная цепочка нуклеотидов |
ГРУППА 408 ХИМИЯ 15,16
ТЕМА 15, 16:
Практическая работа № 3. Получение и свойства карбоновых кислот
Цель работы: Получить уксусную кислоту и изучить её свойства.
Реактивы и оборудование: ацетат натрия, серная кислота (конц.), уксусная кислота, магний (порошок), цинк, гидроксид натрия, карбонат натрия, фенолфталеин, универсальная индикаторная бумага, прибор для получения и собирания кислоты, спиртовка, пробирку, вата, спички.
Ход работы:
Внимание!!! Работа с кислотами!! Соблюдайте ТБ!
Опыт 1. Получение уксусной кислоты.
В пробирку с ацетатом натрия прибавить 1- 2 мл концентрированной серной кислоты. Закрыть пробирку пробкой с газоотводной трубкой, конец которой опустите в другую пробирку вход в пробирку прикрыть ваткой, смотрите рисунок:
Смесь в пробирке осторожно нагревайте до тех пор, пока в приёмнике – пробирке не соберётся 1 -2 мл жидкости. Прекратите нагревание, закройте спиртовку.
Опустите в пробирку с образовавшейся жидкости универсальную индикаторную бумагу. Как изменился цвет индикатора? Почему? Запишите уравнение диссоциации уксусной кислоты.
Опишите запах, образовавшейся жидкости? Соблюдайте осторожность при определении запаха! Составьте уравнение данной химической реакции.
Опыт 2. Взаимодействие уксусной кислоты с металлами.
Посмотрите видео-опыт «Взаимодействие уксусной кислоты с металлами»
В одну пробирку положите гранулу цинка, в другую порошок магния. В обе пробирки прилейте 1 мл уксусной кислоты. Что наблюдаете? Сравните скорость этих реакций? Запишите соответствующие уравнения химических реакций, назовите продукты, укажите тип реакции.
Опыт 3. Взаимодействие уксусной кислоты с основаниями.
Посмотрите видео-опыт «Взаимодействие уксусной кислоты с основаниями»
В пробирку налейте 1 мл гидроксида натрия и добавьте 1 каплю фенолфталеина. Что наблюдаете? Почему?
Затем добавьте к содержимому пробирки уксусную кислоту. Почему происходит обесцвечивание? Запишите УХР (УРАВНЕНИЕ ХИМИЧЕСКОЙ РЕАКЦИИ), назовите продукты.
Название опыта. Что делали. | УХР. Наблюдения. Выводы |
опыт 2 опыт 3 | 2СН3СООН + Мg = H2↑ + ( CH3COO)2 Mg- выдел. газ 2СН3СООН + Zn = H2 ↑ + ( CH3COO)2 Zn - выдел. газ 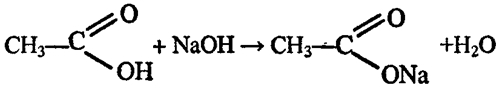 |
Вывод:
ГРУППА 406 ХИМИЯ 4
Тема 4: Неметаллы. Особенности строения атомов. Неметаллы – простые вещества. |
ПОЛОЖЕНИЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ-НЕМЕТАЛЛОВ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА
Из более сотни известных химических элементов простые вещества неметаллы образуют 22 элемента, причем все они находятся в главных (А) подгруппах.
Элементы-неметаллы находятся в правом верхнем углу Периодической таблицы, в главных подгруппах выше диагонали бериллий – астат. Причем с увеличением номера главной подгруппы число неметаллов в ней закономерно увеличивается на один (рис. 1).

Рис. 1. Расположение неметаллов среди элементов подгрупп А (выделены красным)
ОСОБЕННОСТИ СТРОЕНИЯ АТОМОВ НЕМЕТАЛЛОВ
Неметаллические свойства связаны со способностью атомов элементов присоединять к себе электроны. Притяжение внешних электронов к ядру тем сильнее, чем меньше размеры атома и больше заряд ядра. В периоде с ростом заряда ядра от элемента к элементу радиус атома уменьшается, сильнее становится притяжение внешних электронов к ядру и неметаллические свойства усиливаются. Вместе с тем от периода к периоду радиус атома увеличивается из-за увеличения числа электронных слоев, и ядра этих атомов все слабее притягивают к себе внешние электроны. Поэтому с ростом номера периода в нем уменьшается количество элементов-неметаллов.
На внешнем электронном слое в атомах неметаллов большее число электронов, чем в атомах металлов. Электроотрицательность атомов неметаллов существенно выше, чем атомов металлов.
ОСОБЕННОСТИ СТРОЕНИЯ ЭЛЕМЕНТОВ VIII-A ПОДГРУППЫ
Элементы VIII-А подгруппы завершают каждый период.
Особенностью строения атомов неона, аргона, криптона, ксенона и радона является устойчивый восьмиэлектронный внешний слой (октет), а гелия – двухэлектронный (дуплет). При обычных условиях их простые вещества, как правило, не вступают в химические реакции и представляют собой одноатомные газы. Поэтому их часто называют инертными, или благородными, газами. Последнее название более целесообразно, так как известны некоторые соединения этих элементов (например, оксид ксенона, фторид радона и др.).
ИЗМЕНЕНИЕ СВОЙСТВ НЕМЕТАЛЛОВ В ГРУППАХ
В группах с увеличением заряда ядра увеличивается радиус атома, т. к. растет число электронных слоев в атоме. Следовательно, способность притягивать электроны, электроотрицательность и окислительные свойства уменьшаются.
В периодах же, наоборот, с увеличением заряда ядра электроотрицательность и окислительные свойства увеличиваются, т. к. уменьшается радиус атома.
Самый электроотрицательный элемент – это фтор. Поэтому он и самый активный неметалл.
Изменение некоторых свойств элементов неметаллов рассмотрено в таблице на рис. 2 на примере элементов третьего периода.
Свойства | Si | P | S | Cl |
Порядковый номер | 14 | 15 | 16 | 17 |
Число внешних электронов | 4 | 5 | 6 | 7 |
Радиус атома в нм | 0,117 | 0,111 | 0,104 | 0,099 |
Высшая степень окисления | +4 (SiO2) | +5 (Р2О5) | +6(SO3) | +7 (Cl2O7) |
Низшая степень окисления | -4 (SiH4) силан | -3 (PH3) фосфин | -2 (H2S) сероводород | -1 (HCl) хлороводород |
Неметаллический характер |
усиливается | |||
Рис. 2. Сравнение свойств неметаллов третьего периода
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Распространенность неметаллов в космосе и на земле различна.
Самый распространенный элемент земной коры – кислород, он составляет примерно половину общей массы элементов, образующих земную кору (49,13 %). Кислород также является составной частью атмосферы, он занимает 21 % ее объема.
Вторым по распространенности на земле элементом является кремний. Его в земной коре 27,6 % по массе. Кремний с кислородом образует самые разнообразные природные соединения вследствие своего особенного родства с кислородом.
К распространенным элементам неметаллам следует отнести и азот. В земной коре его 0,01 % по массе, а в атмосфере – 78 % по объему.
Водород распространен в земной коре незначительно – всего 1 % по массе. Но во Вселенной он является господствующим элементом. Его особая роль в жизни Вселенной заключается в том, что водород является источником энергии, питающей Солнце и другие звезды.
В значительно меньших количествах, чем перечисленные элементы, в природе встречаются углерод, фосфор, сера. Но эти элементы наряду с кислородом, углеродом и водородом входят в состав живых организмов и выполняют важные биологические функции. Поэтому их называют биогенными элементами.
Подведение итогов урока
Из материалов урока вы узнали, почему химических элементов-неметаллов намного меньше, чем металлов, как различаются по строению атомы металлов и неметаллов, а также какими свойствами обладают неметаллические элементы.
