14.09.22 г. СРЕДА . Группы 308,306,408
Здравствуйте, уважаемые студенты, заведите, пожалуйста тетрадь для конспектов по химии, другую- по биологии, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения).Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 308 ХИМИЯ 5,6
Тема:Сущность и классификация химических реакций.
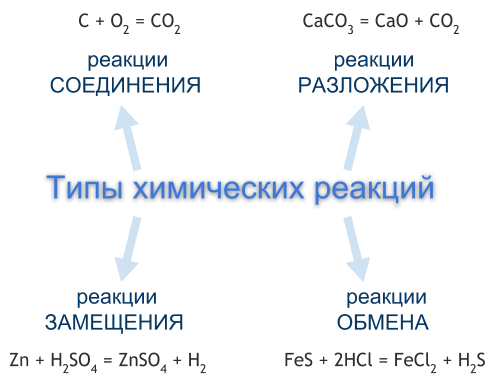
Типы химических реакций
В природе существует огромное множество различных химических реакций. Для их упорядочивания и систематизации придумано несколько способов их классификации, то есть разделения на различные типы.
Чаще всего химические реакции классифицируют по числу и составу реагентов и продуктов реакции. По этой классификации выделяют четыре типа химических реакций — это реакции соединения, разложения, замещения, обмена. Однако существуют химические реакции, которые нельзя отнести ни к одному из перечисленных типов.
РЕАКЦИИ СОЕДИНЕНИЯ
Реакция соединения — это реакция, реагентами которой являются два или несколько простых или сложных веществ, а продуктом — одно сложное вещество.
Примеры реакций соединения
Образование оксидов из простых веществ:
C + O2 = CO2, 2Mg + O2 = 2MgO
Взаимодействие металла с неметаллом и получение соли:
2Fe + 3Cl2 = 2FeCl3
Взаимодействие оксида с водой:
CaO + H2O = Ca(OH)2
РЕАКЦИИ РАЗЛОЖЕНИЯ
Реакция разложения — это реакция, реагентом которой является одно сложное вещество, а продуктом — два или несколько простых или сложных веществ. Чаще всего реакции разложения протекают при нагревании.
Примеры реакций разложения
Разложение мела при нагревании:
CaCO3 = CaO + CO2
Разложение воды под действием электрического тока:
2H2O = 2H2 + O2
Разложение оксида ртути при нагревании:
2HgO = 2Hg + O2
РЕАКЦИИ ЗАМЕЩЕНИЯ
Реакция замещения — это реакция, реагентами которой являются простое и сложное вещества, а продуктами — также простое и сложное вещества, но атомы одного из элементов в сложном веществе заменены на атомы простого реагента.
Примеры реакций замещения
Замещение водорода в кислотах:
Zn + H2SO4 = ZnSO4 + H2
Вытеснение металла из соли:
Fe + CuSO4 = FeSO4 + Cu
Образование щелочи:
2Na + 2H2O = 2NaOH + H2
РЕАКЦИИ ОБМЕНА
Реакция обмена — это реакция, реагентами и продуктами которой являются по два сложных вещества, в процессе реакции реагенты обмениваются между собой своими составными частями, в результате чего образуются другие сложные вещества.
Примеры реакций обмена
Взаимодействие соли с кислотой:
FeS + 2HCl = FeCl2 + H2S
Взаимодействие двух солей:
2K3PO4 + 3MgSO4 = Mg3(PO4)2 + 3K2SO4
Тема: Окислительно-восстановительные реакции. Степень окисления. Окислитель и восстановление. Восстановитель и окисление. Метод электронного баланса для составления уравнений окислительно-восстановительных реакций.
Многие химические реакции уравниваются простым подбором коэффициентов. Но иногда возникают сложности: количество атомов какого-нибудь элемента в левой и правой частях уравнения никак не удается сделать одинаковым без того, чтобы не нарушить "равновесия" между атомами других элементов.
Чаще всего такие сложности возникают в уравнениях окислительно-восстановительных реакций. Для их уравнивания используют несколько способов, из которых мы пока рассмотрим один – метод электронного баланса.
Напишем уравнение реакции между алюминием и кислородом:
Al + O2 = Al2O3
Пусть вас не вводит в заблуждение простота этого уравнения. Наша задача – разобраться в методе, который в будущем позволит вам уравнивать гораздо более сложные реакции.
Итак, в чем заключается метод электронного баланса? Баланс – это равенство. Поэтому следует сделать одинаковым количество электронов, которые отдает один элемент и принимает другой элемент в данной реакции. Первоначально это количество выглядит разным, что видно из разных степеней окисления алюминия и кислорода:
0 | 0 | +3 –2 | ||
Al | + | O2 | = | Al2O3 |
Алюминий отдает электроны (приобретает положительную степень окисления), а кислород – принимает электроны (приобретает отрицательную степень окисления). Чтобы получить степень окисления +3, атом алюминия должен отдать 3 электрона. Молекула кислорода, чтобы превратиться в кислородные атомы со степенью окисления -2, должна принять 4 электрона:
`
Чтобы количество отданных и принятых электронов выровнялось, первое уравнение надо умножить на 4, а второе – на 3. Для этого достаточно переместить числа отданных и принятых электронов против верхней и нижней строчки так, как показано на схеме вверху.
Если теперь в уравнении перед восстановителем (Al) мы поставим найденный нами коэффициент 4, а перед окислителем (O2) – найденный нами коэффициент 3, то количество отданных и принятых электронов выравнивается и становится равным 12. Электронный баланс достигнут. Видно, что перед продуктом реакции Al2O3 необходим коэффициент 2. Теперь уравнение окислительно-восстановительной реакции уравнено:
4Al + 3O2 = 2Al2O3
Все преимущества метода электронного баланса проявляются в более сложных случаях, чем окисление алюминия кислородом. Например, известная всем "марганцовка" – марганцевокислый калий KMnO4 – является сильным окислителем за счет атома Mn в степени окисления +7. Даже анион хлора Cl– отдает ему электрон, превращаясь в атом хлора. Это иногда используют для получения газообразного хлора в лаборатории:
+7 | –1 | 0 | +2 | |||||||||
KMnO4 | + | KCl | + | H2SO4 | = | Cl2 | + | MnSO4 | + | K2SO4 | + | H2O |
Составим схему электронного баланса:
Двойка и пятерка – главные коэффициенты уравнения, благодаря которым удается легко подобрать все другие коэффициенты. Перед Cl2 следует поставить коэффициент 5 (или 2·5 = 10 перед KСl), а перед KMnO4 – коэффициент 2. Все остальные коэффициенты привязывают к этим двум коэффициентам. Это гораздо легче, чем действовать простым перебором чисел.
2KMnO4 + 10KCl + 8H2SO4 = 5Cl2 + 2MnSO4 + 6K2SO4 + 8H2O
Чтобы уравнять количество атомов К (12 атомов слева), надо перед K2SO4 в правой части уравнения поставить коэффициент 6. Наконец, чтобы уравнять кислород и водород, достаточно перед H2SO4 и H2O поставить коэффициент 8. Мы получили уравнение в окончательном виде.
Метод электронного баланса, как мы видим, не исключает и обыкновенного подбора коэффициентов в уравнениях окислительно-восстановительных реакций, но может заметно облегчить такой подбор.
** Окислительно-восстановительные реакции играют огромную роль в природе и технике. Без этих реакций невозможна жизнь, потому что дыхание, обмен веществ, синтез растениями клетчатки из углекислого газа и воды – все это окислительно-восстановительные процессы.
В технике с помощью реакций этого типа получают такие важные вещества как аммиак (NH3), серную (H2SO4)и соляную (HCl) кислоты и многие другие продукты. Вся металлургия основана на восстановлении металлов из их соединений – руд. Большинство химических реакций – окислительно-восстановительные. Приведем важнейшие определения, связанные с окислительно-восстановительными реакциями.
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Окислителями называются вещества, присоединяющие электроны. Во время реакции они восстанавливаются.
Восстановителями называются вещества, отдающие электроны. Во время реакции они окисляются.
Поскольку окислитель присоединяет электроны, степень окисления его атомов может только уменьшаться. Наоборот, восстановитель теряет электроны и степень окисления его атомов должна повышаться.
Окисление всегда сопровождается восстановлением и, наоборот, восстановление всегда связано с окислением.
Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
Если каждый атом окислителя может принять иное количество электронов, чем отдает атом восстановителя, то необходимо так подобрать количество атомов того и другого реагента, чтобы количество отдаваемых и принимаемых электронов стало одинаковым. Это требование положено в основу метода электронного баланса, с помощью которого уравнивают уравнения окислительно-восстановительных реакций.
ГРУППА 306 Биология 2
Тема: Неорганические соединения клетки.
Неорганические вещества клетки
В состав клетки входит около 70 элементов Периодической системы элементов Менделеева, а 24 из них присутствуют во всех типах клеток. Все присутствующие в клетке элементы делятся, в зависимости от их содержания в клетке, на группы:
Другой принцип классификации элементов:
В состав клетки входят молекулы неорганических и органических соединений.
Неорганические соединения клетки – вода и неорганические ионы.
Вода – важнейшее неорганическое вещество клетки. Все биохимические реакции происходят в водных растворах. Молекула воды имеет нелинейную пространственную структуру и обладает полярностью. Между отдельными молекулами воды образуются водородные связи, определяющие физические и химические свойства воды.
Физические свойства воды | Значение для биологических процессов |
Высокая теплоемкость (из-за водородных связей между молекулами) и теплопроводность (из-за небольших размеров молекул) | Транспирация |
Прозрачность в видимом участке спектра | Высокопродуктивные биоценозы прудов, озер, рек ( из-за возможности фотосинтеза на небольшой глубине) |
Практически полная несжимаемость (из-за сил межмолекулярного сцепления) | Поддержание формы организмов: форма сочных органов растений, положение трав в пространстве, гидростатический скелет круглых червей, медуз, амниотическая жидкость поддерживает и защищает плод млекопитающих |
Подвижность молекул (из-за слабости водородных связей) | Осмос: поступление воды из почвы; плазмолиз |
Вязкость (водородные связи) | Смазывающие свойства: синовиальная жидкость в суставах, плевральная жидкость |
Растворитель (полярность молекул) | Кровь, тканевая жидкость, лимфа, желудочный сок, слюна, у животных; клеточный сок у растений; водные организмы используют растворенный в воде кислород |
Способность образовывать гидратационную оболочку вокруг макромолекул (из-за полярности молекул) | Дисперсионная среда в коллоидной системе цитоплазмы |
Оптимальное для биологических систем значение сил поверхностного натяжения (из-за сил межмолекулярного сцепления) | Водные растворы – средство передвижения веществ в организме |
Расширение при замерзании (из-за образования каждой молекулой максимального числа – 4 – водородных связей_ | Лед легче воды, выполняет в водоемах функцию теплоизолятора |
Неорганические ионы:
катионы K+, Na+, Ca2+ , Mg2+ и анионы Cl–, NO3- , PO4 2-, CO32-, НPO42-.
Разность между количеством катионов и анионов (Nа+, К+, Сl-) на поверхности и внутри клетки обеспечивает возникновение потенциала действия, что лежит в основе нервного и мышечного возбуждения.
Анионы фосфорной кислоты создают фосфатную буферную систему, поддерживающую рН внутриклеточной среды организма на уровне 6—9.
Угольная кислота и ее анионы создают бикарбонатную буферную систему и поддерживают рН внеклеточной среды (плазмы крови) на уровне 7—4.
Соединения азота служат источником минерального питания, синтеза белков, нуклеиновых кислот.
Атомы фосфора входят в состав нуклеиновых кислот, фосфолипидов, а также костей позвоночных, хитинового покрова членистоногих.
Ионы кальция входят в состав вещества костей; они также необходимы для осуществления мышечного сокращения, свертывания крови.
Таблица. Роль макроэлементов на клеточном и организменном уровне организации. (для ознакомления)

Таблица. Роль микроэлементов в жизни клетки, растительного и животного организмов.

Тесты
Часть А
А1. Полярностью воды обусловлена ее способность
1) проводить тепло
3) растворять хлорид натрия
2) поглощать тепло
4) растворять глицерин
А2. Больным рахитом детям необходимо давать препараты, содержащие
1) железо
2) калий
3) кальций
4) цинк
А3. Проведение нервного импульса обеспечивается ионами:
1) калия и натрия
2) фосфора и азота
3) железа и меди
4) кислорода и хлора
А4. Слабые связи между молекулами воды в ее жидкой фазе называются:
1) ковалентными
2) гидрофобными
3) водородными
4) гидрофильными
А5. В состав гемоглобина входит
1) фосфор
2) железо
3) сера
4) магний
А6. Выберите группу химических элементов, обязательно входящую в состав белков
1) Na, K, O, S
2) N, P, C, Cl
3) C, S, Fe, O
4) C, H, O, N
А7. Пациентам с гипофункцией щитовидной железы дают препараты, содержащие
1) йод
2) железо
3) фосфор
4) натрий
Часть В
В1. Выберите функции воды в клетке
1) энергетическая
2) ферментативная
3) транспортная
4) строительная
5) смазывающая
6) терморегуляционная
В2. Выберите только физические свойства воды
1) способность к диссоциации
2) гидролиз солей
3) плотность
4) теплопроводность
5) электропроводность
6) донорство электронов
Часть С
С1. Какие физические свойства воды определяют ее биологическое значение?
ГРУППА 408 БИОЛОГИЯ 9,10
Тема: Факторы эволюции человека.
Эволюция человека началась более 10 млн лет назад и продолжается до сих пор. На формирование современного вида человека действовали социальные и биологические факторы антропогенеза.
ФАКТОРЫ
Человек – биологический вид, вышедший из биосферы и создавший искусственную среду, которую назвали ноосферой. Поэтому развитие человечества зависит от двух факторов:
- биологических – естественных и одинаковых для всех видов живых существ;
- социальных – обусловленных обществом, нормами поведения, трудом, культурой.
Изначально на эволюцию человека действовали только биологические факторы. Однако по мере эволюционного усложнения, как отдельного вида человека, так и общества (племени) в целом, значительную роль стали играть социальные факторы.
Антропогенез иногда называют антропосоциогенезом, подчёркивая значимость социальной жизни в эволюции человека.
БИОЛОГИЧЕСКИЕ
Человечество, как любой другой вид, формировался под влиянием движущих сил эволюции, к которым относятся:
- изменчивость;
- естественный отбор;
- мутации;
- изоляции;
- борьба за существование.
На ранних этапах антропогенеза решающую роль играл естественный отбор. Благодаря силам естественного отбора человечество приобрело характерные черты, отличающие его от остальных человекообразных обезьян. Эволюции во многом способствовало изменение образа жизни в связи с изменением климата и рельефа местности.
Благодаря естественному отбору человечество приобрело:
- развитый мозг;
- хватательную кисть;
- прямохождение;
- голую кожу (волосы сохранились только на голове).
Считается, что предками человека были дриопитеки, жившие на деревьях. С исчезновением лесов им пришлось постепенно выйти в саванны и приспособиться к новым условиям, что способствовало дальнейшей эволюции.
СОЦИАЛЬНЫЕ
На развитие способностей человека повлияли социальные факторы антропогенеза. В первую очередь выделяют коллективный труд, а именно охоту. Человек – довольно слабое существо, чтобы охотиться на крупную и опасную добычу в одиночку. Поэтому сплочение племени, распределение задач, налаживание отношений способствовали успешной охоте.
Тема: Предмет экологии. Экологические факторы среды.
Экология — это наука о взаимоотношениях организмов между собой и с окружающей неживой природой.
Термин «экология» ввел в научный обиход в 1866 г. немецкий зоолог и эволюционист, последователь Ч. Дарвина Э. Геккель.
Задачи экологии:
- Изучение пространственного размещения и адаптационных возможностей живых организмов, их роль в круговороте веществ (экология особей, или аутэкология).
- Изучение динамики численности и структуры популяций (популяционная экология).
- Изучение состава и пространственной структуры сообществ, круговорота веществ и энергии в биосистемах (экология сообществ, или экосистемная экология).
- Изучение взаимодействия с окружающей средой отдельных таксономических групп организмов (экология растений, экология животных, экология микроорганизмов и т. д.).
- Изучение различных экосистем: водных (гидробиология), лесных (лесоведение).
- Реконструкция и изучение эволюции древних сообществ (палеоэкология).
Экология тесно связана с другими науками: физиологией, генетикой, физикой, географией и биогеографией, геологией и эволюционной теорией.
В экологических расчетах применяется методы математического и компьютерного моделирования, метод статистического анализа данных.
экологические факторы
Экологические факторы — компоненты окружающей среды, влияющие на живой организм.
Существование определенного вида зависит от сочетания множества различных факторов. Причем для каждого вида значение отдельных факторов, а также их комбинации весьма специфичны.
Виды экологических факторов:
- Абиотические факторы — факторы неживой природы, прямо или косвенно действующие на организм.
Примеры: рельеф, температура и влажность воздуха, освещенность, течение и ветер. - Биотические факторы — факторы живой природы, влияющие на организм.
Примеры: микроорганизмы, животные и растения. - Антропогенные факторы — факторы, связанные с деятельностью человека.
Примеры: строительство дорог, распашка земель, промышленность и транспорт.
Абиотические факторы
- климатические: годовая сумма температур, среднегодовая температура, влажность, давление воздуха