Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения).Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 308 ХИМИЯ 46,47
ТЕМА 46,47:Химия в сельском хозяйстве. Химизация сельского хозяйства и ее направления. Растения и почва, почвенный поглощающий комплекс. Удобрения и их классификация.Химические средства защиты растений. Отрицательные последствия применения пестицидов и борьба с ними. Химизация животноводства.
Химия в сельском хозяйстве и её направления
Химизация — это одно из направлений научно-технического прогресса, основанное на широком применении химических веществ, процессов и методов в различных отраслях, например в сельском хозяйстве.
Основные направления химизации сельского хозяйства:
Производство минеральных макро- и микроудобрений, а также кормовых фосфатов.
Внесение извести, гипса и других веществ для улучшения структуры почв.
Применение химических средств защиты растений: гербицидов, зооцидов и инсектицидов и т. д.
Использование в растениеводстве стимуляторов роста и плодоношения растений.
Разработка способов выращивания экологически чистой сельскохозяйственной продукции.
Повышение продуктивности животных с помощью стимуляторов роста, специальных кормовых добавок.
Производство и применение полимерных материалов для сельского хозяйства.
Производство материалов для средств малой механизации, использующихся в сельском хозяйстве.
Основная цель химизации сельского хозяйства — обеспечение роста производства, улучшение качества и продление сроков сохранности сельскохозяйственной продукции, повышение эффективности земледелия и животноводства.
Удобрения и их классификация
Эффективность удобрений значительно возрастает, если их применяют в комплексе с другими приемами агротехники. Сейчас в мире более 90% удобрений не возвращается в почву, откуда они взяты с урожаем, а безвозвратно теряется в сточных трубах городов и населенных пунктов. Чудовищная концентрация населения в городах привела к извлечению из почвы всех минеральных удобрений, вследствие чего почва производит продукты питания низкого биологического качества, которые снижают энергию и жизнедеятельность народа. Однако чрезмерное и неправильное использование удобрений в сельском хозяйстве дает также значительный отрицательный эффект. Использование удобрений и пестицидов в сельском хозяйстве приводит к избыточному содержанию нитритов и нитратов в сельскохозяйственной продукции, загрязнению водоемов, морей и океанов вымываемых удобрениями.
По происхождению удобрения разделяют на:
неорганические (минеральные)
органические
органо-минеральные
бактериальные.
Минеральные удобрения — неорганические вещества (в основном соли), содержащие необходимые для растений элементы питания. Их получают химической или механической обработкой неорганического сырья и другими способами.
По составу бывают:
Азотные
Фосфорные
Калийные
Микроудобрения (борные, молибденовые и т. д.)
Органические удобрения. Питательные элементы в них находятся в веществах растительного и животного происхождения. Это навоз, торф, жмых, фекалии, пищевые отходы и отбросы, люпин, сераделла.
Органо-минеральные удобрения содержат органические и минеральные вещества. Их получают путем обработки аммиаком и фосфорной кислотой органических веществ (торфа, сланцев, бурого угля) или путем смешивания навоза либо торфа с фосфорными удобрениями.
Бактериальные удобрения — препараты, содержащие культуру микроорганизмов, фиксирующих органическое вещество почвы и удобрений (азотобактерин, нитрагин почвенный).
По агрегатному состоянию они могут быть:
Твердыми
Жидкими
Суспензированными
По агрохимическому воздействию они могут быть:
Прямые
Косвенные
Препараты, регулирующие рост растений
I. Прямые удобрения предназначаются для непосредственного питания растений. Они содержат азот, фосфор, калий, магний, серу, железо и микроэлементы (В, Mo, Cu, Zn) и делятся на:
a) Простые, которые содержат один из элементов питания: азот, фосфор, калий, молибден и т. д. В свою очередь, их подразделяют на:
1) азотные удобрения, которые различают по форме соединений азота:
Аммиачные
Аммонийные
Нитратные
Амидные
Их сочетания
2) фосфорные удобрения, в основу классификации которых положена их растворимость в воде и органических кислотах, они делятся на:
растворимые в воде (гидрофосфат аммония)
нерастворимые в воде, но растворимые в растворах лимонной кислоты и ее солей (преципитат)
труднорастворимые в воде (фосфоритная мука, простой суперфосфат)
3) калийные удобрения разделают на:
сырые соли (минералы каинит, сильвинит)
концентрированные удобрения, полученные переработкой природных калийных солей (КС1, K2SO4), золы (древесные и торфяные), содержащие поташ — К2СО3
4) микроудобрения — технические смеси, содержащие микроэлементы В(ОН)3 (Н3ВО3, молибдат аммония и др.).
b) Комплексные удобрения: содержат не менее двух питательных элементов.
II. Косвенные удобрения применяют для химического, физического, микробиологического воздействия на почву с целью улучшения условий использования удобрений. Например, для нейтрализации кислотности почв применяют молотые известняки, доломит, гашеную известь; для мелиорации солонцов используют гипс; для подкисления почв используют гидросульфит натрия.
Химическая мелиорация почв
Химическую мелиорацию проводят для улучшения качества почв с повышенной кислотностью или щелочностью. В первом случае осуществляют известкование, во втором — гипсование.
Химические средства защиты растений
Ежегодно из-за вредителей, сорняков и болезней в мире теряется до 24% урожая. Суммарный ущерб сельскому хозяйству ежегодно исчисляется в 70 млрд долларов.
Для борьбы с вредителями, сорняками и болезнями в нашей стране ежегодно выпускают более 500 тыс. т пестицидов. Их применение позволяет сберечь до сотни тысяч тонн урожая в год.
По назначению пестициды делят на:
инсектициды (для борьбы с вредными насекомыми)
фунгициды ( для излечения растений и почвы от грибковых заболеваний)
гербициды (для уничтожения сорняков)
бактерициды (для уничтожения вредных микроорганизмов)
зооциды (для уничтожения грызунов)
половые аттрактанты (для приманки вредителей и их уничтожения)
репелленты (для отпугивания вредных насекомых от растений, которыми они питаются)
хемостерилянты (для стерилизации вредных насекомых)
Широкое применение пестицидов не только ведет к росту урожайности, но и к таким отрицательным последствиям, как:
гибель диких животных при обработке полей пестицидами
массовое размножение вредителей после применения пестицидов
появление вредителей, устойчивых к пестицидам
Уменьшить вредное влияние пестицидов на природу можно, пользуясь следующими методами борьбы с грызунами:
Карантинный метод (предепреждение распространения вредителей)
Селекционный метод (выведении сортов растений и пород животных, устойчивых к болезням и вредным насекомым)
Агротехнический метод (обработки почвы, введение севооборотов и т.д.)
Химический метод (созданию новых пестицидов с высокой избирательностью действия и большой скоростью распада)
Физический способ (ультразвук, ультрафиолет, электропропольник и т.д.)
Химизация животноводства — это комплекс мер, способствующих повышению качества кормов и продуктивности животных. Основные ее направления:
- производство химических консервантов и стабилизаторов кормов;
- производство кормовых дрожжей и микробиологического белка;
- использование мочевины и других кормовых добавок;
- применение стимуляторов роста животных.
Так, для создания прочной кормовой базы важно не только увеличить заготовку кормов, но и улучшить их качество, снизить потери при уборке и хранении. Наиболее прогрессивная форма заготовки зеленых кормов — химическое консервирование, так как оно обеспечивает хорошую сохранность питательных веществ, подавляет развитие гнилостных и маслянокислых бактерий, предотвращает нежелательные ферментативные процессы. В качестве консервантов используют пропионовую и бензойную кислоты, дисульфат натрия Na2S2O7 и гидросульфат натрия NaHSO4, концентрат низкомолекулярных кислот. Химические добавки при силосовании трав, кукурузы, подсолнечника и бобово-злаковых смесей повышают качество корма и значительно сокращают потери питательных веществ. Для повышения содержания перевариваемого протеина в рационах скота и птицы используют кормовые дрожжи, белки микробного происхождения, мочевину и другие вещества. Так, применение 1 т кормовых дрожжей в рационе птицы позволяет дополнительно получить по 2 т мяса или 35 тыс. яиц.
При составлении пищевых рационов для откорма животных в настоящее время экологически более обоснованно вводить в растительную пищу незаменимые аминокислоты, которые получают ферментативным или полным синтезом. Так, добавкой 0,4% лизина к пшеничной муке можно повысить ее биологическую ценность не менее чем на 50%.
Недостаток протеина в рационе животных можно восполнить, используя мочевину, бикарбонат аммония и другие аммонийные соли органических и минеральных кислот, безопасные в экологическом отношении. Скармливание животным мочевины позволяет экономить от 20 до 35% кормового белка.
Полноценность рационов сельскохозяйственных животных во многом определяется тем, насколько они сбалансированы по содержанию минеральных веществ, витаминов и других биологически активных веществ.
Напомним значение одного из важнейших биогенных элементов — фосфора. Он входит в состав молекул сложных белков, нуклеиновых кислот, фосфатидов, фитина и других веществ, без которых невозможна жизнь. Содержание фосфора в теле животного (в пересчете на Р2O5) достигает 1 %.
Фосфор вместе с кальцием составляет основу костей животных. На эти два элемента приходится около 65— 70% всех минеральных веществ. Они играют очень важную роль в обмене веществ, поэтому для нормального роста и развития животные нуждаются в кормовых фосфатах. Включение их в рацион коров на 5—10% увеличивает надои молока. Для восполнения дефицита фосфора в качестве кормовых добавок используют также гидроортофосфаты натрия и аммония, кормовой преципитат. Вместе с тем избыток фосфора в рационе затрудняет всасывание и усвоение организмом животного солей магния.
Важную роль в организме животных играют и другие химические элементы. Железо, медь, марганец, кобальт и кальций участвуют в синтезе гемоглобина, сера — в синтезе белка. Иод является составной частью гормона щитовидной железы, хлор — соляной кислоты. Многим животным необходима поваренная соль, содержащая натрий и хлор.
Применение витаминов и стимуляторов роста обеспечивает увеличение суточных привесов крупного рогатого скота, свиней, овец и цыплят.
Чаще всего биологически активные вещества дают в виде так называемых премиксов — смеси микроэлементов, витаминов, ферментных препаратов, антибиотиков.
Вопросы (Уметь устно отвечать,данные вопросы могут быть в контрольной)
- Что понимают под химизацией сельского хозяйства? Каковы ее основные направления?
- Рассмотрите на примерах взаимосвязь растений и почвы.
- Что такое ППК? Какие существуют виды поглощения веществ почвой?
- Рассмотрите общую классификацию удобрений и сравните экологическую безопасность минеральных и органических удобрений.
- Какова классификация удобрений: а) минеральных; б) органических? Ответ иллюстрируйте примерами.
- Какую роль играют микроудобрения в повышении урожайности сельскохозяйственных культур? Существуют ли ультрамикроудобрения? Приведите примеры.
- Что понимают под химической мелиорацией почв? Какие ее виды вам известны? В чем сущность каждого из видов?
- Что такое пестициды? Какие виды пестицидов вы знаете? Какие из них используются: а) в вашем приусадебном (дачном) хозяйстве; б) в быту?
- Как уменьшить отрицательные последствия применения пестицидов на практике?
- Какие направления химизации животноводства вы знаете? Расскажите о каждом из них и опишите значение отдельных химических веществ в животноводстве для решения продовольственной проблемы.
ГРУППА 406 ХИМИЯ 23,24
Тема 23: Алкены. Этилен, его получение (дегидрированием этана, деполимеризацией полиэтилена). Гомологический ряд, изомерия, номенклатура алкенов.
Непредельные углеводороды
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкины, алкадиены (полиены). Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных углеводородов — алканов.
Алкены
Алкены - непредельные (ненасыщенные) ациклические алифатические углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь). Своё второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел.
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда - этилену - CH2=CH2. Общая формула их гомологического ряда - CnH2n.
Гомологический ряд алкенов | Структурные формулы | Названия, суффикс ен, илен |
C2Н4 | CH2=CH2 | этен, этилен |
C3H6 | CH2=CH-CH3 | пропен |
C4H8 | CH2=CH-CH2-CH3 | бутен-1 |
CH3-CH=CH-CH3 | бутен-2 |
Гомологи
СH2=CH2 этен
 СH2=CH-CH3 пропен
СH2=CH-CH3 пропен
СH2=CH-CH2-CH3 бутен-1
СH2=CH-CH2-CH2-СН3 пентен-1
Физические свойства алкенов
Этилен (этен) – бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, малорастворим в воде.
С2 – С4 (газы)
С5 – С17 (жидкости)
С18 – (твёрдые)
§ Алкены не растворяются в воде, растворимы в органических растворителях (бензин, бензол и др.)
§ Легче воды
§ С увеличением Mr температуры плавления и кипения увеличиваются
Строение
Этилен
ХАРАКТЕРИСТИКИ И ФИЗИЧЕСКИЕ СВОЙСТВА ЭТИЛЕНА
Представляет собой бесцветный горючий газ (строение молекулы показано на рис. 1), который обладает слабым запахом. Плохо растворяется в воде, но хорошо в диэтиловом эфире и углеводородах.

Рис. 1. Строение молекулы этилена.
Таблица 1. Физические свойства этилена.
Молекулярная формула | CH2=CH2 (C2H4) |
Молярная масса, г/моль | 28 |
Плотность, г/см3 | 0,001178 |
Температура плавления, oС | -169,2 |
Температура кипения, oС | -103,7 |
ПОЛУЧЕНИЕ ЭТИЛЕНА
Способы получения этилена можно разделить на промышленные и лабораторные. В первом случае этен – это продуктдегидрирования этана, полученного при крекинге нефти.
В лабораторных условиях этилен можно получить при помощи дегидратации этанола (1), дегалогенированиямоно- и дигалогенпроизводных этана (2, 3) или при неполном гидрировании ацетилена (4):
CH3-CH2-OH→CH2=CH2 + H2O (H2SO4 (conc), to = 170) (1);
CH3-CH2-Br + NaOHalcohol→CH2=CH2 + NaBr + H2O (to) (2);
Cl-CH2-CH2-Cl + Zn(Mg) →CH2=CH2 + ZnCl2(MgCl2) (3);
CH≡CH + H2→CH2=CH2 (Pd, to) (4).
Запомните характеристики sр2 –гибридизации
1) Плоское тригональное (треугольное) строение
2) Угол – HCH - 120°
3) Длина (-С=С-) связи – 0,134 нм
4) Связи - σ, p
5) Невозможно вращение относительно (-С=С-) связи
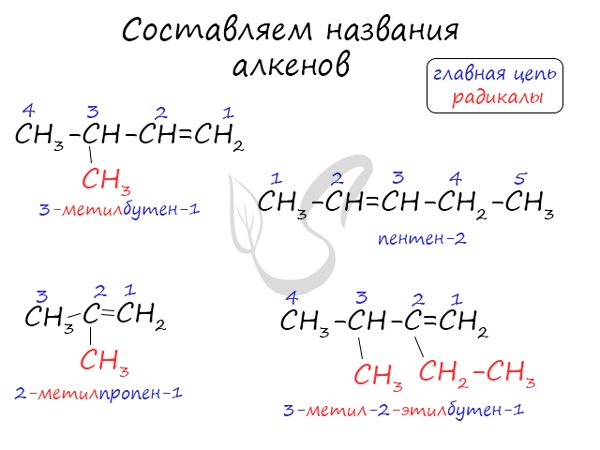
Номенклатура
Названия алкенов формируются путем добавления суффикса "ен" к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.
Образование названий алкенов по номенклатуре ИЮПАК
ТЕМА 24:Химические свойства этилена: горение, качественные реакции (обесцвечивание бромной воды и раствора перманганата калия), гидратация, полимеризация
ХИМИЧЕСКИЕ СВОЙСТВА ЭТИЛЕНА
Этилен способен присоединять водород (гидрирование) (5), галогены (галогенирование) (6), галогеноводороды (гидрогалогенирование) (7) и воду (гидратация) (8):
CH2=CH2 + H2→ CH3-CH3 (kat = Pt) (5);
CH2=CH2 + Br2→BrCH-CHBr (6);
CH2=CH2 + H-Cl → H2C-CHCl (7);
CH2=CH2 + H-OH → CH3-CH2-OH (H+, to) (8).
В зависимости от условий проведения реакции окисления этилена могут быть получены многоатомные спирты (9), эпоксиды (10) или альдегиды (11):
CH2=CH2 + 2KMnO4 + 2KOH → HO-CH2-CH2-OH + 2K2MnO4 (9);
2CH2=CH2 + O2 → 2C2OH4 (эпоксид) (kat = Ag,to) (10);
2CH2=CH2 + O2 → 2CH3-C(O)H (kat = PdCl2, CuCl) (11).
В результате горения этилена происходит разрыв всех связей в молекуле, а продуктами реакции являются углекислый газ и воды:
C2H4 + 2O2→ 2CO2 + 2H2O.
Этилен подвергается полимеризации:
nCH2=CH2→ -[-CH2-CH2-]-n (kat, to).
Кроме этого, если проводить галогенирование этилена при температуре 400oС, то разрыва двойной связи происходить не будет, будет замещаться один атом водорода в углеводородном радикале:
CH2=CH2 + Cl2→ CH2=CH-Cl + HCl.
ПРИМЕНЕНИЕ ЭТИЛЕНА
Основное направление использование этилена — промышленный органический синтез таких соединений как галогенопроизводные, спирты (этанол, этиленгликоль), уксусный альдегид, уксусная кислота и др. Кроме этого данное соединение в производстве полимеров.
| Задание | Осуществите ряд превращений: этан → этен → этанол → этен → хлорэтан → бутан. |
| Решение | Для получения этена из этана необходимо использовать реакцию дегидрирования этана, которая протекает в присутствии катализатора (Ni, Pd, Pt) и при нагревании: С2H6 →C2H4 + H2. Получение этанола из этена осуществляют по реакции гидратации, протекающей водой в присутствии минеральных кислот (серной, фосфорной): С2H4 + H2O = C2H5OH. Для получения этена из этанола используют реакцию дегидротации: C2H5OH →(t, H2SO4) → C2H4 + H2O. Получение хлорэтана из этена осуществляют по реакции гидрогалогенирования: С2H4 + HCl → C2H5Cl. Для получения бутана из хлорэтана используют реакцию Вюрца: 2C2H5Cl +2Na → C4H10 + 2NaCl. |
Тема 12: Лаб.работа №3 «Строение растительной, животной, грибной и бактериальной клеток под микроскопом».
ГРУППА 408 БИОЛОГИЯ 23,24
ТЕМА 23,24: Охрана экосистем.

|