03.03.21 г. 303, 305, 108, 308
ГРУППА 303
ТЕМА: Электрохимический ряд напряжений металлов. Металлотермия.Общие способы получения металлов. Понятие о металлургии.
В таблице Д. И. Менделеева Металлы располагаются ниже диагонали бор-астат.

Рис. 2 Положение металлов в периодической системе Д.И.Менделеева.
Объединены эти элементы в группу металлов по нескольким сходным признакам: относительно большие радиусы атомов, во внешнем слое малое количество электронов (1-3). Например, для атомов калия и железа:


При сближении атомов, валентные орбитали соседних атомом перекрываются, образуется металлическая связь.

Рис.3 Металлическая связь
Вещества с металлической связью реализуют металлические кристаллические решетки, в которых узлы представлены атомами или катионами, а обобществлённые электроны электростатически притягиваются катионами, обеспечивая стабильность и прочность. Такое строение объясняет физические и химические свойства металлов.
Кроме сходного строения атомов у металлов можно выделить группу общих физических свойств: электро- и теплопроводность, пластичность, ковкость, металлический блеск. Эти свойства позволяют человеку широко применять металлы в жизни.
Атомы металлов имеют небольшие значения электроотрицательности:

Все металлы имеют исключительно восстановительные свойства, т.е. способны только отдавать электроны.
Силу восстановительных свойств можно отобразить в электрохимическом ряду напряжения металлов. Используя эти данные, можно записать уравнения взаимодействия металлов с водой. 
Например:
Ba + 2H2O → Ba(OH)2 + H2↑
3Fe+ 4H2O = Fe3O4 + 4H2
Электрохимический ряд напряжения металлов можно использовать для прогнозирования взаимодействия и получения металлов: Металл способен вытеснять (восстанавливать) из солей те металлы, которые стоят правее него, а также вытеснять водород из разбавленных кислот.
 Например:
Например:
CuSO4 + Fe –> FeSO4 + Cu
NiSO4 + Zn –> Ni + ZnSO4
Zn + 2HCl → ZnCl2 + H2
Основные способы получения металлов: пирометаллургия, гидрометаллургия, электрометаллургия.
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, медь восстанавливают из куприта Cu2O прокаливанием с углем (коксом):
SnО2+ 2С = Sn + 2СО↑; Cu2O + С = 2Cu+ СО ↑.
Алюминотермия и магниетермия способы получения металлов, основанные на восстановлении металлов из их соединений (оксидов, галогенидов и др.) более активными металлами (Al и Mg). Например:
tо
2Al + 3BaO → 3Ba + Al2O3
TiCl4 + 2Mg → Ti + 2MgCl2
Металлотермические опыты получения металлов впервые осуществил русский ученый Н. Н. Бекетов в XIX в.
Восстановительные свойства металлов проявляются при взаимодействии с неметаллами. Например:
H2O
2Al + 3I2 → 2AlI3 (инициатором реакции является вода)
to
2Fe + 3Cl2 → 2FeCl3 (реакция горения)
2Na + S → Na2S (реакция идет самопроизвольно при смешивании серы и натрия)
Основными восстановителями для получения металлов являются С, СО, Н2.
Например:

Кроме восстановителей для получения металлов ещё используют электрохимический способ – электролиз.
Электролиз получил широкое распространение в металлургии цветных металлов и в ряде химических производств. Такие металлы, как алюминий, цинк, магний, получают главным образом путём электролиза.
Сущность электролиза заключается в выделении из электролита частиц вещества при протекании через электролитическую ванну постоянного тока и осаждении их на погруженных в ванну электродах. Цель процесса - получение возможно более чистых незагрязнённых примесями металлов.

Рис. 6. Процессы, протекающие при электролизе.
Схема электролизной ванны: 1 - ванна, 2 - электролит, 3 - анод, 4 - катод, 5 - источник питания
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
Задания необходимо решать с использование ряда напряжения металлов:

Задание 1: Составьте уравнение реакций взаимодействия металлов с кислотами, расставьте коэффициенты и найдите их сумму.
Al + Н2SО4 →
Fe + Н2SО4 →
Алюминий и железо стоят левее водорода в ряду напряжения металлов, поэтому могут вытеснить водород из разбавленных кислот. При прохождении реакции наблюдаем выделение водорода в виде мелких пузырьков.
Коэффициенты расставляем, уравнивая количество атомов одного элемента до и после стрелки.
Сумма коэффициентов в уравнении с алюминием : 9 (2+3+1+3).
В уравнении с железом: 4 (1+1+1+1).
Задание 2: Составьте уравнение реакций взаимодействия металлов с солями, расставьте коэффициенты и найдите их сумму.
PbSO4 + Fe →
Zn+CuCl2 →
Свинец стоит в ряду напряжения металлов правее железа, поэтому будет вытеснен из соли более активным металлом (Fe):
PbSO4 + Fe = FeSO4 + Pb,
Аналогичные рассуждения можно применить в следующей реакции:
Zn+CuCl2 = ZnCl2 + Cu (цинк более активный, чем медь).
Так медь, которая в ряду активностей металлов стоит после водорода, не будет реагировать с хлоридом цинка, поэтому реакция замещения не будет проходить.
ZnCl2 + Cu →
Коэффициенты расставляем, уравнивая количество атомов одного элемента до и после стрелки.
Сумма коэффициентов в уравнении с цинком: 4 (1+1+1+1).
В уравнении с железом: 4 (1+1+1+1).
ГРУППА 305
ТЕМА:Соли как электролиты. Способы получения солей.
Например, при растворении кристаллов хлорида натрия в воде положительно заряженные ионы натрия и отрицательно заряженные ионы хлора, из которых образована кристаллическая решётка этого вещества, переходят в раствор:
При электролитической диссоциации сульфата алюминия образуются положительно заряженные ионы алюминия и отрицательно заряженные сульфат-ионы:
2. Соли могут взаимодействовать с металлами.
Например, если кусочек железа поместить в раствор сульфата меди, он покрывается красно-бурым осадком меди. Раствор постепенно меняет цвет с синего на бледно-зелёный, поскольку образуется соль железа(
Видеофрагмент:
взаимодействие сульфата меди( |
При взаимодействии хлорида меди(
Протекает реакция обмена, в ходе которой химически более активная кислота вытесняет менее активную.
Например, при взаимодействии раствора хлорида бария с серной кислотой образуется осадок сульфата бария, а в растворе остаётся соляная кислота:
При взаимодействии карбоната кальция с соляной кислотой образуются хлорид кальция и угольная кислота, которая тут же разлагается на углекислый газ и воду:
Взаимодействие кислот с солями |
Реакция обмена возможна в том случае, если в результате хотя бы один из продуктов является практически нерастворимым (выпадает в осадок).
Например, при взаимодействии нитрата никеля(
Видеофрагмент:
Взаимодействие нитрата никеля( |
При взаимодействии карбоната натрия (соды) с гидроксидом кальция (гашёной известью) образуются гидроксид натрия и практически нерастворимый карбонат кальция:
Например, при взаимодействии сульфида натрия с нитратом серебра образуются нитрат натрия и практически нерастворимый сульфид серебра:
Взаимодействие сульфида натрия с нитратом серебра |
При взаимодействии нитрата бария с сульфатом калия образуются нитрат калия и практически нерастворимый сульфат бария:
6. Некоторые соли при нагревании разлагаются.
- реакции, в ходе которых элементы не изменяют степень окисления,
- окислительно-восстановительные реакции.
A. Реакции разложения солей, протекающие без изменения степени окисления элементов.
При сильном нагревании карбонат кальция (мел, известняк, мрамор) разлагается, образуя оксид кальция (жжёную известь) и углекислый газ:
| Разложение мела при нагревании |
| Разложение гидрокарбоната натрия |
Кристаллогидраты солей при нагревании теряют воду. Например, пентагидрат сульфата меди(
При обычных условиях образовавшийся безводный сульфат меди можно превратить в кристаллогидрат:
Видеофрагмент:
Разрушение и образование медного купороса |
Аналогичная химическая реакция протекает, когда к гемигидрату сульфата кальция (жжёному гипсу) при помешивании добавляют воду. Получившаяся кашица быстро застывает в результате образования дигидрата сульфата кальция (гипса):
Видеофрагмент:
| Застывание гипса |
Б. Окислительно-восстановительные реакции разложения солей.
Например, при термическом разложении нитрата калия образуются нитрит этого металла и кислород:
Видеофрагмент:
Разложение нитрата калия |
Разложение перманганата калия в лабораторных условиях можно использовать для получения кислорода. При разложении этой соли, кроме кислорода, образуются манганат калия и оксид марганца(
Взаимопревращение карбонатов и гидрокарбонатов |
2. Кислые соли образуются при неполной нейтрализации многоосновных кислот.
Например, при взаимодействии гидроксида натрия с серной кислотой в соотношении количества вещества
Если гидроксид кальция взаимодействует с фосфорной (ортофосфорной) кислотой в
соотношении количества вещества
3. Кислые соли образуются при действии избытка кислотного оксида на основание.
Например, если гидроксид натрия реагирует с оксидом углерода(
Например, если смешать растворы хлорида кальция и гидроксида кальция, из полученного раствора можно выкристаллизовать гидроксохлорид кальция:
Например, при взаимодействии раствора сульфата меди(
Получение основного карбоната меди |
Например, при действии раствора гидроксида калия на гидроксид цинка образуется тетрагидроксоцинкат калия:
2. Ещё один способ получения комплексных солей — действие растворов щелочей на амфотерные оксиды.
Например, при действии раствора гидроксида натрия на оксид цинка образуется тетрагидроксоцинкат натрия:
Комплексные соли образуются также при растворении в щёлочи цинка или алюминия.
ГРУППА 108
ТЕМА: РЕШЕНИЕ ЗАДАЧ.
Задача 1. Определите, какое количество вещества оксида углерода (IV) образуется при сжигании природного газа массой 8,2 г, содержащего 5% этана.
Дано: Решение: m(природ. газа) = 8,2 г w(С2Н6) = 5% Найти: ν(СО2) = ? | Решение: 1. Определим массу этана, содержащегося в природном газе. m(С2Н6) = 8,2 × 0,05 = 0,41 г. 2. Вычислим количество вещества оксида углерода (IV), образовавшегося при горении 0,41 г С2Н6. Для этого запишем уравнение реакции: 2С2Н6 + 7О2 = 4СО2 + 6Н2О; М(С2Н6) = 30 г/моль; m(С2Н6) = Составляем пропорцию: при сгорании при сгорании 0,41 г С2Н6------х моль СО2; 0,41 × 4 х = ---------------- = 0,027 моль СО2. 60 Ответ: Образовалось 0,027 моль СО2. |
Задача 2. Рассчитайте, какой объём воздуха потребуется, чтобы сжечь
Дано: Решение: V(природ. газа) = w(СН4) = 90% w(С2Н6) = 5% w( СО2) = 3% w( N2) = 2% Найти: V(воздуха) = ? | Решение: 1. Определим объёмный состав природного газа. V(СН4) = 50 × 0,9 = V(С2Н6) = 50 × 0,05 = 2,5 м3 V(СО2) = 50 × 0,03 = 1,5 м3 V(N2) = 50 × 0,02 = 2. Вычислим, какой объём кислорода потребуется для сжигания СН4 + 2О2 = 4СО2 + 6Н2О; x = 3. Вычислим, какой объём кислорода потребуется для сжигания 2,5 м3 С2Н6. Для этого составим уравнение реакции: 2С2Н6 + 7О2 = 4СО2 + 6Н2О. Составляем пропорцию: при сгорании при сгорании 2,5 м3 С2Н6------х м3 О2; 2,5 × 7 х = ---------------- = 2 4. Вычислим объём кислорода, который потребуется для сжигания V(O2) = 90 + 8,75 = 98,75 м3 5. Вычислим объём воздуха, необходимый для сжигания V(воздуха) = 493,75 м3 Ответ: На сжигание |
Задача 3. При сжигании углеводорода массой 2,1 г получили 6,6 г оксида углерода(IV) и 2,7 г воды. Относительная плотность органического соединения по водороду 42. Выведите молекулярную формулу углеводорода.
Дано: Решение: m(СхНу) = 2,1 г m(СО2) = 6,6 г m(H2О) = 2,7 г D(Н2) = 42 Найти молекулярную формулу углеводорода. | Решение: 1. По относительной плотности найдём молярную массу углеводорода: D(Н2) = М(СхНу); М(Н2) М(СхНу) = 2 г/моль · 42 = 84 г/моль. 2. Рассчитаем массу и количество вещества оксида углерода(IV), выделившегося при сгорании 1 моль (или 2,1г 6,6г СхНу + О2 ® СО2 + Н2О; х = m(СО2) = Найдем количество вещества СО2, Найдём количество вещества СО2, выделившееся при сгорании 1 моль углеводорода: Мr(СО2) = 12 +16 · 2 = 44; М(СО2) = 44 г/моль; ν(СО2) = 3. Рассчитаем массу и количество вещества воды, выделившейся при сгорании 1 моль углеводорода. Для этого составим схему уравнения реакции горения углеводорода: 2,1г 2,7г СхНу + О2 ® СО2 + Н2О. Составим и решим пропорцию: у = m(H2О) = Найдём количество вещества воды, которое содержится в 108 г: Мr(H2О) = 1 · 2 + 16 = 18; М(H2О) = 18 г/моль; ν(H2О) = 4. Определим молекулярную формулу органического соединения: СхНу + 9О2 ® 6СО2 + 6Н2О. В 6 моль оксида углерода(IV), образовавшихся при сгорании 1 моль углеводорода, содержится 6 моль атомов углерода; в 6 моль воды, образовавшейся при сгорании 1 моль углеводорода, содержится 12 атомов водорода. Следовательно: в 1 моль углеводорода содержалось 6 моль атомов углерода и 12 моль атомов водорода. Молекулярная формула углеводорода С6Н12. атомов водорода Ответ: С6Н12. |
Задача 4. При сжигании 4,4 г алкана выделилось 13,4 г углекислого газа — оксида углерода(IV). Относительная плотность вещества по воздуху равна 1,52. Определите молекулярную формулу органического соединения.
Дано: m(CnH2n+2) = 4,4 г m(CO2) = 13,4 г D(в) = 1,52
Найти: CnH2n+2 = ?
| Решение: 1. По относительной плотности найдём молярную массу алкана: D(в) = М(CnH2n+2) : М(в); М(CnH2n+2)= 29 г/моль × 1,52 = 44 г/моль.
2. Рассчитаем массу и количество вещества оксида углерода(IV), выделившегося при сгорании 1 моль или Составим и решим пропорцию: 4,4 г алкана ________ 13,4 г СО2
х =
Найдём количество вещества СО2, которое выделяется при сгорании 1 моль углеводорода: Mr(СО2)=12+16·2= 44; М(СО2) = 44 г/моль; ν(СО2) = m(СО2) : M (СО2); ν (СО2) =
3. Определим молекулярную формулу алкана. В 3-х моль оксида углерода(IV), выделившихся при сгорании 1 моль алкана, содержится 3 моль атомов углерода. Следовательно, количество атомов углерода в алкане равно 3. По общей формуле алканов CnH2n+2, количество атомов водорода равно 8. Молекулярная формула углеводорода — С3Н8 — пропан.
Ответ: С3Н8. |
ГРУППА 308
ТЕМА1 : Решение задач по химическим уравнениям при условии, что одно из реагирующих веществ дано в избытке.
Повторение основных понятий.
Что такое уравнение химической реакции? (Химическим уравнением называют условную запись химической реакции посредством химических формул и математических знаков)
Что показывает уравнение химической реакции? (оно показывает, какие вещества и в каких количествах вступили и получились в результате химической реакции)
Предположим, что нам надо получить в лаборатории определенное количество какого-либо вещества. Что для этого необходимо? (1. написать уравнение реакции. 2. провести расчет. 3. взвесить и отмерить определенное количество веществ на основании данных расчета по уравнениям реакций. 4. осуществить расчет)
Чтобы провести расчет, какие понятия и физические величины нам можно и нужно использовать при решении задач ( Ar, Mr, ν, M, m)
Где мы возьмем значения относительных атомных масс? (в ПСХЭ Д.И. Менделеева)
Как мы найдем значения относительных молекулярных масс? (для нахождения относительных молекулярных масс надо суммировать значения относительных атомных масс элементов, входящих в состав молекулы вещества, с учетом числа атомов каждого элемента).
При неполном сгорании топлива и других веществ, в частности табака, образуется угарный газ СО, вызывающий кислородное голодание, блокируя гемоглобин крови. Вычислите относительную молекулярную массу этого вещества. (28)
Как рассчитаем молярную массу вещества? (M=Mr)
Как определить по уравнению реакции, в каких мольных отношениях находятся необходимые для расчета вещества? ( по коэффициентам)
Как связаны между собой понятия «количество вещества», «молярная масса» и «масса» (m=νM; ν= m/M)
Суточная потребность организма в кальции в виде СаСО3 составляет 1,2г. Вычислите количество карбоната кальция. (0,012моль)(см. приложение 1)
Какую массу воды получит ваш организм, если вы выпили ее суточную норму – 138,9 моль? (2500,2г)
Железо – важнейшая составная часть организма человека и животных. Для лечения анемии, вызванной дефицитом железа в организме, и для стимуляции работы кроветворных органов используют восстановленное железо. Вычислите массу железа, которая может быть восстановлена алюминием из 1,5 моль оксида железа (III). 2Al + Fe2О3 = Al2О3 + 2Fe (168г)
Интеллектуальная разминка
Вещество, 5%-ная спиртовая настойка которого используется в качестве дезинфицирующего и кровоостанавливающего средства. (иод)
Вещество, которое применяется внутрь при повышении кислотности желудочного сока. Наружно оно употребляется как слабая щелочь для полоскания, промывания и ингаляций при насморке. (питьевая сода)
Вещество, 0,9%-ный водный раствор которого называется изотоническим (физиологическим) и применяют для внутривенных вливаний при большой потере крови. В быту оно находит применение как пищевая добавка при приготовлении пищи. (Поваренная соль)
Меня в составе мрамора найди,
Я твердость придаю кости,
В составе извести меня найдешь,
Теперь меня ты твердо назовешь.
(кальций)
В виде таблеток это вещество применяют внутрь при пищевых отравлениях. Получают его при прокаливании древесины (березы) без доступа воздуха с последующей обработкой. (Активированный уголь, углерод)
Она образует два аллотропных видоизменения: бывает кристаллическая и пластическая, входит в состав мазей и присыпок, способствует заживлению ран. (сера)
Изучение нового материала
Задача. Рассчитайте массу питьевой соды (гидрокарбоната натрия), используемой в народной и традиционной медицине для полоскания и ингаляций, которая образуется при пропускании 2,64г углекислого газа через раствор, содержащий 2г гидроксида натрия. (см. приложение 2)
(Записываем, дано, что надо найти, составляем уравнение реакции. Пишем над формулами веществ их массы. Под формулами веществ записываем количество вещества, молярную массу и массу. По ходу решения вывешивается алгоритм решения задачи.)
? Что необычного вы встретили в условии данной задачи? (в условии задачи указаны массы всех исходных веществ)
? Проблема: по массе какого вещества следует вычислять массу соды?
Тема урока: Расчеты по химическим уравнениям: одно из реагирующих веществ дано в избытке.
Иногда встречаются задачи, в которых даются массы или объемы двух реагирующих веществ (как в данном случае).
Для расчета по уравнению реакции было бы вполне достаточно знать или массу углекислого газа или массу гидроксида натрия. Зачем в условии задачи лишние данные? Дело в том, что мольные соотношения реагирующих веществ в данном случае могут быть не эквивалентны, поэтому одно из них в процессе израсходуется полностью, а часть другого останется не прореагировавшей. Очевидно, если находить массу конечного продукта, используя данные о веществе, оказавшемся в избытке, мы получим неправильный ответ. Как определить это вещество? Для этого найдем количества веществ реагентов.
(Учащиеся записывают алгоритм решения задачи в тетрадях, который отдельными блоками вывешивается на доске в виде таблицы «Алгоритм решения». Учитель записывает решение задачи на доске)
2,64г 2г x
СО2 + NaOH = NaHCO3
1 моль 1 моль 1 моль
44г/моль 40г/моль 84г/моль
44г 40г 84г
Находим ν (СО2)
ν= m/ M ν (СО2) = 2,64г/44г/моль = 0,06 моль
Находим ν (NaOH)
ν(NaOH) = 2г/40г/моль = 0,05моль
Находим избыток
По ур. р. ν(СО2) : ν (NaOH) = 1:1 => чтобы прореагировало 0,05 моль NaOH требуется 0,05 моль СО2, а дано 0,06 моль => СО2 в избытке.
Находим массу NaHCO3
Массу гидрокарбоната натрия следует находить, используя для расчета гидроксид натрия.
Из 40г NaOH – 84г NaHCO3
Из 2г NaOH – x
2г ∙ 84г
X = = 4,2г
= = 4,2г
40г
Ответ: 4,2г
(Затем учитель предлагает еще раз внимательно посмотреть на записи решения на доске, после чего закрывает их, а учащиеся самостоятельно воспроизводят их в тетрадях, используя имеющийся алгоритм. Затем они сверяют их с записями на доске.)
ТЕМА2: Генетическая связь предельных одноатомных спиртов с углеводородами.
Свойства углеводородов зависят от химического, пространственного, электронного строения молекул и характера химических связей.
Изучение строения, химических свойств и способов получения углеводородов различных групп показывает, что все они генетически связаны между собой, т.е. возможны превращения одних углеводородов в другие:

Это позволяет осуществлять целенаправленный синтез заданных соединений, используя ряд необходимых химических реакций (цепь превращений).
Задача 1. Назвать промежуточные продукты в схеме превращений:



 Этиловый спирт H2SO4 (k), t X HBr Y Na Z Cr2O3 Al2O3 бутадиен-1,3
Этиловый спирт H2SO4 (k), t X HBr Y Na Z Cr2O3 Al2O3 бутадиен-1,3
-H2
Решение. В данной цепи превращений, включающей 4 реакции, из этилового спирта С2Н5ОН должен быть получен бутадиен-1,3 СН2=СН–СН=СН2.
1. При нагревании спиртов с концентрированной серной кислотой
H2SO4 (водоотнимающее средство) происходит их дегидратация с образованием алкена Отщепление воды от этилового спирта приводит к образованию этилена:
![]()
2. Этилен – представитель алкенов. Являясь ненасыщенным соединением, он способен вступать в реакции присоединения . В результате гидробромирования этилена:
![]()
3.При нагревании бромэтана в присутствии металлического натрия (реакция Вюрца, образуется н-бутан (вещество Z):
![]()
4.Дегидрирование н-бутана в присутствии катализатора – один из способов получения бутадиена-1,3 СН2=СН–СН=СН2
(раздел 5.4. Получение алкадиенов).
Ответ: 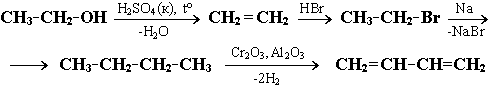
Осуществить превращения:
1 2 3 4 5
СаC2 → A → Б → H3C-CH2-Cl → В → Н3С-СН2-О-С3Н7
+2Н2 +КОН
СаС2 + 2Н2О → НС≡СН + Са(ОН)2 А
2) НС≡СН + 2Н2 → Н3С-СН3 Б
3) Н3С-СН3 + С12 → Н3С-СН2-С1 + НС1
4) Н3С-СН2-С1 + КОН (водн.) → Н3С-СН2-ОН + КС1 В
5) Н3С-СН2-ОН +НО-С3Н7 → Н3С-СН2-О-С3Н7 + Н2О