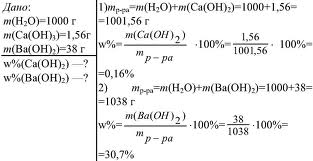РАСПИСАНИЕ ЗАНЯТИЙ НА НЕДЕЛЮ: 16.01.23Г.-20.01.23
| Пт.20.01 | ||||
1,2 | 306 | 508 | 406 | 505 | 401 |
3,4 | 401 | 505 | 505 | 501 | 505 |
5 | 401 | 505 | 401 | 306 | - |
6,7 | 408 | 501 | - | 508 | 501 |
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 505 БИОЛОГИЯ 6,7
ТЕМА 6,7:Нуклеиновые кислоты. АТФ и другие органические соединения клетки.
Нуклеиновые кислоты.
СНАЧАЛА ВНИМАТЕЛЬНО ПОСМОТРИТЕ ВИДЕО. ЗАТЕМ ПРОЧИТАЙТЕ НИЖЕ ТЕКСТ, ЗАПИШИТЕ ГЛАВНОЕ.
Строение нуклеиновых кислот
В отличие от белков, углеводов и липидов, нуклеиновые кислоты никогда не накапливаются в клетке в больших количествах, и обнаружить их можно только с помощью специальных химических методов. Поэтому они были открыты только во второй половине XIX в., а по-настоящему изучить их роль в процессах жизнедеятельности удалось лишь во второй половине XX в. Так как первоначально они были обнаружены только в ядрах, им дали название нуклеиновые (от лат. nucleus — ядро).
Нуклеиновые кислоты — биологические полимеры, мономерами которым служат нуклеотиды. Связи между нуклеотидами легко подвергаются гидролизу (распаду при реакции с водой). Каждый нуклеотид состоит из остатков углевода, фосфорной кислоты и азотистого основания (рис. 1).

Рис. 1. Строение нуклеотида
Углеводный компонент представлен пентозами — рибозой (в РНК) или дезоксирибозой (в ДНК), у которой отсутствует кислород при втором атоме углерода (рис. 2).

Рис. 2. Пентозы
Остаток фосфорной кислоты образует сложноэфирную связь с гидроксилом при 5-м атоме углерода в сахаре. Соединение нуклеотидов в полимер происходит путем образования фосфатом одного нуклеотида второй эфирной связи с гидроксилом при 3-м углероде соседнего нуклеотида. Такая связь получила название фосфодиэфирной.
Таким образом, нуклеиновые кислоты представляют собой цепь из чередующихся остатков пентозы и фосфорной кислоты (рис. 3).
Кроме того, от первого атома углерода каждой пентозы отходит в бок азотистое основание. В этом нуклеиновые кислоты сходны с белками, в которых полимерная цепь образована пептидными группировками с отходящими от них боковыми радикалами аминокислот. Так же, как и у белков, в нуклеиновых кислотах два конца цепи неодинаковы. С одной стороны имеется не занятое связью пятое положение рибозы, этот конец называют 5’-концом. С противоположной стороны не занят связью третий гидроксил сахара, этот конец обозначают как 3’-конец. 5’-конец считается началом цепи, а 3’-конец — ее окончанием.

Рис. 3. Нуклеиновые кислоты
В одной молекуле нуклеиновой кислоты присутствует только один вид пентозы. Те молекулы, которые содержат рибозу, называют рибонуклеиновой кислотой, или сокращенно РНК. Нуклеиновую кислоту, содержащие дезоксирибозу, называют дезоксирибонуклеиновой кислотой, или ДНК.
Помимо пентозы, нуклеиновые кислоты отличаются азотистыми основаниями. Они представляют собой ароматические циклы, содержащие несколько атомов азота и заместители при определенных атомах углерода.
По структуре гетероциклов азотистые основания делятся на две группы.
Пиримидиновые азотистые основания: урацил, тимин и цитозин. Тимин отличается от урацила только наличием метильной группы, что незначительно меняет его свойства. В РНК встречаются урацил и цитозин, а в ДНК — тимин и цитозин.
Пуриновые основания: аденин и гуанин. Во всех нуклеиновых кислотах присутствуют оба пурина.

Рис. 4. Азотистые основания
За счет чередования различных нуклеотидов в цепи нуклеиновые кислоты могут достигать огромного многообразия (количество видов полимеров равно числу видов мономеров в степени, равной числу мономеров в цепи). И хотя число мономеров в нуклеиновых кислотах меньше, чем в белках, степень полимерности, особенно у ДНК, намного выше. Длина цепей ДНК, входящих в хромосомы разных организмов, составляет от миллионов до сотен миллионов нуклеотидов.
Молекулы РНК обычно короче, их длина — от нескольких десятков до нескольких десятков тысяч нуклеотидов. А при длине цепи 500 нуклеотидов количество возможных комбинаций составляет более 10 300.
принцип комплЕментарности
При анализе содержания азотистых оснований в ДНК из различных организмов Эрвин Чаргафф обнаружил определенные закономерности, позднее названные правилами Чаргаффа.
Молярное содержание аденина всегда равно молярному содержанию тимина, а молярное содержание гуанина — молярному содержанию цитозина.
Количество пуринов равнялось количеству пиримидинов, а отношение А+Т/Г+Ц было различным у разных видов живых организмов.
Это указывало на возможные взаимодействия оснований в ДНК между собой.
На основании правил Чаргаффа и предварительных результатов рентгеноструктурного анализа Джеймс Уотсон и Френсис Крик в 1953 г. предложили двуспиральную модель структуры ДНК.
Согласно этой модели молекула ДНК состоит из двух полинуклеотидных цепей, соединенных между собой азотистыми основаниями. При этом аденин одной цепи всегда взаимодействует с тимином в другой, и наоборот. Точно так же гуанин одной цепи всегда связан с цитозином в другой (рис. 6).

Рис. 5. Образование водородных связей между азотистыми основаниями
Такие пары оснований удерживаются за счет образования между основаниями водородных связей:
- пара А–Т образует 2 водородные связи;
- пара Г–Ц образует 3 водородные связи.
Главной особенностью пар А–Т и Г–Ц является их одинаковая геометрия. Это позволяет построить двуспиральную молекулу с постоянным расстоянием между цепями, построенными остатками сахара и фосфорной кислоты. Образование любых других пар приводит к нарушению правильной структуры.
Такое взаимодействие оснований, при котором они дополняют друг друга до определенной структуры, одинаковой для всех пар, получило название принципа комплементарности.
Пары аденин и тимин, гуанин и цитозин называются комплементарными парами, а две цепочки нуклеиновых кислот, в которых все основания образуют комплементарные пары — комплементарными цепочками. Таким образом, каждая молекула ДНК состоит из двух комплементарных цепочек полинуклеотидов (рис. 6).

Рис. 6. Принцип комплиментарности
Важной особенностью структуры двойной спирали ДНК является то, что комплементарные цепи направлены в противоположные стороны, т. е. 5’-конец одной цепи связан комплементарными основаниями с 3’-концом другой цепи, и наоборот. Основания плотно слипаются своими плоскостями, что делает связь между цепочками еще более прочной. Такое слипание получило название стэкинг-взаимодействия. В результате в центре молекулы ДНК находится как бы стержень, построенный из азотистых оснований, а по краям он обвит двумя нитями, состоящими из чередующихся остатков дезоксирибозы и фосфорной кислоты.
сравнение ДНК и РНК
| Нуклеиновая кислота | Строение | Функции | Особенности |
| ДНК | азотистое основание: аденин (А) тимин (Т) гуанин (Г) цитозин (Ц) углевод: дезоксирибоза остаток фосфорной кислоты | хранение и передача наследственной информации | двойная спираль (по принципу комплементарности); способность к репликации (самоудвоению) |
| РНК | азотистое основание: аденин (А) урацил (У) гуанин (Г) цитозин (Ц) углевод: рибоза остаток фосфорной кислоты | биосинтез белка | одинарная цепочка нуклеотидов |
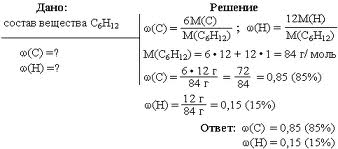
ТЕМА:АТФ и другие органические соединения.
Универсальным источником энергии во всех клетках служит


Нуклеотиды могут также принимать участие в регуляции окислительных процессов в клетке.
Витамины принимают участие в обмене веществ преимущественно как составная часть сложных ферментов. Их отсутствие или недостаток приводит к тяжёлым нарушениям жизнедеятельности организма.
ГРУППА 501 ХИМИЯ 27, 28
ТЕМА 27,28:Зависимость растворимости газов, жидкостей и твердых веществ от различных факторов.
Массовая доля растворенного вещества.
Растворимость зависит от природы растворяемого вещества и растворителя, температуры, давления и влияния посторонних веществ.
Природа веществ, образующих раствор. Этот фактор хорошо иллюстрирует старое правило: подобное растворяется в подобном. Под подобием подразумевают природу химической связи в веществах, образующих раствор. Действительно, две неполярные жидкости будут смешиваться друг с другом неограниченно, а неполярная и полярная жидкости будут практически нерастворимы друг в друге.
Вещества, состоящие из неполярных молекул, лучше растворяются в неполярных растворителях, например, сера хорошо растворяется в сероуглероде и практически не растворяется в воде. Кислород в воде растворяется в 10 раз хуже, чем в бензоле.
Вещества с ионным и ковалентным полярным характером связи, как правило, хорошо растворяются в сильно полярных растворителях. Однако ионные кристаллические структуры гораздо прочнее, чем молекулярные, поэтому, когда энергия кристаллической решетки велика, а энергия сольватации низка, растворимость таких соединений в воде мала (BaSO4, CuS, CaF2 и т.д.).
Максимальную энергию кристаллической решетки имеют полимерные соединений с ковалентной связью (алмаз, диоксид кремния и т.д.), поэтому растворимость таких веществ ничтожно мала в любых растворителях.
Температура.
Согласно принципу Ле Шателье, на зависимость растворимости от температуры влияет значение теплового эффект растворения данного вещества в данном растворителе.
Если растворение вещества является экзотермическим процессом, то с повышением температуры его растворимость будет уменьшаться (например, Ca(OH)2 в воде) и наоборот. Для большинства солей растворимость при нагревании увеличивается.
Практически все газы растворяются с выделением тепла, поэтому растворимость газов в жидкостях с повышением температуры уменьшается, а с понижением температуры - увеличивается.
Если измерять растворимость веществ при разных температурах, то обнаружится, что одни вещества сильно изменяют свою растворимость в зависимости от температуры, другие - не очень сильно (табл. 2).
Таблица 2.
Влияние температуры на растворимость некоторых твердых веществ.
В таблице приведена растворимость в г/100 г воды
Вещество | Температура, оC | ||||
0 | 20 | 50 | 80 | 100 | |
KBr | 53,5 | 65,2 | 80,8 | 94,6 | 103,3 |
NaCl | 35,7 | 35,9 | 36,8 | 38,1 | 39,4 |
CaSO4 | 0,176 | 0,206 | 0,180 | 0,102 | 0,066 |
Если полученные экспериментальным путем значения растворимости при различных температурах нанести на оси координат, то получаются так называемые кривые растворимости различных веществ (рис. 3).
Эти кривые имеют большое практическое значение. Используя эти кривые, можно рассчитать, сколько вещества, например KNO3, выпадет в осадок при охлаждении до 20оС насыщенного раствора, приготовленного при температуре 80оС. На этом основаны процессы, которые позволяют очищать некоторые вещества. Дело в том, что при охлаждении ненасыщенного раствора образуется насыщенный раствор, но насыщенный по основному веществу, которого больше всего, а не по примесям. Поэтому при охлаждении в осадок выпадает только чистое вещество, а примеси (вместе с частью вещества) остаются в растворе. Чистые кристаллы потом отфильтровывают от охлажденного, загрязненного примесями раствора. Этот способ очистки называется ПЕРЕКРИСТАЛЛИЗАЦИЕЙ. Так очищают, например, многие лекарственные препараты.
Давление. По принципу Ле Шателье увеличение давления смещает равновесие в сторону уменьшения объема системы. При растворении твердых веществ в жидкости объем изменяется мало, поэтому давление не будет существенным образом влиять на растворимость солей. Также влияние давления практически не будет проявляться и для смеси двух жидкостей.
Растворимость газов сильно зависит от давления, так как в этом случае происходит значительное изменение объема системы. С увеличением давления растворимость газов увеличивается.
Для смеси газов растворимость каждого из них определяется законом Генри:
Растворимость летучего вещества при постоянной температуре прямо пропорциональна его парциальному давлению над раствором.
Закон справедлив для разбавленных растворов, невысоких давлений и при отсутствии химического взаимодействия с растворителем.
ТЕМА: Массовая доля растворенного вещества.
Массовая доля.
Один из самых распространенных способов выражения концентрации раствора – через массовую долю растворенного вещества.
Отношение массы растворенного вещества к общей массе раствора называют массовой долей растворенного вещества.
Массовую долю обозначают греческой буквой «омега» и выражают в долях единицы или процентах (рисунок 2).
Рис.2. Массовая доля компонентов смеси.
Посмотрев видео
вы вникнете в понятие массовой доли и научитесь ее вычислять.
Если в 100 г раствора содержится 30 г хлорида натрия, это означает, что ω(NaCl) = 0,3 или ω(NaCl) = 30 %. Можно также сказать: «имеется тридцатипроцентный раствор хлорида натрия».
Массовая доля — самая распространенная в быту и большинстве отраслей промышленности концентрация. Именно массовая доля жира, например, указана на пакетах с молоком (посмотрите на рисунок 3).
Рис.3. Массовая доля жира в молоке.
Масса раствора складывается из массы растворителя и массы растворенного вещества, т. е.:
m(раствора) = m(растворителя) + m(растворенного вещества).
Предположим, массовая доля растворенного вещества равна 0,1, или 10%. Следовательно, оставшиеся 0,9, или 90%, – это массовая доля растворителя.
Массовая доля растворенного вещества широко используется не только в химии, но и в медицине, биологии, физике, да и в повседневной жизни. Рассмотрим решение некоторых задач
Рис.4. Задача на нахождение массовой доли.
ГРУППА 306 БИОЛОГИЯ 48
ТЕМА 48:Приспособленность организмов - результат действия факторов эволюции. Л.Р.№2«Приспособленность организмов».
Перейдите по ссылке, посмотрите видео , прочитайте текст, проработайте задания темы.(на этом сайте).Запишите очень краткий план, с какими понятиями вы познакомились.Выполните лабораторную работу.
ЛАБОРАТОРНАЯ РАБОТА №2
«ПРИСПОСОБЛЕННОСТЬ ОРГАНИЗМОВ К СРЕДЕ ОБИТАНИЯ».
Цель: сформировать понятие о приспособленности организмов к среде
обитания, закрепить умение выявлять черты приспособленности.
Задание:
1. Прочитайте статью о насекомом и заполните таблицу.
Название насекомогоМЕСТО ОБИТАНИЯ
ТИП ОКРАСКИ
БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
2.Сделайте вывод о значении приспособленности организмов к среде обитания.
Медведка обыкновенная.

Медведка - насекомое, относящееся к семейству сверчковых . Тело толстое, 5-6 см длиною, сверху серовато-бурое, снизу темно-желтое, густо покрыто очень короткими волосками, так, что кажется бархатистым. Передние ноги укороченные, толстые, предназначены для копания земли. Надкрылья укороченные, с помощью них самцы могут стрекотать (петь); крылья большие, очень тонкие, в покое веерообразно сложены. Медведка распространена по всей Европе за исключением крайнего Севера; В естественных условиях медведка селится на увлажненных, рыхлых, богатых органикой почвах. Особенно любит унавоженную землю. Часто встречается на огородах и в садах, где приносит большой вред, повреждая корневую систему многих культурных растений. Роют многочисленные, довольно поверхностные ходы. Днем медведки держатся под землей, а вечером с наступлением темноты выходят на поверхность земли, причем иногда летят на свет.Особенно нравится медведкам селиться на высоких и теплых компостных грядах, где они зимуют и где весной делают в земле свои гнезда и откладывает яйца. А чтобы обеспечить тепло для своего потомства, они уничтожают растения, затеняющие почву от солнечных лучей вблизи их гнезд. Они подгрызают корни и стебли растений, опустошают грядку так, что приходится дополнительно подсеивать семена или подсаживать рассаду.
ГРУППА 508 ХИМИЯ 22, 23
ТЕМА 22,23:Строение алкенов. Гомологи и изомеры алкенов. Изомерия: углеродной цепи, положения кратной связи, цис-, транс- изомерия.
Свойства, получение и применение алкенов. Правило Марковникова.
Гомологический ряд алкенов
Все алкены имеют некоторые общие или похожие физические и химические свойства. Схожие по строению алкены, которые отличаются на одну или несколько групп –СН2–, называют гомологами. Такие алкены образуют гомологический ряд.
Самый первый представитель гомологического ряда алкенов – этен (этилен) C2H4, или СH2=СH2.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь.
| Название алкена | Формула алкена |
| Этилен (этен) | C2H4 |
| Пропилен (пропен) | C3H6 |
| Бутилен (бутен) | C4H8 |
| Пентен | C5H10 |
| Гексен | C6H12 |
| Гептен | C7H14 |
| Октен | C8H16 |
| Нонен | C9H18 |
Общая формула гомологического ряда алкенов CnH2n.
Первые четыре члена гомологического ряда алкенов – газы, начиная с C5 – жидкости.
Алкены легче воды, не растворимы в воде и не смешиваются с ней.
Строение алкенов
Рассмотрим особенности строения алкенов на примере этилена.
В молекуле этилена присутствуют химические связи C–H и С=С.
Связь C–H ковалентная слабополярная одинарная σ-связь. Связь С=С – двойная, ковалентная неполярная, одна из связей σ, вторая π-связь. Атомы углерода при двойной связи образуют по три σ-связи и одну π-связь. Следовательно, гибридизация атомов углерода при двойной связи в молекулах алкенов – sp2:
При образовании связи σ-связи между атомами углерода происходит перекрывание sp2-гибридных орбиталей атомов углерода:
При образовании π-связи между атомами углерода происходит перекрывание негибридных орбиталей атомов углерода:
Три sp2-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому три гибридные орбитали атомов углерода при двойной связи в алкенах направлены в пространстве под углом 120о друг к другу:
Это соответствует плоско-треугольному строению молекулы.
| Например, молекуле этилена C2H4 соответствует плоское строение. |
Молекулам линейных алкенов с большим числом атомов углерода соответствует пространственное строение.
| Например, в молекуле пропилена присутствует атом углерода в sp3-гибридном состоянии, в составе метильного фрагмента СН3. Такой фрагмент имеет тетраэдрическое строение и располагается вне плоскости двойной связи. |
Изомерия алкенов
Для алкенов характерна структурная и пространственная изомерия.
СТРУКТУРНАЯ ИЗОМЕРИЯ
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратной связи и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
| Например. Изомеры с различным углеродным скелетом и с формулой С4Н8 — бутен-1 и метилпропен |
| Бутен-1 | Метилпропен |
 |  |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкены являются межклассовыми изомерами с циклоалканами. Общая формула и алкенов, и циклоалканов — CnH2n.
| Например. Межклассовые изомеры с общей формулой С3Н6 — пропилен и циклопропан |
| Пропилен | Циклопропан |
 |
Изомеры с различным положением двойной связи отличаются положением двойной связи в углеродном скелете.
| Например. Изомеры положения двойной связи, которые соответствуют формуле С4Н8 — бутен-1 и бутен-2 |
| Бутен-1 | Бутен-2 |
 |
ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ
Для алкенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у алкенов.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
| Например. Для бутена-2 характерна цис- и транс-изомерия. В цис-изомере метильные радикалы CH3 располагаются по одну сторону от плоскости двойной связи, в транс-изомере — по разные стороны. |
| цис-Бутен-2 | транс-Бутен-2 |

| |
Цис-транс-изомерия не характерна для тех алкенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
| Например. Для пентена-1 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода) |
Номенклатура алкенов
В названиях алкенов для обозначения двойной связи используется суффикс -ЕН.
| Например, алкен имеет название 2-метилпропен. |
При этом правила составления названий (номенклатура) для алкенов в целом такие же, как и для алканов, но дополняются некоторыми пунктами:
1. Углеродная цепь, в составе которой есть двойная связь, считается главной.
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода при двойной связи получили наименьший номер. Нумерацию следует начинать с более близкого к двойной связи конца цепи.
3. В конце молекулы вместо суффикса АН добавляют суффикс ЕН и указывают наименьший номер атома углерода при двойной связи в углеродной цепи.
4. Для простейших алкенов применяются также исторически сложившиеся (тривиальные) названия:
| Тривиальное название | Формула алкена |
| Этилен |  |
| Пропилен | |
| Бутилен-1 |
Радикалы, содержащие двойную связь, также носят тривиальные названия:
| Формула радикала | Тривиальное название |
| CH2=CH- | винил |
| CH2=CH-CH2— | аллил |
Получение алкенов
Рассмотрим промышленные и лабораторные способы получения алкенов.
1. Дегидрирование алканов
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, образуются двойные и тройные связи.
| Например, при дегидрировании этана может образоваться этилен или ацетилен: |
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
2. Крекинг алканов
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Реакции присоединения к алкенам протекают по ионному механизму. В результате реакции происходит разрыв
Молекулы образующихся продуктов присоединения не содержат двойных связей.
1. Присоединение водорода (гидрирование)
Реакция протекает в присутствии катализатора (никель, платина, палладий) и приводит к образованию алканов:
Этен Этан
2. Присоединение воды (гидратация)
Реакция происходит в присутствии минеральных кислот (серной, фосфорной) и приводит к образованию спиртов:
Этен Этанол
Реакцию гидратации этилена используют в промышленности для получения этанола.
В случае несимметричных алкенов реакция гидратации протекает по правилу Марковникова:
 Правило Марковникова
Правило Марковникова
атом водорода преимущественно присоединяется к наиболее гидрированному атому углерода по месту разрыва двойной связи.