ПОНЕДЕЛЬНИК, 11.10.21 г. 306, 308, 408, 301
моя почта : rimma.lu@gmail.com
ГРУППА 306 ХИМИЯ 11,12
ТЕМА: Валентность.
Валентность -это свойство атома химического элемента присоединять или замещать определенное число атомов другого элемента, т.е., иными словами, это количество химических связей, которые атом данного химического элемента может образовывать с другими атомами.
Валентность углерода в органических соединениях равна IV. Этот тезис представляет собой одно из основных положений теории строения органических соединений А.М. Бутлерова.
Для углерода характерно наличие двух валентностей- высшей IV и низшей II. Однако, если изобразить структурные формулы органических веществ, не учитывая положения теории, валентность углерода будет представляться дробным числом, чего не может быть, поскольку величина валентности всегда является целым числом.
Согласно, теории строения органических соединений А.М. Бутлерова атомы в молекулах органических соединений связаны между собой в определенной последовательности, это означает, что атомы углерода могут быть связаны между собой, причем не всегда обязательно одинарными связями. Например: — этан;
— пропен.
ТЕМА: Химическое строение как порядок соединения атомов в молекулы по валентности. Изготовление моделей молекул органических веществ.
Во времена А. М. Бутлерова в органической химии широко использовали эмпирические (молекулярные) и структурные формулы. Последние отражают порядок соединения атомов в молекуле согласно их валентности, которая обозначается черточками.
Н
1
Н-С-Н
l
Н
Для простоты записи часто используют сокращенные структурные формулы, в которых черточками обозначают только связи между атомами углерода, а также связи в функциональных группах.
Сокращенные МОЛЕКУЛЯРНЫЕ формулы
С2Н6
Затем, по мере развития знаний о природе химической связи и о влиянии электронного строения молекул органических веществ на их свойства, стали пользоваться электронными формулами, в которых ковалентную связь условно обозначают двумя точками. В таких формулах часто показывают направление смещения электронных пар в молекуле. Например, для уксусного альдегида
Современная органическая химия различает два основных типа изомерии: структурную (изомерию цепи, изомерию положения кратных связей, изомерию гомологических рядов, изомерию положения функциональных групп) и стереоизомерию (геометрическую, или цис-, трсшсизомерию, оптическую, или зеркальную, изомерию).
вещества, имеющие одинаковую молекулярную формулу, но разное строение и разные физические и химические свойства.
Например, формуле
Этанол Диметиловый эфир
Итак, вы смогли убедиться в том, что второе положение теории химического строения, четко сформулированное А. М. Бутлеровым, было неполным. С современных позиций это положение требует дополнения:
- свойства веществ зависят не только от их качественного и количественного состава, но и от их
- химического,
- электронного,
- пространственного строения.
Создание теории строения веществ сыграло важнейшую роль в развитии органической химии. Теория строения создала предпосылки для объяснения и прогнозирования различных видов изомерии молекул органических соединений, а также направлений и механизмов протекания химических реакций.
На основе этой теории химики-органики создают вещества, которые не только заменяют природные, но по свойствам значительно их превосходят. Так, синтетические красители гораздо лучше и дешевле многих природных, например ализарина и индиго. В больших количествах производят синтетические каучуки с самыми разнообразными свойствами. Широкое применение находят пластмассы и волокна, изделия из которых используют в технике, быту, медицине, сельском хозяйстве.
Сравнивая две величайшие теории химии — теорию строения А. М. Бутлерова и теорию периодичности Д. И. Менделеева, — нетрудно заметить, что в обеих теориях так много общего в путях их становления, направлениях развития и общенаучном значении. Впрочем, в истории любой другой ведущей научной теории (теории Ч. Дарвина, генетике, квантовой теории и т. д.) можно найти такие общие этапы.
ГРУППА 308 ХИМИЯ 11,12
ТЕМА: Одноосновные предельные карбоновые кислоты. Строение молекул. Изомерия и номенклатура.
ТЕМА:Свойства карбоновых кислот
Строение и классификация карбоновых кислот
Карбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH.
Общая формула предельных монокарбоновых кислот
В соответствии с кислотно-основной теорией. кислые свойства объясняются тем, что карбоксильная группа может сравнительно легко отщеплять протон. Однако все органические кислоты являются слабыми (степень диссоциации <30%). При этом ди- и трикарбоновые кислоты более сильные, чем монокарбоновые.
Классификация карбоновых кислот, помимо общих классификационных признаков неорганических кислот (основность, содержание кислорода, степень диссоциации) проводится по следующим признакам:
1. По типу углеводородного радикала, связанного с карбоксильной группой:
- ароматические (бензойная кислота);
- алифатические - предельные (капроновая кислота) и непредельные (акриловая кислота);
- алициклические (хинная кислота);
- гетероциклические (никотиновая кислота).
2. По числу карбоксильных групп:
- одноосновные (муравьиная
, уксусная кислота ) - двухосновные (щавелевая
, янтарная (бутандиовая) кислота ) - многоосновные (лимонная кислота
).
При введении в молекулы кислоты других функциональных групп (например, -ОН, -C(O)-, -
Молекулы предельных карбоновых кислот не содержат
Особенности строения
Рассмотрим особенности строения карбоксильной группы. Карбоксильная группа сочетает в себе две функциональные группы - карбонил и гидроксил, оказывающие взаимное влияние друг на друга. Атомы кислорода и углерод карбоксильной группы образуют
В группе С=О атом углерода несет частичный положительный заряд и поэтому стягивает на себя неподеленную электронную пару между атомом кислорода и водорода в группе ОН (индуктивный эффект). При этом электронная плотность на атоме кислорода уменьшается, и связь О-Н ослабляется. Это приводит к способности кислот отщеплять протон водорода. Поэтому карбоновые кислоты являются слабыми электролитами.
В свою очередь, группа ОН "гасит" положительный заряд на группе С=О, которая из-за этого теряет способность к реакциям нуклеофильного присоединения, характерным для карбонильных соединений.
На степень диссоциации оказывает влияние углеводородный радикал.
Влияние заместителя ослабевает с удалением от карбоксильной группы (индукционный эффект затухает с расстоянием). В целом, ароматические кислоты более сильные, чем алифатические. При этом наличие сильных акцепторов (например,
Карбонильная группа по отношению к группе ОН выступает в роли электроноакцептора, а гидроксильная группа за счет +М-эффекта - в роли электронодонора, подающего электронную плотность на карбонильную группу. Особенности электронного строения карбоновых кислот обусловливают существование нескольких реакционных центров:
- ОН-кислотный центр, обусловленный сильной поляризацией связи О-Н;
- электрофильный центр - атом углерода карбоксильной группы;
- n- основный центр - атом кислорода карбонильной группы с неподеленной парой электронов;
- слабый СН-кислотный центр, проявляющийся только в производных кислот, так как в самих кислотах имеется несравненно более сильный ОН-кислотный центр.
НОМЕНКЛАТУРА И ИЗОМЕРИЯ ОДНООСНОВНЫХ КАРБОНОВЫХ КИСЛОТ
В соответствии с международной номенклатурой ИЮПАК, карбоновые кислоты называют, выбирая за основу наиболее длинную углеродную цепочку, содержащую группу -СООН, и добавляя к названию углеводородного радикала окончание "-овая" и слово "кислота". При этом отсчет производится от первого атома углерода, входящего в состав карбоксильной группы. Это правило не распространяется на аминокислоты, для которых нумерация начинается со второго атома углерода, если считать атом карбоксильной группы.
Многие из карбоновых кислот имеют тривиальные названия:
| Название по ИЮПАК | Тривиальное название | Формула | Название соли |
|---|---|---|---|
| Метановая кислота | Муравьиная кислота | формиаты | |
| Этановая кислота | Уксусная кислота | ацетаты | |
| Пропановая кислота | Пропионовая кислота | пропионаты | |
| Бутановая кислота | Масляная кислота | бутираты | |
| Пентановая кислота | Валериановая кислота | валераты | |
| Гексановая кислота | Капроновая кислота | капронаты |
Для одноосновных карбоновых кислот характерны следующие виды изомерии:
1. Изомерия углеродного скелета
2. Межклассовая изомерия со сложными эфирами
Химические свойства органических кислот
4. Химические свойства непредельных карбоновых кислот, обусловленные наличием пи-связей в молекуле.
5. Реакция этерификации, условия ее осуществления6. Прочие реакции
Видео по теме:
- Свойства карбоновых кислот
- 10 класс. Химические свойства предельных одноосновных карбоновых кислот
- Карбоновые кислоты
- Карбоновые кислоты. Видео лекция по химии
ГРУППА 408 ХИМИЯ 12
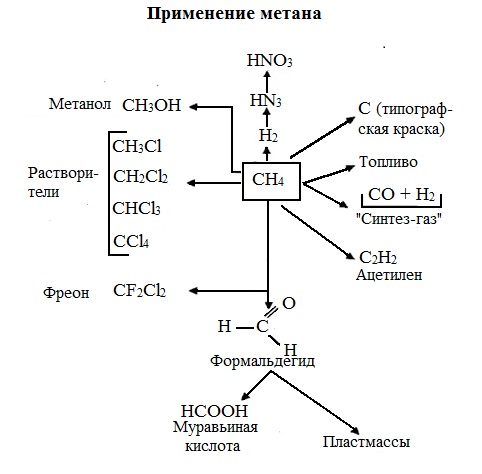
ТЕМА: Применение алканов.
Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека.
Газообразные алканы используются в качестве ценного топлива.Жидкие алканы – это бензин, керосин, жидкость для разжига костров. Из твердых алканов делают свечи.
Метан – является основным компонентом природных и попутных газов (60-99%). В состав природных газов входят пропан и бутан.
Благодаря большой теплотворной способности метан в больших количествах расходуется в быту и в промышленности. Именно он горит в кухонных плитах и сжигается на теплоэлектростанциях для производства электроэнергии. В смеси с воздухом метан взровоопасен.
Смесь пропана и бутана используется в качестве бытового топлива.
Пропан и бутан при повышении давления сжижаются, поэтому пропаном заправляют балоны для тушения пожаров. Пропан-бутановой смесью заправляют зажигалки.
Жидкие углеводоpоды составляют значительную долю в моторных и ракетных топливах и используются в качестве растворителей.
Большое промышленное значение имеет окисление высших предельных углеводородов – парафинов с числом углеродных атомов 20-25. Этим путем получают синтетические жирные кислоты с различной длиной цепи, которые используются для производства мыл, различных моющих средств, смазочных материалов, лаков и эмалей.
Вазелиновое масло (смесь жидких углеводоpодов с числом атомов углерода до 15) — пpозpачная жидкость без запаха и вкуса, используется в медицине, паpфюмеpии и косметике.
Вазелин (смесь жидких и твеpдых пpедельных углеводоpодов с числом углеpодных атомов до 25) пpименяется для пpиготовления мазей, используемых в медицине.
Паpафин (смесь твеpдых углеводоpодов С19-С35) — белая твеpдая масса без запаха и вкуса (tпл= 50-70°C) — пpименяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых пpоцедуp в медицине и т.д.
Использование алканов в качестве смазочных материалов
Использование алканов в качестве топлива
Использование парафина для получения водостойкой бумаги
Применение алканов в медицине (вазелин, парафин и др.)
Применение галогенопроизводных алканов
В современной нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ.
Нормальные предельные углеводороды средней молекулярной массы используются как питательный субстрат в микробиологическом синтезе белка из нефти.
Большое значение имеют галогенопроизводные алканов, которые используются как растворители, хладоагенты и сырье для дальнейших синтезов.
Алканы (предельные углеводороды)
ГРУППА 301 ХИМИЯ 11,12
ТЕМА: КОНТРОЛЬНАЯ РАБОТА
(РЕШИТЕ ЗАДАЧИ, АНАЛОГИЧНЫЕ С РЕШЕНИЕМ СМОТРИТЕ ВО ВКЛАДКЕ "РЕШАЕМ ЗАДАЧИ")
1. Какая масса хлорида аммония образуется при взаимодействии хлороводорода массой 7,3 г с аммиаком массой 5,1 г? Какой газ останется в избытке? Определите массу избытка.
Дано: m(HCl)=7,3 г; m(NH3)=5,1 г.
Найти: m(NH4Cl) =? m(избытка) =?
2. В избытке соляной кислоты растворили магний массой 6 г и цинк массой 6,5 г. Какой объем водорода, измеренный при нормальных условиях, выделится при этом?
Дано: m(Mg)=6 г; m(Zn)=6,5 г; н.у.
Найти: V(H2) =?
3. Из образца горной породы массой 25 г, содержащей минерал аргентит
Ag2S, выделено серебро массой 5,4 г. Определите массовую долю аргентита в образце.
Дано: m(Ag )=5,4 г; m = 25 г.
Найти: ω(Ag2S) =?
ТЕМА: Предмет органической химии. Природные, искусственные и синтетические органические вещества. Сравнение органических веществ с неорганическими.
Химики разделяли все вещества в зависимости от источника их получения на минеральные (неорганические), животные и растительные (органические).
Долгое время считалось, что для получения органических веществ нужна особенная «жизненная сила» - vis vitalis, которая действует только в живых организмах, а химики способны лишь выделять органические вещества из продуктов жизнедеятельности , но не могут синтезировать их. Поэтому шведский химик Й.Я. Берцелиус определил органическую химию как химию растительных или животных веществ, образующихся под влиянием «жизненной силы».Именно Берцелиус ввел понятие органические вещества и органическая химия.
Развитие химии привело к накоплению большого количества фактов и к краху учения о «жизненной силе» -витализма. Немецкий ученый Ф. Вёлер в 1824 г. осуществил первый синтез органических веществ - получил щавелевую кислоту путем взаимодействия двух неорганических веществ – дициана и воды:
А в 1828 г. Вёлер, нагревая водный раствор неорганического вещества цианата аммония, получил мочевину – продут жизнедеятельности живых организмов
Изумлённый таким результатом, Вёлер написал Берцелиусу: «Должен сказать вам, что я умею приготовить мочевину, не нуждаясь не в почке, ни в живом организме вообще»
В последние годы блестящие синтезы анилина Г. Кольбе и Э. Франклендом (1842), жира М. Берло (1854), сахаристых веществ А.Бутлеровым (1861) и др. окончательно похоронили миф о «жизненной силе».
Появилось классическое определение К. Шорлеммера, не потерявшее своего значения и более 120 лет спустя:
"Органическая химия есть химия углеводородов и их производных, т.е. продуктов, образующихся при замене водорода другими атомами или группами атомов".
Сейчас органическую химию чаще всего называют химией соединений углерода. Почему же из более чем ста элементов Периодической системы Д. И. Менделеева природа именно углерод положила в основу всего живого? Ответ на этот вопрос неоднозначен. Многое вам станет понятно, когда вы рассмотрите строение атома углерода и поймете слова Д. И. Менделеева, сказанные им в «Основах химии» об этом замечательном элементе: «Углерод встречается в природе как в свободном, так и в соединительном состоянии, в весьма различных формах и видах… Способность атомов углерода соединяться между собой и давать сложные частицы проявляется во всех углеродистых соединениях… Ни в одном из элементов… способности к усложнению не развито в такой степени, как в углероде… Ни одна пара элементов не дает столь много соединений, как углерод с водородом».
Многочисленные связи атомов углерода между собой и с атомами других элементов (водорода, кислорода, азота, серы, фосфора), входящих в состав органических веществ, могут разрушаться под влиянием природных факторов. Поэтому углерод совершает непрерывный круговорот в природе: из атмосферы (углекислый газ) – в растения (фотосинтез), из растений – в животные организмы, из живого – в мертвое, из мертвого – в живое…(рис 1).
Органические вещества имеют ряд особенностей, которые отличают их от неорганических веществ:
1. Неорганических веществ насчитывается немногим более 100 тыс., тогда как органических – почти 18млн (табл. 1).
Таблица 1. Рост числа известных органических соединений
Год | Число известных органических соединений |
1880 | 12 000 |
1910 | 150 000 |
1940 | 500 000 |
1960 | 1 000000 |
1970 | 2 000000 |
1980 | 5 500 000 |
2000 | 18 000000 |
2. В состав всех органических веществ входят углерод и водород, поэтому большинство из них горючи и при горении обязательно образуют углекислый газ и воду.
3. Органические вещества построены более сложно, чем неорганические, и многие из них имеют огромную молекулярную массу, например те, благодаря которым происходят жизненные процессы: белки, жиры, углеводороды, нуклеиновые кислоты и. т. д.
4. Органические вещества можно расположить в ряд сходных по составу, строению и свойствам – гомологов
Гомологическим рядом называется ряд веществ, расположенных в порядке возрастания их относительных молекулярных масс, сходных по строению и химическими свойствам, где каждый член отличается от предыдущего на гомологическую разность СН2
5. Для органических веществ характерной является изомерия, очень редко встречающаяся среди неорганических веществ. Вспомните примеры изомеров, с которыми вы знакомились в 9 классе. В чем причины различий в свойствах изомеров?
Изомерия – это явление существования разных веществ –изомеров с одинаковым качественным и количественным составом, т.е. одинаковой молекулярной формулой.
Величайшим обобщением знаний о неорганических веществах является Периодический закон и Периодическая система элементов Д. И. Менделеева. Для органических веществ аналогом такого обобщения служат теория строения органических соединений А. М. Бутлерова. Вспомните, что Бутлеров понимал под химическим строением. Сформулируйте основные положения этой теории.
Для количественной характеристики способности атомов одного химического элемента соединяться с определенным числом атомов другого химического элемента в неорганической химии, где большинство веществ имеет немолекулярное строение, применяют понятие «степень окисления». В органической химии, где большинство соединений имеет молекулярное строение, используют понятие «валентность». Вспомните, что означают эти понятия, сравните их.
Велико значение органической химии в нашей жизни. В любом организме, в любой момент протекает множество превращений одних органических веществ в другие. Поэтому без знаний органической химии невозможно понять, как осуществляется функционирование систем, образующих живой организм, т.е. сложно понимание биологии и медицины.
С помощью органического синтеза получают разнообразные органические вещества: искусственные и синтетические волокна, каучуки, пластмассы, красители, пестициды (что это такое?), синтетические витамины, гормоны, лекарства и.т.д.
Многие современные продукты и материалы, без которых мы не можем обходиться, являются органическими веществами (табл. 2)
Развитие биотехнологии, т.е. получения органических веществ не из живых организмов, а из клеточных культур (например, получение белков с помощью дрожжей на основе углеводородного сырья), генной инженерии, т.е. синтеза важнейших соединений белковой природы (например, синтез инсулина, интерферона), создание новых видов высокопродуктивных организмов было бы невозможно без достижения органической химии.
Таблица 2. Некоторые природные и синтетические вещества.
Природные вещества | Синтетические вещества |
Белки, углеводы, жиры | Пищевые добавки, стимуляторы |
Витамины | Синтетические витамины |
Ферменты | Катализаторы |
Гормоны | Гормональные препараты |
Лекарства растительного и природного происхождения | Синтетические лекарства |