05.12.22г. ПОНЕДЕЛЬНИК 501,406,405
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 501 ХИМИЯ 13,14
ПРОСМОТРИТЕ ДЛЯ ПОВТОРЕНИЯ ВИДЕО.
Состояние электронов в атоме. Строение атомов элементов больших и малых периодов.
По современным представлениям атом состоит
из положительно заряженного ядра и движущихся вокруг него электронов. В ядре содержатся
протоны и нейтроны. Число протонов, а также электронов равно порядковому номеру элемента.
Частица масса заряд
Протон 1 +1
Нейтрон 1 0
Электрон ≈ 0 – 1
Сумма протонов и нейтронов численно равна относительной атомной массе элемента.
Пространство вокруг ядра, в котором наиболее вероятно место нахождения электрона, называется
орбиталью или электронным облаком. Формы электронных облаков различны (s, p, d, f );
О – s- орбиталь ; ∞ – p- орбиталь
Электронные облака d и f имеют более сложную форму.
Электроны, двигаясь в пространстве вокруг ядра , образуют его электроннуюоболочку, которая
делится на электронные слои или уровни. Распределение электронов по электронным слоям
(уровням) можно представить следующим образом: +1 H ) +6 C ) ) +12 Mg ) ) )
1 2 4 2 8 2
Максимальное число электронов в электронном слое (уровне) определяется по формуле: N = 2 n 2,
где n – номер электронного слоя (уровня).
Число электронных слоев (уровней) равно номеру периода, в котором находится элемент. Уровни
делятся на подуровни (s, p, d, f) и заполняются электронами в определенной последовательности.
В зависимости от того, какой подуровень последним заполняется электронами, все элементы делятся
на 4 семейства: s, p, d, f – элементы. Число валентных электронов (участвующих в образовании
химических связей) численно равно номеру группы.
Электронная конфигурация атомов отображается с помощью электронных формул, например,
атом водорода имеет электронную конфигурацию: 1 S1
А атом углерода – 1 S 2 2 S 2 2 P 2.
У элементов малых и больших периодов строение электронных оболочек атомов отличается.
В малых периодах слева направо число внешних электронов увеличивается резко – от 1 до 8 и
свойства элементов также меняются резко - от металлическим к неметаллическим. Так, в
начале 3 периода стоит типичный металл натрий (легко отдает 1 электрон внешнего уровня), а в
конце периода – типичный неметалл хлор (легко присоединяет 1 электрон до завершения уровня).
Завершает период аргон – инертный газ.
Свойства соединений элементов изменяются от основных к кислотным через амфотерные. Оксиды
натрия и магния – основные, оксид алюминия – амфотерный, а оксиды кремния, фосфора, серы и
хлора – кислотные.
Большие периоды состоят из 2-х рядов. В четных рядах больших периодов на внешнем уровне
число эдектронов не меняется (равно 1 или 2), идет дозаполнение предыдущего снаружи уровня
(d – подуровень, элементы «вставных» декад), поэтому свойства элементов меняются плавно,
здесь все элементы – металлы. В нечетных рядах число внешних эектронов снова резко растет,
как в малом периоде, от 1 до 8 и свойства элементов снова меняются резко - от металлических
к неметаллическим. Однако, в целом, в начале любого большого периода – типичные металлы,
а в конце – типичные неметаллы, т. е. при переходе от одного периода к другому наблюдается
периодичность изменения свойств элементов, а значит, и их соединений. Свойства элементов,
их оксидов, гидратов этих оксидов (и водородных соединений элементов главных подгрупп)
периодически повторяются
В группах (в главных подгруппах) сверху вниз, с ростом заряда ядра и радиуса атома металлические
свойства усиливаются, а неметаллические ослабевают, основность соединений в подгруппе сверху
вниз усиливается.
ТЕМА 13 : Электронные конфигурации атомов химических элементов.
Моделирование построения Периодической таблицы химических элементов.
ЗАДАНИЕ: ПРОЧИТАЙТЕ ВИМАТЕЛЬНО.
1. ПРЕПИШИТЕ И ВЫУЧИТЕ ПРАВИЛА ПАУЛИ И ХУНДА
2. Составьте схемы электронного строения, электронные формулы и графические электронные формулы атомов следующих химических элементов: Са, Fе, Zr, Sn, Nb, Hf, Ра.
Швейцарский физик В. Паули в 1925 г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского «веретено»), то есть обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемой оси: по часовой или против часовой стрелки. Этот принцип носит название принципа Паули.
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, то есть электроны с противоположными спинами.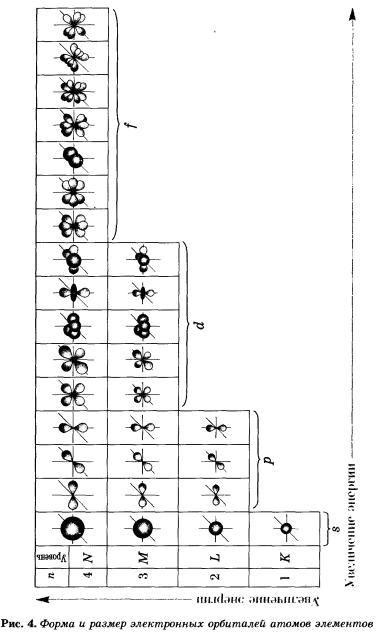
На рисунке 5 показана схема подразделения энергетических уровней на подуровни.
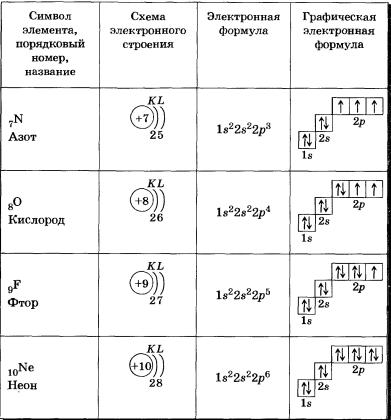
s-Орбиталь, как вы уже знаете, имеет сферическую форму. Электрон атома водорода (s = 1) располагается на этой ор-битали и неспарен. Поэтому его электронная формула или электронная конфигурация будет записываться так: 1s1. В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой (1 ...), латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа вверху от буквы (как показатель степени), показывает число электронов на подуровне.
Для атома гелия Не, имеющего два спаренных электрона на одной s-орбитали, эта формула: 1s2.
Электронная оболочка атома гелия завершена и очень устойчива. Гелий — это благородный газ.
На втором энергетическом уровне (n = 2) имеется четыре орбитали: одна s и три р. Электроны s-орбитали второго уровня (2s-орбитали) обладают более высокой энергией, так как находятся на большем расстоянии от ядра, чем электроны 1s-орбитали (n = 2).
Вообще, для каждого значения n существует одна s-орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере увеличения значения n.
р-Орбиталь имеет форму гантели или объемной восьмерки. Все три р-орбитали расположены в атоме взаимно перпендикулярно вдоль пространственных координат, проведенных через ядро атома. Следует подчеркнуть еще раз, что каждый энергетический уровень (электронный слой), начиная с n = 2, имеет три р-орбитали. С увеличением значения n электроны анимают р-орбитали, расположенные на больших расстояниях от ядра и направленные по осям х, у, г.
У элементов второго периода (n = 2) заполняется сначала одна в-орбиталь, а затем три р-орбитали. Электронная формула 1л: 1s22s1. Электрон слабее связан с ядром атома, поэтому атом лития может легко отдавать его (как вы, очевидно, помните, этот процесс называется окислением), превращаясь в ион Li+.
В атоме бериллия Ве0 четвертый электрон также размещается на 2s-орбитали: 1s22s2. Два внешних электрона атома бериллия легко отрываются — Ве0 при этом окисляется в катион Ве2+.
У атома бора пятый электрон занимает 2р-орбиталь: 1s22s22р1. Далее у атомов С, N, О, Е идет заполнение 2р-орбиталей, которое заканчивается у благородного газа неона: 1s22s22р6.
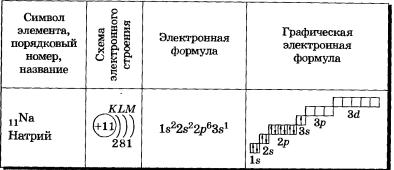
У элементов третьего периода заполняются соответственно Зв- и Зр-орбитали. Пять d-орбиталей третьего уровня при этом остаются свободными:
11Nа 1s22s2Зв1; 17С11в22822р63р5; 18Аг П^Ёр^Зр6.
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, то есть записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул.
У элементов больших периодов (четвертого и пятого) первые два электрона занимают соответственно 4я- и 5я-орбитали: 19К 2, 8, 8, 1; 38Sr 2, 8, 18, 8, 2. Начиная с третьего элемента каждого большого периода, последующие десять электронов поступят на предыдущие 3d- и 4d- орбитали соответственно (у элементов побочных подгрупп): 23V 2, 8, 11, 2; 26Tr 2, 8, 14, 2; 40Zr 2, 8, 18, 10, 2; 43Тг 2, 8, 18, 13, 2. Как правило, тогда, когда будет заполнен предыдущий d-подуровень, начнет заполняться внешний (соответственно 4р- и 5р ) р-подуровень.
У элементов больших периодов — шестого и незавершенного седьмого — электронные уровни и подуровни заполняются электронами, как правило, так: первые два электрона поступят на внешний в-подуровень: 56Ва 2, 8, 18, 18, 8, 2; 87Гг 2, 8, 18, 32, 18, 8, 1; следующий один электрон (у Nа и Ас) на предыдущий (p-подуровень:57Lа 2, 8, 18, 18, 9, 2 и 89Ас 2, 8, 18, 32, 18, 9, 2.
Затем последующие 14 электронов поступят на третий снаружи энергетический уровень на 4f- и 5f-орбитали соответственно у лантаноидов и актиноидов.
Затем снова начнет застраиваться второй снаружи энергетический уровень (d-подуровень): у элементов побочных подгрупп: 73Та 2, 8,18, 32,11, 2; 104Rf 2, 8,18, 32, 32,10, 2, — и, наконец, только после полного заполнения десятью электронами сйгоду-ровня будет снова заполняться внешний р-подуровень:
86Rn 2, 8, 18, 32, 18, 8.
Очень часто строение электронных оболочек атомов изображают с помощью энергетических или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки (орбитали), располагаются в них сначала по одному и имеют при этом одинаковое значение спина, а лишь затем спариваются, но спины при этом по принципу Паули будут уже противоположно направленными.
В заключение еще раз рассмотрим отображение электронных конфигураций атомов элементов по периодам системы Д. И. Менделеева. Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).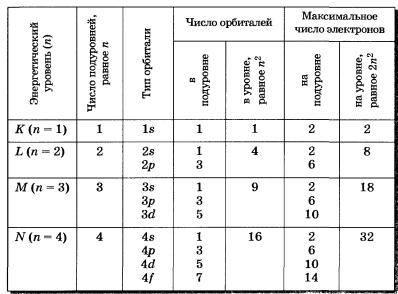
В атоме гелия первый электронный слой завершен — в нем 2 электрона.
Водород и гелий — s-элементы, у этих атомов заполняется электронами s-орбиталь.
Элементы второго периода
У всех элементов второго периода первый электронный слой заполнен и электроны заполняют е- и р-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала s-, а затем р ) и правилами Паули и Хунда (табл. 2).
В атоме неона второй электронный слой завершен — в нем 8 электронов.
Таблица 2 Строение электронных оболочек атомов элементов второго периода
Li, Ве — в-элементы.
В, С, N, О, F, Nе — р-элементы, у этих атомов заполняются электронами р-орбитали.
Элементы третьего периода
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать Зs-, 3р- и Зd-подуровни (табл. 3).
Таблица 3 Строение электронных оболочек атомов элементов третьего периода
У атома магния достраивается Зs-электронная орбиталь. Nа и Mg— s-элементы.
В атоме аргона на внешнем слое (третьем электронном слое) 8 электронов. Как внешний слой, он завершен, но всего в третьем электронном слое, как вы уже знаете, может быть 18 электронов, а это значит, что у элементов третьего периода остаются незаполненными Зd-орбитали.
Все элементы от Аl до Аг — р-элементы. s- и р-элементы образуют главные подгруппы в Периодической системе.
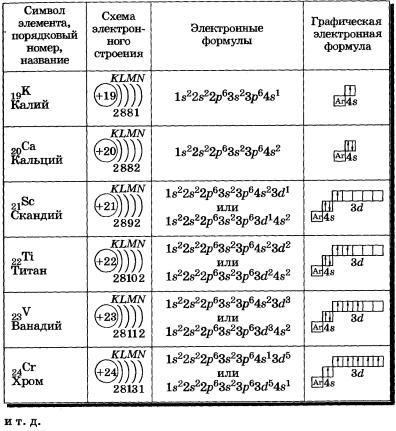
У атомов калия и кальция появляется четвертый электронный слой, заполняется 4s-подуровень (табл. 4), так как он имеет меньшую энергию, чем Зй-подуровень. Для упрощения графических электронных формул атомов элементов четвертого периода: 1) обозначим условно графическую электронную формулу аргона так:
Аr;
2) не будем изображать подуровни, которые у этих атомов не заполняются.
Таблица 4 Строение электронных оболочек атомов элементов четвертого периода
К, Са — s-элементы, входящие в главные подгруппы. У атомов от Sс до Zn заполняется электронами Зй-подуровень. Это Зй-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
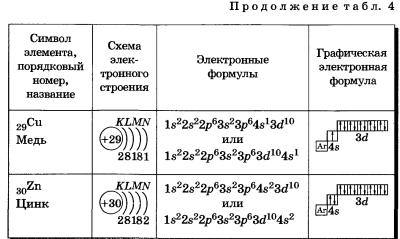
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с 4я- на Зй-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций Зd5 и Зd10:
В атоме цинка третий электронный слой завершен — в нем заполнены все подуровни 3s, Зр и Зd, всего на них 18 электронов.
У следующих за цинком элементов продолжает заполняться четвертый электронный слой, 4р-подуровень: Элементы от Gа до Кr — р-элементы.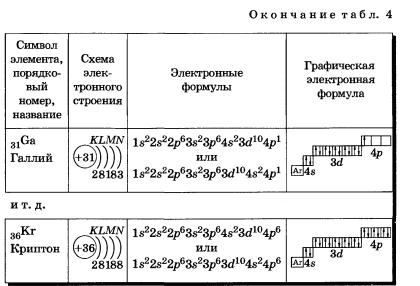
У атома криптона внешний слой (четвертый) завершен, имеет 8 электронов. Но всего в четвертом электронном слое, как вы знаете, может быть 32 электрона; у атома криптона пока остаются незаполненными 4d- и 4f- подуровни.
У элементов пятого периода идет заполнение подуровней в следующем порядке: 5s-> 4d -> 5р. И также встречаются исключения, связанные с «провалом» электронов, у 41Nb, 42MO и т.д.
В шестом и седьмом периодах появляются элементы, то есть элементы, у которых идет заполнение соответственно 4f- и 5f-подуровней третьего снаружи электронного слоя.
4f-Элементы называют лантаноидами.
5f-Элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: 55Сs и 56Ва — 6s-элементы;
57Lа... 6s25d1 — 5d-элемент; 58Се — 71Lu — 4f-элементы; 72Hf — 80Нg — 5d-элементы; 81Тl— 86Rn — 6р-элементы. Но и здесь встречаются элементы, у которых «нарушается» порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных f подуровней, то есть nf7 и nf14.
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, как вы уже поняли, делят на четыре электронных семейства или блока (рис. 7).
1) s-Элементы; заполняется электронами в-подуровень внешнего уровня атома; к s-элементам относятся водород, гелий и элементы главных подгрупп I и II групп;
2) р-элементы; заполняется электронами р-подуровень внешнего уровня атома; к р элементам относятся элементы главных подгрупп III—VIII групп;
3) d-элементы; заполняется электронами d-подуровень предвнешнего уровня атома; к d-элементам относятся элементы побочных подгрупп I—VIII групп, то есть элементы вставных декад больших периодов, расположенные между s- и р-элементами. Их также называют переходными элементами;
4) f-элементы, заполняется электронами f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и актиноиды.
ТЕМА 14:Ионная химическая связь. Катионы, их образование из атомов в результате процесса окисления. Анионы, их образование из атомов в результате процесса восстановления.
Теория:







ГРУППА 406 ХИМИЯ 28,29,30
ТЕМА 28,29,30: Натуральный и синтетические каучуки. Резина.
Ознакомление с коллекцией каучуков и образцами изделий из резины.
Алкины. Ацетилен. Химические свойства ацетилена: горение, обесцвечивание бромной воды, присоединение хлороводорода и гидратация.
Применение ацетилена на основе свойств.
Натуральный и синтетические каучуки. Резина.
Ознакомление с коллекцией каучуков и образцами изделий из резины.
Натуральный и синтетические каучуки. Резина.
Особенностью реакций присоединения к алкадиенам с сопряженными двойными связями является способность присоединять молекулы как по месту разрыва двойной связи (1,2-присоединение), так и к крайним углеродным атомам (1,4-присоединение) .
1,2 присоединение:
СН2= СН– СН =СН2 + Сl2 СН2Cl– СНCl– СН =СН2
1,4 присоединение:
СН2= СН– СН =СН2 + Сl2 СН2Cl– СН= СН – СН2Cl
Оба вида присоединения протекают параллельно. Выход того или иного продукта определяется условиями протекания реакции и характером реагента. Так атомарный водород присоединяется в положение 1,4, а молекулярный водород над катализатором – в 1,2 положение, либо происходит полное гидрирование .
1,2 присоединение:
СН2= СН– СН =СН2 Н2СН3–СН2 – СН =СН2 Н2СН3–СН2 – СН2 – СН3
бутан
1,4 присоединение:
СН2= СН– СН =СН2 2Н СН3– СН =СН – СН3 бутен-2
Запишите реакцию присоединения бромоводорода, учитывая правило Марковникова.
Проверим себя.
СН2= СН– СН =СН2 + HBr СН3 – СНBr– СН =СН2
3-бромбутен-1 (1,2 присоединение)
СН2= СН– СН =СН2 + HBr СН2 Br–СН= СН– СН3
1-бромбутен-2 (1,4 присоединение)
Реакции полимеризации идут преимущественно по 1,4 положениям, при этом получаются высокомолекулярные синтетические каучуки :
nСН2= СН–СН =СН2 (–СН2– СН =СН – СН2 –)n
бутадиен-1,3 бутадиеновый каучук
nСН2= С–СН =СН2 (–СН2 – С = СН –СН2 –) n
СН3 СН3
изопрен изопреновый каучук
Запишите уравнение реакции получения хлоропренового каучука, если мономером для его получения является хлоропрен (2-хлорбутадиен-1,3).
Проверим себя .
nСН2= С–СН =СН2 (–СН2 – С = СН –СН2 –) n
Сl Сl
хлоропрен хлоропреновый каучук
Каучуки бывают природные (натуральные) и синтетические. Учитель демонстрирует коллекции каучука, учащиеся отмечают в тетрадь свойства. Природный каучук является липким, эластичным, резиноподобным материалом. Синтетические каучуки обладают такими свойствами как: высокая износостойкость, устойчивость к многократным деформациям, высокая устойчивость к органическим растворителям (слайд 13).
Заслушаем сообщение о «Знакомстве европейцев с каучуком» (приложение 1) (слайд 14)
Каучуки – исходное сырье для получения резины. Процесс получения резины из каучука называют вулканизацией. Получающаяся резина содержит около 5% S, и по своим свойствам значительно превосходит исходный продукт. «Историю изобретения резины» мы узнаем из сообщения (приложение 2)
Способы получения
Бутадиен-1,3, изопрен и другие алкадиены имеют огромное промышленное значение, они служат сырьем для получения синтетических полимеров, производство которых составляет миллионы тонн в год. Рассмотрим промышленные способы получения алкадиенов (слайд 17-18):
Дегидрирование:
С 4Н10 600˚С, Al2O3, Cr2O3СН2= СН–СН =СН2 + 2H2
4Н10 600˚С, Al2O3, Cr2O3СН2= СН–СН =СН2 + 2H2
бутадиен-1,3
С Н3 – СH – СН2 – СН3 t, Al2O3, Cr2O3 СН2= С–СН =СН2 + 2H2
Н3 – СH – СН2 – СН3 t, Al2O3, Cr2O3 СН2= С–СН =СН2 + 2H2
СН3 СН3
изопрен (2-метилбутадиен-1,3)
Дегидратация и дегидрирование спиртов (метод Лебедева):
С2Н5ОН 400-500 °С, Al2O3, ZnOСН2= СН–СН =СН2 + 2H2O + H2

Дегидрогалогенирование:
C l– СН2 – СH – СН2 – СН2 –Cl + 2KOH 600˚С,ZnO, MgO
l– СН2 – СH – СН2 – СН2 –Cl + 2KOH 600˚С,ZnO, MgO
СН2= СН–СН =СН2 + 2KCl + 2 H2O
6. Направления применения
Алкадиены применяются для производства каучука и резины, о них мы уже говорили. Для закрепления этого вопроса выполним упражнение 4 стр. 34 в рабочей тетради (Габриелян, О.С. Химия 10 класс: рабочая тетрадь к учебнику «Химия 10 класс. Базовый уровень») (слайд 19). При работе с интерактивной доской ученик может воспользоваться стрелками для соединения блоков схемы.
Приложение 1
« Знакомство европейцев с каучуком»
Каучук существует столько лет, сколько и сама природа. Окаменелые остатки каучуконосных деревьев, которые были найдены, имеют возраст около трёх миллионов лет. Каучук на языке индейцев тупи-гуарани означает «слёзы дерева» («кау» – дерево, «учу» – плакать, течь). Каучуковые шары из сырой резины найдены среди руин цивилизаций инков и майя в Центральной и Южной Америке, возраст этих шаров не менее 900 лет.
Первое знакомство европейцев с натуральным каучуком произошло почти пять веков назад. Собственно, история каучука началась, как ни странно, с детского мячика и школьной резинки.
В 1493 году корабль Христофора Колумба во время второго путешествия в Америку пристал к острову, названному именем Эспаньола (Гаити). Высадившись на берег, испанцы были удивлены весёлой игрой индейцев, похожей на наш баскетбол. Они в такт песне подбрасывали чёрные шары, которые, упав на землю, делали, словно живые, высокие и забавные прыжки. Взяв эти шары в руки, испанцы нашли, что они довольно тяжелы, липки и пахнут дымом.
Индейцы скатывали их из загустевшего млечного сока, вытекавшего из порезов на коре дерева гевеи. Колумб привёз несколько кусков этого удивительного вещества на родину, но в те времена он никого не заинтересовал. Индейцы делали из него непромокаемые калоши, которые в жару прилипали к ногам, а, растянувшись, больше уже не сжимались.
Много лет испанцы пытались повторить водонепроницаемые вещи (обувь, одежду, головные уборы) индейцев, но все попытки были неудачными.
Первые попытки сделать каучуковую обувь вызывали только смех. Галоши или сапоги хорошо служили в дождь, но стоило выглянуть и припечь солнцу, как они растягивались, начинали прилипать. В мороз же такая обувь становилась хрупкой, как стекло.
Следующие два века каучук для Европы был просто любопытной заморской диковинкой.
В 1731 году правительство Франции отправило математика и географа Шарля Кондамина в географическую экспедицию по Южной Америке. В 1736 он отправил обратно во Францию несколько образцов каучука вместе с описанием продукции, производимой из него людьми, населяющими Амазонскую низменность. После этого резко возрос научный интерес к изучению этого вещества и его свойств.
В 1770 году британский химик Джозеф Пристли впервые нашёл ему применение: он обнаружил, что каучук может стирать то, что написано графитовым карандашом. Тогда такие куски каучука называли гуммиластиком («смолой эластичной»).
В 1791 году английский фабрикант Самуэль Пил запатентовал способ сделать одежду водонепроницаемой с помощью обработки её раствором каучука в скипидаре.
Во Франции к 1820 г. научились изготовлять подтяжки и подвязки из каучуковых нитей, сплетённых с тканью.
В Англии британский химик и изобретатель Чарльз Макинтош пропитал каучуком плотную материю, и она стала непромокаемой. Так появились первые плащи-макинтоши, а потом и первые галоши, и сумки для перевозки почты. Правда, потом стал очевиден большой недостаток всей этой продукции, делавший ее совершенно непригодной: в сильную жару материал становился слишком мягким, а в холодную погоду затвердевал, как камень.
В США вещи из каучука стали популярными в 1830-х годах, резиновые бутылки и обувь, сделанные южноамериканскими индейцами, импортировались в больших количествах. Другие резиновые изделия завозились из Англии, а в 1832 году в городе Роксбери штата Массачусетс Джон Хаскинс и Эдвард Шафе организовали первую «каучуковую» фабрику в США.
Открытие в 1839 году резины, полученной от нагревания каучука и серы, привело к широкому её применению.
Внимание капиталистов всех стран обратилось на добычу каучука. Бразилия оказалась владетельницей громадных богатств. Чтобы сохранить их, правительство Бразилии издало закон, запрещающий под страхом смерти вывоз семян и молодых деревьев гевеи. Но было поздно. По совету ботаника Дж. Гукера, англичанин Викгем поехал в 1876 году на берега Амазонки, где собрал 70000 семян Гевеи и тайком доставил их в ботанический сад в Кью. Семена были высеяны, но взошло только 4%. Однако через несколько дней сеянцы достигли полуметровой высоты. Затем они были отправлены на остров Цейлон, а оттуда разосланы на Яву, в Бирму, Австралию и др.
В нашей стране не было известно природных источников для получения натурального каучука, а из других стран каучук к нам не завозился. Впервые в промышленных масштабах синтетический каучук был получен выдающимся русским ученым С.В Лебедевым.
Приложение2
«История открытия вулканизации резины».
История открытия Чарльзом Гудийром вулканизации резины – одна из самых запутанных и непостижимых историй. Этот человек не имел права на успех. Он не обладал нужными знаниями и подготовкой. Он сталкивался с трудностями, перед которыми спасовал бы любой другой. Часто он даже не знал, чего добивался.
Гудийр начал опыты с бразильской эластичной смолой, изготовляя дома тонкие пленки при помощи скалки для теста. Он смешивал сырую смолу с любым попадавшимся под руку веществом: солью, перцем, сахаром, песком, касторовым маслом, даже с супом – следуя великолепному логическому заключению, что рано или поздно он перепробует все, что есть на земле, и наконец наткнется на удачное сочетание. Житель Нью-Хэвена Ральф Стил одолжил Гудийру денег, и тот открыл на них лавку. На полках красовались сотни пар галош. Но в первый же жаркий день они растаяли и превратились в дурно пахнущее месиво.
Гудийр закрыл свою лавку и занялся опытами, смешивая с резиновой смолой множество веществ: орешник, сыр, чернила и все это никуда не годилось, за исключением магнезии. Когда он смещал фунт магнезии с фунтом резиновой смолы, получился материал белее резиновой смолы и гибкий и прочный, как кожа. Он изготовил из него обложки для книг, чехлы для роялей, показал публике, получил горячее одобрение, смеялся от радости – и через месяц убедился, что его вновь постигла полная неудача.
В то время Гудийр думал, что его рецепт с магнезией можно еще как-то усовершенствовать. Он кипятил смесь смолы и магнезии в водном растворе негашеной извести и получал пласты резины, которая была гораздо глаже и прочнее прежней.
Газеты восхваляли его как человека, спасшего резиновую промышленность. Но через три недели Гудийр обнаружил, что одной капли самой слабой кислоты – даже яблочного сока – было достаточно, чтобы нейтрализовать негашеную известь и разрушить материал.
Многократные опыты требовали денег, и в итоге исследователь оказался в долговой тюрьме; именно там, продолжая опыты, он обнаружил, что липкость исчезает, если посыпать каучук серой и высушить его. Уже выйдя из тюрьмы, Гудийр, опять же по рассеянности, положил кусочек каучука с серой не на стол, а на горячую плиту. Ошибка оказалась открытием, потому что на плите Гудийр обнаружил не липкую смесь, а сухой мягкий упругий кусок… уже резины. Под действием серы при умеренном нагревании каучук приобретал большую прочность, твердость, становился менее чувствительным к переменам температуры. Процесс назвали вулканизацией, а вулканизированный каучук – резиной.
Вот как описывала первые испытания нового материала дочь Гудийра: «Я случайно увидела, что отец держит у огня маленький кусочек резины, и заметила, что в тот день он был необычайно взволнован каким-то открытием. Он вышел из дома и прибил кусок гвоздем к стене. Стояли сильные холода. На следующее утро отец принес этот кусочек в дом и торжествующе поднял его над головой. Резина была такой же гибкой, как и раньше. Это доказывало ценность открытия».
Вулканизация резины послужила толчком для развития электропромышленности, так как резина является прекрасным материалом для изоляции. Еще при жизни Гудийра в Соединенных Штатах, Англии, Франции и Германии выросли корпуса огромных фабрик, на которых работало более шестидесяти тысяч человек и изготовлялось пятьсот видов различных резиновых изделий, в общей сложности на 8 миллионов долларов в год. Окрыленный успехом, Гудийр стал тратить больше, чем зарабатывал. Он умер в 1860 году, оставив после себя двести тысяч долларов долгу, но друзья уже не считали его сумасшедшим.
«Гудйер Тайр энд Раббер» (Goodyear Tyre and Rubber), резинотехническая фирма США. Основана в 1898. Главный производитель синтетического каучука в США, выпускает также военную продукцию; 1-е место в мире по производству шин.
Тема: Алкины. Ацетилен. Химические свойства ацетилена: горение, обесцвечивание бромной воды, присоединение хлороводорода и гидратация.
ТЕМА: Применение ацетилена на основе свойств.
.
АЛКИНЫ. АЦЕТИЛЕН. ХИМИЧЕСКИЕ СВОЙСТВА АЦЕТИЛЕНА: ГОРЕНИЕ, ОБЕСЦВЕЧИВАНИЕ БРОМНОЙ ВОДЫ, ПРИСОЕДИНЕНИЕ ХЛОРОВОДОРОДА И ГИДРАТАЦИЯ. ПРИМЕНЕНИЕ АЦЕТИЛЕНА НА ОСНОВЕ СВОЙСТВ.
На этом уроке вы сможете самостоятельно изучить тему «Алкины. Строение, номенклатура, изомерия, физические свойства, получение». В ходе урока вы узнаете о том, что представляют собой алкины – ациклические углеводороды, содержащие в молекуле одну тройную связь. Познакомитесь с физическими свойствами алкинов, особенностями их строения.
НОМЕНКЛАТУРА АЛКИНОВ
Алкины (ацетиленовые углеводороды) – углеводороды, молекулы которых содержат тройную связь углерод-углерод. Общая формула алкинов – CnH2n-2.
Номенклатура алкинов
Тройную связь обозначают суффиксом -ин.
 | |
| ацетилен (этин) | бутин-1 |
Главная цепь должна включать в себя тройные связи, а нумерация проводится так, чтобы они получили наименьшие номера.

3,6-диметилгептадиин-1,4

Рис. 1. Шаростержневая модель ацетилена
СТРОЕНИЕ АЛКИНОВ
Атомы углерода тройной связи находятся в состоянии sp-гибридизации. Сигма-связи, образуемые sp-гибридными атомами углерода, расположены под углом 180о друг к другу.
Тройная связь короче и прочнее двойной связи. Она образована тремя парами электронов и включает одну σ- и две π-связи. Две π-связи лежат во взаимно перпендикулярных плоскостях. Рис. 2.

Рис. 2. Образование тройной связи в молекуле ацетилена
3. ИЗОМЕРИЯ АЛКИНОВ
1. Изомерия скелета
2. Изомерия положения тройной связи
| бутин-1 | бутин-2 |
3. Межклассовая изомерия. Алкинам изомерны, например, алкадиены и циклоалкены.
 |  | |
| бутин-1 | бутадиен-1,3 | циклобутен |
Алкины не обладают геометрической изомерией.
4. ФИЗИЧЕСКИЕ СВОЙСТВА И ПОЛУЧЕНИЕ АЛКИНОВ
Ацетилен, пропин и бутин-1 при комнатной температуре – бесцветные газы, остальные алкины – жидкости или твердые вещества.
Ацетилен немного растворим в воде, хорошо растворяется в ацетоне. Это используют для его хранения и транспортировки. Ацетилен нельзя хранить в баллонах в сжатом состоянии, т.к. под давлением он разлагается со взрывом. В баллон помещают пористый материал, пропитанный ацетоном, а в нем растворяют ацетилен.
Получение алкинов
1. В промышленности ацетилен получают термическим разложением (пиролизом) метана: 2СН4![]() С2Н2 + 3Н2.
С2Н2 + 3Н2.
2. Для получения ацетилена в лаборатории и в технических целях используют взаимодействие карбида кальция с водой:
СаC2 + Н2О ¾¾¾→ Сa(OH)2 + C2H2.
3. Другие алкины в лаборатории получают взаимодействием дигалогеналканов, содержащих атомы галогенов у одного или у соседних атомов углерода, со спиртовым раствором щелочи при нагревании:

1. Реакции гидрирования и галогенирования
Гидрирование алкинов протекает в тех же условиях, что гидрирование алкенов. В зависимости от количества водорода может образоваться алкен или алкан.
![]()
![]()
Электрофильное присоединение
Алкины менее активны в электрофильном присоединении, чем алкены. Почему? Потому что тройная связь короче и прочнее, чем двойная. Поэтому в некоторых случаях для осуществления реакции необходимы специальные условия (например, присутствие солей ртути в качестве катализатора).
Реакции присоединения к алкинам могут проходить в два этапа: на первом образуется вещество с двойной связью.
2. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА АЛКИНЫ
1. Галогенирование.
Обесцвечивание бромной воды – качественная реакция на алкины, так же как на алкены.


2. Гидрогалогенирование.
Присоединение хлороводорода к ацетилену приводит к образованию винилхлорида (хлорэтена) – мономера для синтеза распространенного материала поливинилхлорида (ПВХ):
![]()
3. РЕАКЦИЯ КУЧЕРОВА
3. Гидратация (реакция Кучерова)
Реакция проходит в кислой среде в присутствии солей ртути. Образующийся на первой стадии фенол перегруппировывается в карбонильное соединение.


Выполните тест, в конце теста знак "отправить"