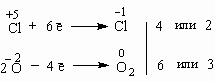Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com Тетрадь привезете, когда перейдем на очную форму обучения.)
Моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
СПРАВА НАХОДИТСЯ АРХИВ- ТАМ СМОТРИМ ДАТУ И ГРУППЫ
РАСПИСАНИЕ ЗАНЯТИЙ НА НЕДЕЛЮ: 27.03.23г. - 31.03.23г.
Пн.27.03: 401, 401, 403
Вт. 28.03:508, 505, 505, 501
Ср. 29.03: 505, 401, 501
Чт. 30.03: 505, 508
Пт. 31.03: 505, ..., 501
ГРУППА 505 ХИМИЯ 48
ТЕМА:Окислительно-восстановительные реакции. Степень окисления. Окислитель и восстановление. Восстановитель и окисление. Метод электронного баланса для составления уравнений окислительно-восстановительных реакций.
Окислительно-восстановительные реакции. Степень окисления. Окислитель и восстановление. Восстановитель и окисление. Метод электронного баланса для составления уравнений окислительно-восстановительных реакций.
Уравнения окислительно-восстановительных реакций.
Многие химические реакции уравниваются простым подбором коэффициентов. Но иногда возникают сложности: количество атомов какого-нибудь элемента в левой и правой частях уравнения никак не удается сделать одинаковым без того, чтобы не нарушить "равновесия" между атомами других элементов.
Чаще всего такие сложности возникают в уравнениях окислительно-восстановительных реакций. Для их уравнивания используют несколько способов, из которых мы пока рассмотрим один – метод электронного баланса.
Напишем уравнение реакции между алюминием и кислородом:
Al + O2 = Al2O3
Пусть вас не вводит в заблуждение простота этого уравнения. Наша задача – разобраться в методе, который в будущем позволит вам уравнивать гораздо более сложные реакции.
Итак, в чем заключается метод электронного баланса? Баланс – это равенство. Поэтому следует сделать одинаковым количество электронов, которые отдает один элемент и принимает другой элемент в данной реакции. Первоначально это количество выглядит разным, что видно из разных степеней окисления алюминия и кислорода:
0 | 0 | +3 –2 | ||
Al | + | O2 | = | Al2O3 |
Алюминий отдает электроны (приобретает положительную степень окисления), а кислород – принимает электроны (приобретает отрицательную степень окисления). Чтобы получить степень окисления +3, атом алюминия должен отдать 3 электрона. Молекула кислорода, чтобы превратиться в кислородные атомы со степенью окисления -2, должна принять 4 электрона:
`
Чтобы количество отданных и принятых электронов выровнялось, первое уравнение надо умножить на 4, а второе – на 3. Для этого достаточно переместить числа отданных и принятых электронов против верхней и нижней строчки так, как показано на схеме вверху.
Если теперь в уравнении перед восстановителем (Al) мы поставим найденный нами коэффициент 4, а перед окислителем (O2) – найденный нами коэффициент 3, то количество отданных и принятых электронов выравнивается и становится равным 12. Электронный баланс достигнут. Видно, что перед продуктом реакции Al2O3 необходим коэффициент 2. Теперь уравнение окислительно-восстановительной реакции уравнено:
4Al + 3O2 = 2Al2O3
Все преимущества метода электронного баланса проявляются в более сложных случаях, чем окисление алюминия кислородом. Например, известная всем "марганцовка" – марганцевокислый калий KMnO4 – является сильным окислителем за счет атома Mn в степени окисления +7. Даже анион хлора Cl– отдает ему электрон, превращаясь в атом хлора. Это иногда используют для получения газообразного хлора в лаборатории:
+7 | –1 | 0 | +2 | |||||||||
KMnO4 | + | KCl | + | H2SO4 | = | Cl2 | + | MnSO4 | + | K2SO4 | + | H2O |
Составим схему электронного баланса:
Двойка и пятерка – главные коэффициенты уравнения, благодаря которым удается легко подобрать все другие коэффициенты. Перед Cl2 следует поставить коэффициент 5 (или 2·5 = 10 перед KСl), а перед KMnO4 – коэффициент 2. Все остальные коэффициенты привязывают к этим двум коэффициентам. Это гораздо легче, чем действовать простым перебором чисел.
2KMnO4 + 10KCl + 8H2SO4 = 5Cl2 + 2MnSO4 + 6K2SO4 + 8H2O
Чтобы уравнять количество атомов К (12 атомов слева), надо перед K2SO4 в правой части уравнения поставить коэффициент 6. Наконец, чтобы уравнять кислород и водород, достаточно перед H2SO4 и H2O поставить коэффициент 8. Мы получили уравнение в окончательном виде.
Метод электронного баланса, как мы видим, не исключает и обыкновенного подбора коэффициентов в уравнениях окислительно-восстановительных реакций, но может заметно облегчить такой подбор.
** Окислительно-восстановительные реакции играют огромную роль в природе и технике. Без этих реакций невозможна жизнь, потому что дыхание, обмен веществ, синтез растениями клетчатки из углекислого газа и воды – все это окислительно-восстановительные процессы.
В технике с помощью реакций этого типа получают такие важные вещества как аммиак (NH3), серную (H2SO4)и соляную (HCl) кислоты и многие другие продукты. Вся металлургия основана на восстановлении металлов из их соединений – руд. Большинство химических реакций – окислительно-восстановительные. Приведем важнейшие определения, связанные с окислительно-восстановительными реакциями.
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Окислителями называются вещества, присоединяющие электроны. Во время реакции они восстанавливаются.
Восстановителями называются вещества, отдающие электроны. Во время реакции они окисляются.
Поскольку окислитель присоединяет электроны, степень окисления его атомов может только уменьшаться. Наоборот, восстановитель теряет электроны и степень окисления его атомов должна повышаться.
Окисление всегда сопровождается восстановлением и, наоборот, восстановление всегда связано с окислением.
Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
Если каждый атом окислителя может принять иное количество электронов, чем отдает атом восстановителя, то необходимо так подобрать количество атомов того и другого реагента, чтобы количество отдаваемых и принимаемых электронов стало одинаковым. Это требование положено в основу метода электронного баланса, с помощью которого уравнивают уравнения окислительно-восстановительных реакций.
Различают три основных типа окислительно-восстановительных реакций:
1) Реакции МЕЖМОЛЕКУЛЯРНОГО окисления-восстановления (когда окислитель и восстановитель – разные вещества);
2) Реакции ДИСПРОПОРЦИОНИРОВАНИЯ (когда окислителем и восстановителем может служить одно и то же вещество);
3) Реакции ВНУТРИМОЛЕКУЛЯРНОГО окисления-восстановления (когда одна часть молекулы выступает в роли окислителя, а другая – в роли восстановителя).
Рассмотрим примеры реакций трех типов.
1. Реакциями межмолекулярного окисления-восстановления являются все уже рассмотренные нами в этом параграфе реакции.
Рассмотрим несколько более сложный случай, когда не весь окислитель может быть израсходован в реакции, поскольку часть его участвует в обычной – не окислительно-восстановительной реакции обмена:
0 | +5 | +2 | +2 | |||||
Cu | + | HNO3 | = | Cu(NO3)2 | + | NO | + | H2O |
Часть частиц NO3- участвует в реакции в качестве окислителя, давая оксид азота NO, а часть ионов NO3- в неизменном виде переходит в соединение меди Cu(NO3)2. Составим электронный баланс:
Поставим найденный для меди коэффициент 3 перед Cu и Cu(NO3)2. А вот коэффициент 2 следует поставить только перед NO, потому что весь имеющийся в нем азот участвовал в окислительно-восстановительной реакции. Было бы ошибкой поставить коэффициент 2 перед HNO3, потому что это вещество включает в себя и те атомы азота, которые не участвуют в окислении-восстановлении и входят в состав продукта Cu(NO3)2 (частицы NO3- здесь иногда называют “ионом-наблюдателем”).
Остальные коэффициенты подбираются без труда по уже найденным:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
2. Реакции диспропорционирования происходят тогда, когда молекулы одного и того же вещества способны окислять и восстанавливать друг друга. Это становится возможным, если вещество содержит в своем составе атомы какого-либо элемента в ПРОМЕЖУТОЧНОЙ степени окисления. Следовательно, степень окисления способна как понижаться, так и повышаться. Например:
+3 | +5 | +2 | ||||
HNO2 | = | HNO3 | + | NO | + | H2O |
Эту реакцию можно представить как реакцию между HNO2 и HNO2 как окислителем и восстановителем и применить метод электронного баланса:
+3 | +3 | +5 | +2 | |||||
HNO2 | + | HNO2 | = | HNO3 | + | NO | + | H2O |
Получаем уравнение:
2HNO2 + 1HNO2 = 1HNO3 + 2NO + H2O
Или, складывая вместе моли HNO2:
3HNO2 = HNO3 + 2NO + H2O
3. Реакции внутримолекулярного окисления-восстановления происходят тогда, когда в молекуле соседствуют атомы-окислители и атомы-восстановители. Рассмотрим разложение бертолетовой соли KClO3 при нагревании:
+5 | –1 | 0 | ||
KClO3 | = | KCl | + | O2 |
Это уравнение также подчиняется требованию электронного баланса:
Здесь возникает сложность – какой из двух найденных коэффициентов поставить перед KClO3 – ведь эта молекула содержит и окислитель и восстановитель? В таких случаях найденные коэффициенты ставятся перед продуктами:
KClO3 = 2KCl + 3O2
Теперь ясно, что перед KClO3 надо поставить коэффициент 2.
2KClO3 = 2KCl + 3O2
Внутримолекулярная реакция разложения бертолетовой соли при нагревании используется при получении кислорода в лаборатории.
Мы рассмотрели важнейшие типы окислительно-восстановительных реакций и метод электронного баланса, но пока не касались вопроса составления уравнений таких реакций. Распространенное заблуждение заключается в том, что вы можете сразу предсказать продукт (или продукты) окислительно-восстановительной реакции. Это не так. Лишь по мере накопления опыта, особенно в лаборатории, вы сможете делать все больше и больше правильных предсказаний. А пока следует научиться уравнивать реакции, реагенты и продукты которых заранее известны.
Горение алюминия на воздухе.
Алюминий - активный металл, но из-за очень прочной оксидной пленки на его поверхности не реагирует при обычных условиях с водой и не окисляется. Однако если алюминий перевести в раздробленное состояние - алюминиевую пыль, то он легко сгорает на воздухе. Поместим в пробирку немного алюминиевой пыли и закроем ее пробкой с двумя трубками, одна из которых доходит почти до дна, а другая заканчивается недалеко от пробки. По длинной трубке подадим в пробирку ток воздуха. Струю воздуха, выходящую из короткой трубки и содержащую частички алюминия, направим в пламя горелки. Попадая в пламя, алюминий сгорает яркими вспышками.
4Al + 3O2 = 2Al2O3
Оборудование: штатив, пробирка с боковым отростком, газоотводная трубка, горелка, штапель.
Техника безопасности. Соблюдать правила пожарной безопасности и правила работы с нагревательными приборами. Не направлять пламя в сторону находящихся рядом людей.
ГРУППА 508 БИОЛОГИЯ 41,42
ТЕМА: Наследственная изменчивость человека. Лечение и предупреждение некоторых наследственных болезней человека.
- Итак, мы с вами продолжаем изучать живые организмы на клеточном уровне. Давайте вспомним, что же такое клетка?
Клетка – это структурно-функциональная элементарная единица строения и жизнедеятельности всех живых организмов.
- Что же в ней такого уникального?
Клетка обладает собственным обменом веществ, так как является открытой системой; способна к самостоятельному существованию, самовоспроизведению, а также является одноклеточным организмом (дробянки и цианобактерии).
А на какие две группы делятся клеточные организмы?
На прокариоты и эукариоты, а в чем различия между этими двумя группами организмов?
Различие в особенностях строения есть – это наличие кольцевой хромосомы у прокариотов (нуклеоид) и наличие оформленного ядра у эукариотов.
Живые организмы
прокариоты эукариоты
не имеют оформленного яра имеют оформленное ядро
Бактерии Грибы
Цианобактерии Растения
Животные
Давайте вспомним, как выглядят клетки прокариот:


А теперь давайте вспомним особенности строения ядра.

Что же является самой главной частью ядра? Правильно, хромосомы, потому что в них находится наследственная информация.
НА организм влияют мутагены, вызывающие мутационную изменчивость. И сегодня на уроке именно этот вопрос мы рассмотрим более подробно.
Мутаген – соединение химической, биологической или физической природы, способное прямо или косвенно повреждать наследственные структуры клетки. (определение записать в тетрадь).
Мутация – в широком смысле слова внезапно возникающее наследуемое изменение. Другими словами мутация – любое структурное или композиционное изменение в ДНК организма произошедшее спонтанно или индуцированное мутагенами. (определение записать в тетрадь).
По происхождению мутагены можно разделить на экзогенные (многие факторы внешней среды) и эндогенные (образуются в процессе жизнедеятельности организма).
По природе возникновения различают: физические, химические и биологические мутагены.
По этому вопросу нам расскажут ребята в своих сообщениях. (Задания на опережающее обучение).
А теперь давайте рассмотрим, какие же мутации возникают у живых организмов на примере человеческого организма. (Задания на опережающее обучение).
Мутации
(виды мутаций записать в тетрадь)
Точечные или генные – изменение в структуре гена, вызванные нарушением последовательности нуклеотидов в молекулах нуклеиновых кислот (выпадение или добавление отдельных нуклеотидов, замена одного нуклеотида другим). (Задания на опережающее обучение).
Хромосомные связаны с изменениями количества отдельных гомологичных хромосом или в их строении. (Задания на опережающее обучение).
Геномные (полиплоидия) – у животных и человека встречается очень редко. (так как этот тип мутаций нарушает функционирование хромосомного механизма определения пола; если количество половых хромосом превышает две, у организмов отмечаются нарушения в развитии и они или погибают, или остаются неспособны к размножению). У растений таких ограничений нет, так как у них нет половых хромосом.
ТЕМА: Одомашнивание как начальный этап селекции.
Одомашнивание как начальный этап селекции.
Одомашнивание как первый этап селекции. Все современные домашние животные и культурные растения произошли от диких предков. Процесс превращения диких животных и растений в культурные формы называют одомашниванием. Главным фактором одомашнивания служит искусственный отбор организмов, отвечающих требованиям человека.
Одомашнивание как начальный этап селекции
1. Селекция как вид научной деятельности возникла:
а) во второй половине XX в. благодаря использованию искусственного мутагенеза в селекции;
б) в первой половине XX в. благодаря открытию Н.И. Вавиловым центров происхождения культурных растений;
в) в середине XIX в., благодаря созданию эволюционной теории Ч.Дарвином;
г) в конце XIX в., благодаря работам И.В. Мичурина.
(Ответ: в.)
2. Причиной окультуривания растений и одомашнивания животных является:
а) переход человека от охоты на диких животных и сбора дикорастущих растений к разведению животных и выращиванию растений в искусственно созданных условиях;
б) возрастание потребностей человека в пище и одежде;
в) постоянное улучшение человеком свойств культивируемых растений и животных;
г) зависимость благополучия человека от ограниченного набора видов растений и животных.
(Ответ: г.)
3. Одомашнивание является начальным этапом:
а) селекции растений, животных;
б) селекции растений;
в) гибридизации;
г) селекции животных.
(Ответ: а.)
4. Центрами происхождения культурных растений Н.И. Вавилов считал регионы мира, где:
а) имеются наиболее благоприятные условия;
б) найдено большое количество ископаемых остатков растений;
в) наблюдается наибольшее число сортов и разновидностей какого-либо растения;
г) отсутствуют конкурирующие виды.
(Ответ: в.)
5. Центрами происхождения культурных растений:
а) хлопчатник, арбуз, кофе;
б) капуста, брюква, люпин, оливковое дерево;
в) пшеница, рожь, овес, чечевица;
являются:
1. Переднеазиатский;
2. Средиземноморский.
3. Африканский.
(Ответ:1–в, 2–б, 3–а.)
6. Центрами одомашнивания животных:
а) индейка, лама, тур;
б) свинья, собака, куры;
в) овца, коза.
считаются центры:
1. Индонезийско-Индокитайский;
2. Южно-Среднеамериканский;
3. Передне-Малоазиатский.
(Ответ: 1–б, 2–а, 3–в.)
7. По выражению Н.И. Вавилова, селекция «представляет собой эволюцию, направляемую волей человека». Это означает, что селекция:
а) осуществляется человеком;
б) представляет длительный процесс;
в) приводит к образованию новых пород животных и сортов растений;
г) приводит к образованию новых пород животных и сортов растений, удовлетворяющих потребностям человека.
(Ответ: г.)
9. Установлено, что домашние животные:
1) лошадь;
2) корова;
3) овца;
произошли от предков:
а) тарпана;
б) тура;
в) лошади Пржевальского;
г) муфлона.
(Ответ: 1–а, 2–б, 3–г.)