ВТОРНИК, 19.04.22 г. 405, 308, 405
ИНСТРУКЦИЯ ДЛЯ ТЕХ, КТО НЕ МОЖЕТ НАЙТИ СВОЮ ГРУППУ:
СПРАВА ЕСТЬ АРХИВ. В АРХИВЕ ПО-ПОРЯДКУ РАСПОЛОЖЕНЫ ДНИ НЕДЕЛИ. ТАМ ЖЕ ВИДНЫ ДАТЫ И НОМЕРА ГРУПП. ВЫБИРАЕТЕ ДЕНЬ СО СВОЕЙ ГРУППОЙ, И ОН ОТКРОЕТСЯ. УРОКИ ВЫЛОЖЕНЫ ПО РАСПИСАНИЮ. НА ОДНОЙ СТРАНИЦЕ ВЫЛОЖЕН ОДИН ДЕНЬ . ВНИМАНИЕ!!! На выполнение задания отводится 1 неделя. Моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
Критерии оценивания: Для получения отличной оценки обучающийся должен:- соблюдать отведенное время; разборчиво и правильно выполнить работу. Если работа будет прислана после указанного срока , оценка будет снижаться.
ГРУППА 405 ХИМИЯ 44,45
ТЕМА: Гидролиз солей. Гидролиз солей различного типа.
Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита. Если рассматривать соль как продукт нейтрализации основания кислотой, то можно разделить соли на четыре группы, для каждой из которых гидролиз будет протекать по-своему. 1). Гидролиз не возможен Соль, образованная сильным основанием и сильной кислотой (KBr, NaCl, NaNO3), гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется. рН таких растворов = 7. Реакция среды остается нейтральной. 2). Гидролиз по катиону (в реакцию с водой вступает только катион) В соли, образованной слабым основанием и сильной кислотой (FeCl2, NH4Cl, Al2(SO4)3, MgSO4) гидролизу подвергается катион: FeCl2 + HOH <=>Fe(OH)Cl + HCl В результате гидролиза образуется слабый электролит, ион H+ и другие ионы. рН раствора < 7 (раствор приобретает кислую реакцию). 3). Гидролиз по аниону (в реакцию с водой вступает только анион) Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3, CH3COONa) подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид-ион ОН- и другие ионы. K2SiO3 + НОH <=>KHSiO3 + KОН рН таких растворов > 7 (раствор приобретает щелочную реакцию). 4). Совместный гидролиз (в реакцию с водой вступает и катион и анион) Соль, образованная слабым основанием и слабой кислотой (СН3СООNН4, (NН4)2СО3, Al2S3), гидролизуется и по катиону, и по аниону. В результате образуются малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания. Мерой силы кислоты и основания является константа диссоциации соответствующего реактива. Реакция среды этих растворов может быть нейтральной, слабокислой или слабощелочной: Al2S3 + 6H2O =>2Al(OH)3↓+ 3H2S↑ Гидролиз - процесс обратимый. Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота Алгоритм составления уравнений гидролиза солей
Практическое применение. На практике с гидролизом учителю приходится сталкиваться, например при приготовлении растворов гидролизующихся солей (ацетат свинца, например). Обычная “методика”: в колбу наливается вода, засыпается соль, взбалтывается. Остается белый осадок. Добавляем еще воды, взбалтываем, осадок не исчезает. Добавляем из чайника горячей воды – осадка кажется еще больше… А причина в том, что одновременно с растворением идет гидролиз соли, и белый осадок, который мы видим это уже продукты гидролиза – малорастворимые основные соли. Все наши дальнейшие действия, разбавление, нагревание, только усиливают степень гидролиза. Как же подавить гидролиз? Не нагревать, не готовить слишком разбавленных растворов, и поскольку главным образом мешает гидролиз по катиону – добавить кислоты. Лучше соответствующей, то есть уксусной. В других случаях степень гидролиза желательно увеличить, и чтобы сделать щелочной моющий раствор бельевой соды более активным, мы его нагреваем – степень гидролиза карбоната натрия при этом возрастает. Важную роль играет гидролиз в процессе обезжелезивания воды методом аэрации. При насыщении воды кислородом, содержащийся в ней гидрокарбонат железа(II) окисляется до соли железа(III), значительно сильнее подвергающегося гидролизу. В результате происходит полный гидролиз и железо отделяется в виде осадка гидроксида железа(III). На этом же основано применение солей алюминия в качестве коагулянтов в процессах очистки воды. Добавляемые в воду соли алюминия в присутствии гидрокарбонат-ионов полностью гидролизуются и объемистый гидроксид алюминия коагулирует, увлекая с собой в осадок различные примеси. Видео - Эксперимент "Гидролиз солей" Видео - Эксперимент "Гидролиз солей, образованных сильным основанием и слабой кислотой" Видео - Эксперимент "Гидролиз солей, образованных слабым основанием и сильной кислотой" Видео - Эксперимент "Гидролиз солей, образованных слабым основанием и слабой кислотой" Видео - Эксперимент "Усиление гидролиза солей при нагревании" ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ №1. Запишите уравнения гидролиза солей и определите среду водных растворов (рН) и тип гидролиза: №2. Составьте уравнения гидролиза солей, определите тип гидролиза и среду раствора: №3. Составьте уравнения гидролиза, определите тип гидролиза и среду водного раствора соли для следующих веществ: Известны следующие типы химических реакций: реакции соединения, реакции разложения, реакции замещения и реакции обмена. А) 4Al + 3O2 = 2Al2O3 -р.соединения Б) 2H2O= 2H2+ O2 -р. разложения В) ZnO + 2 HCl = ZnCl2 + H2O -р.обмена Г) СаСO3 = CaO + CO2 р.соединения Д)) Zn + 2HCl = ZnCl2 + H2 р.замещени Е) Na2O+ CO2=Nа2СO3 р. соединения ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ Пример 1. Введите формулу недостающего продукта реакции. CH3COOH + Ca(OH)2 → … + H2O. Решение Мы видим, что первое вещество в этой реакции – это уксусная кислота, а второе – гидроксид кальция. Вспоминаем, что реакция между кислотой и основанием – это реакция нейтрализации. Продуктами подобных реакций являются соль и вода. Вода уже записана в правой части уравнения, остается вписать туда формулу соль. Это должна быть кальциевая соль уксусной кислоты – ацетат кальция. Ацетат-ион одновалентен, а ион кальция – двухвалентен, следовательно, на каждый ион кальция приходится два ацетат-иона. Его формула (CH3COO)2Ca. Записываем формулу на место пропуска. |
ТЕМА: Реакции соединения, разложения, замещения, обмена. Реакция замещения меди железом в растворе медного купороса.
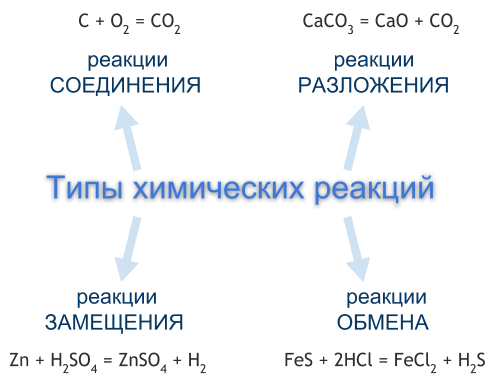
Типы химических реакций
В природе существует огромное множество различных химических реакций. Для их упорядочивания и систематизации придумано несколько способов их классификации, то есть разделения на различные типы.
Чаще всего химические реакции классифицируют по числу и составу реагентов и продуктов реакции. По этой классификации выделяют четыре типа химических реакций — это реакции соединения, разложения, замещения, обмена. Однако существуют химические реакции, которые нельзя отнести ни к одному из перечисленных типов.
РЕАКЦИИ СОЕДИНЕНИЯ
Реакция соединения — это реакция, реагентами которой являются два или несколько простых или сложных веществ, а продуктом — одно сложное вещество.
Примеры реакций соединения
Образование оксидов из простых веществ:
C + O2 = CO2, 2Mg + O2 = 2MgO
Взаимодействие металла с неметаллом и получение соли:
2Fe + 3Cl2 = 2FeCl3
Взаимодействие оксида с водой:
CaO + H2O = Ca(OH)2
РЕАКЦИИ РАЗЛОЖЕНИЯ
Реакция разложения — это реакция, реагентом которой является одно сложное вещество, а продуктом — два или несколько простых или сложных веществ. Чаще всего реакции разложения протекают при нагревании.
Примеры реакций разложения
Разложение мела при нагревании:
CaCO3 = CaO + CO2
Разложение воды под действием электрического тока:
2H2O = 2H2 + O2
Разложение оксида ртути при нагревании:
2HgO = 2Hg + O2
РЕАКЦИИ ЗАМЕЩЕНИЯ
Реакция замещения — это реакция, реагентами которой являются простое и сложное вещества, а продуктами — также простое и сложное вещества, но атомы одного из элементов в сложном веществе заменены на атомы простого реагента.
Примеры реакций замещения
Замещение водорода в кислотах:
Zn + H2SO4 = ZnSO4 + H2
Вытеснение металла из соли:
Fe + CuSO4 = FeSO4 + Cu
Образование щелочи:
2Na + 2H2O = 2NaOH + H2
РЕАКЦИИ ОБМЕНА
Реакция обмена — это реакция, реагентами и продуктами которой являются по два сложных вещества, в процессе реакции реагенты обмениваются между собой своими составными частями, в результате чего образуются другие сложные вещества.
Примеры реакций обмена
Взаимодействие соли с кислотой:
FeS + 2HCl = FeCl2 + H2S
Взаимодействие двух солей:
2K3PO4 + 3MgSO4 = Mg3(PO4)2 + 3K2SO4
ГРУППА 405 БИОЛОГИЯ,44,45
ТЕМА: Появление человека разумного.
Ближайшие «родственники» человека среди животных.
Вспомните, какие связи существуют между живыми организмами? (Беседа с обучающимися)
(Пищевые связи: растения -травоядные животные-хищники-бактерии.
Топические связи – одни организмы создают условия для проживания других организмов)
Все взаимосвязи объединяют живые организмы и окружающую среду в экологические системы.
Экология (от греч. “ ойкос” – жилище, убежище, “ логос”– наука) – это наука о взаимоотношениях живых организмов и среды их обитания. Экология – биологическая наука, изучающая организацию и функционирование надорганизменных систем различных уровней: популяций, видов, биоценозов, экосистем, биогеоценозов и биосферы. Термин впервые ввёл немецкий ученый Э. Геккель (1866 г.) в работе “ Общая морфология организма”.
Предметом экологии являются отдельные особи, популяции, сообщества, экосистемы.
Задачи экологии состоят в:
- изучении влияния окружающей среды на живые организмы,
- выявление проблем взаимодействия человека и природы,
-предложение рациональных путей выхода из экологического кризиса.
2. Среда обитания.
Среда обитания – это та часть природы, которая окружает организм и с которой он непосредственно взаимодействует. Составные части среды и свойства среды изменчивы, поэтому любой организм вынужден постоянно приспосабливаться.
Какие среды обитания вам известны?(Беседа с обучающимися)
1.Наземно-воздушная, ее обитатели называются аэробионты (птицы, большинство млекопитающих, пресмыкающиеся, насекомые…)
Характеристики среды: – концентрация кислорода – большая, количество воды – низкое, колебания температуры – большие, освещенность хорошая, плотность – низкая.
Водная, ее обитатели – гидробионты (рыбы, моллюски…)
Характеристики среды: – концентрация кислорода – малая, количество воды – большое, колебания температуры – невысокие, освещенность различная, плотность – высокая.
Почвенная, ее обитатели – эдафобионты (кроты, дождевой червь, личинки некоторых жуков…)
Характеристики среды: – концентрация кислорода – небольшая, количество воды – небольшое, колебания температуры – высокие в поверхностных слоях, освещенность нулевая, плотность – высокая.
Организменная, ее обитатели – эндобионты (паразитические черви, простейшие), также внешние паразиты (вши, пухоеды, блохи)
Характеристики среды для эндобионтов – кислород отсутствует, количество воды – большое, колебания температуры – отсутствуют, освещенность отсутствует, плотность – высокая
3. Экологические факторы
Экологические факторы – это свойства и элементы среды, которые воздействуют на организмы и заставляют их приспосабливаться (например: смена сезонов, конкуренты по пище). Одни факторы могут способствовать, другие – препятствовать выживанию.
Совокупность всех факторов, которая требуется для существования вида и роль вида в экосистеме, называют экологической нишей.
Классификация факторов (См. схему ниже) Экологические факторы многообразны. Существует несколько квалификаций, в зависимости от подхода. Это по влиянию на жизнедеятельность организмов, по степени изменчивости во времени, по длительности действия.
Рассмотрим классификацию экологических факторов, основанную на их происхождении.

Антропогенные – факторы, сформированные человеком и последствием его деятельности.
А. Прямое уничтожение человеком видов. (Например: истребление бизонов в Северной Америке в1830 г. – 40 млн., в настоящее время –30 тыс. Скорость вымирания в 10 раз выше ,чем 200 лет назад).
Б. Переселение видов. (Например: в Австралию овцы ввезены преднамеренно, а кролики –непреднамеренно; рыжий таракан в Русско-Прусскую войну в ранцах солдат непреднамеренно перемещен в Россию).
Демонстрируются слайды с изображением городских пейзажев (трубы заводов, скопление автомобилей в пробке, свалки мусора).
В. Урбанизация природы. (Воздействие развивающейся промышленности и укрупнение городов ведет к отторжению природы, скоплению большого числа людей, массовый выезд в пригородную зону – рекреационный пресс: вспугивание птиц, исчезновение разнотравья, увеличение численности бродячих кошек и собак, появление гибридов волка и собаки, выросшее количество полевых воробьев и голубей – переносчиков гриппа, постельных клещей.)
Г. Воздействие химических веществ. (Более 120 тыс. химических веществ применяет человек, только 10% исследовано на характер воздействия, например: дуст широко применялся в сельском хозяйстве в 70-е годы был обнаружен в мясе пингвинов в Антарктиде, снят с производства из-за вредного влияния на нервную систему).
Д. Воздействие проникающей радиации (мало изучено).
Некоторые факторы относительно постоянные – сила земного тяготения, солнечная радиация, солевой состав океана, другие – изменчивы – температура, влажность, сила ветра, количество осадков (особенно в наземно-воздушной среде)
Ресурсы среды – элементы среды, из которых живой организм черпает энергию и получает необходимые вещества и пространство для жизни:
-пищевые ресурсы – вода, минеральные и органические вещества;
- энергетические – энергия химических связей пищи, энергия солнца,
- территориальные – гнездовые участки птиц, охотничьи территории зверей и др.
Толерантность организмов. Биологический оптимум фактора
Толерантность (греч. «толерация» - терпение) – способность организма выдерживать изменения условий среды. График, показывающий изменение интенсивности жизнедеятельности от разной степени фактора, называется кривой толерантности.

Биологическим оптимумом фактора называется то количество фактора, при котором особи вида активно размножаются и осваивают среду. Зона пессимума – такое количество фактора, когда, особи вида испытывают стресс, т.е. выживают. Точка минимума и точка максимума – максимально или минимально переносимые значения фактора, за пределами которых жизнь вида невозможна. Предел выносливости между критическими точками - экологическая валентность вида.

Рассмотрев кривую толерантности, можно вывести следующие закономерности:
Каждый фактор имеет лишь определенные пределы положительного влияния на организм. Недостаточное или избыточное количество фактора угнетает ж/д особи.
Стойкость организма определяется тем фактором из всей совокупности, который имеется в минимальном значении для данного организма. Ограничивающим называется тот фактор, значение которого приближается к минимальному или максимальному значению. (Почему в летнее время в мелких водоемах гибнет рыба? (недостаточно кислорода)
Факторы среды на организм воздействуют совместно, усиливая или ослабляя друг друга ( В каком случае, при ветреной или безветренной погоде, при -5 градусах очень холодно?)
На разные функции организма факторы воздействуют по-разному (у холоднокровных температура 40-45 градусов С повышают обмен веществ, но они впадают в тепловое оцепенение).
К каждому фактору организмы приспосабливаются относительно независимым путем.
Организм, способный выжить при широком колебании условий среды, называется эврибионт. (Приставка «эври» означает – широкий предел.)
Организм, требующий строго определенных неизменных условий среды, называется стенобионтом («стено» - узкий предел изменчивости признак).
Например, окунь – эвритермный, форель - стенотермный вид. Но в течение жизни у организма толерантность может изменяться. Взрослые особи многих видов легче переносят колебания условий, чем их детеныши.
ТЕМПЕРАТУРА как фактор среды и приспособления к ее изменению
Большинство видов растений и животных приспособлены к довольно узкому диапазону температур. Колебание температуры в воде обычно меньше, чем на суше, поэтому пределы устойчивости к температуре у водных организмов хуже, чем у наземных.
От температуры зависит интенсивность обмена веществ. В основном организмы живут при температуре от 0 до +50 на поверхности песка в пустыни и до – 70 в некоторых областях Восточной Сибири. Средний диапазон температур находится в пределах от +50 до –50 в наземных местообитаниях и от +2 до +27 – в Мировом океане. (Например, микроорганизмы выдерживают охлаждение до –200, отдельные виды бактерий и водорослей могут жить и размножаться в горячих источниках при температуре + 80, +88.)
Различают животные организмы:
- с постоянной температурой тела (теплокровные);
- с непостоянной температурой тела (хладнокровные).
СВЕТ как фактор среды и приспособления к нему
Свет обеспечивает все жизненные процессы, протекающие на Земле. Для организмов важна длина волны воспринимаемого излучения, его продолжительность и интенсивность воздействия. Например, у растений уменьшение длины светового дня и интенсивность освещения приводит к осеннему листопаду.

ВЛАЖНОСТЬ как фактор среды и приспособления к ней
Вода – это необходимый компонент клетки, поэтому ее количество в тех или иных местах обитания является ограничивающим фактором для растений и животных и определяет характер флоры и фауны данной местности.
Избыток влаги в почве приводит к заболачиванию почвы и появлению болотной растительности. В зависимости от влажности почвы (количество осадков) видовой состав растительности меняется. Широколиственные леса сменяются мелколиственными, затем лесостепной растительностью. Далее низкотравье, и при 250 мл в год – пустыня.
Осадки в течение года могут выпадать не равномерно, живым организмам приходится переносить длительные засухи. Например, растения и животные саванн, где интенсивность растительного покрова, а так же и интенсивное питание копытных животных зависит от сезона дождей.
У растений и животных появились приспособления к разной влажности. Например, у степных и пустынных растений – развита мощная корневая система, утолщена кутикула листа, листовая пластинка уменьшена или превращена в иголки и колючки. У саксаула фотосинтез идет зеленой частью стебля. Рост в период засухи у растений прекращается. Кактусы запасают влагу в расширенной части стебля, иголки вместо листьев уменьшают испарение.
У животных тоже появились приспособленности, позволяющих переносить недостаток влаги:
- мелкие животные – грызуны, змеи, черепахи, членистоногие – добывают влагу из пищи.
- источником воды может стать жироподобное вещество например у верблюда.
- в жаркое время некоторые животные – грызуны, черепахи впадают в спячку, продолжавшуюся несколько месяцев.
- растения – эфемеры к началу лета, после кратковременного цветения, могут сбрасывать листья, отмирать наземные части и так переживать период засухи. При этом до следующего сезона сохраняются луковицы, корневища.
Заключение. Экология должна служить научной базой любых мероприятий по использованию и охране природных ресурсов, по сохранению среды в благоприятном состоянии для обитания человека. Достижения экологии позволяют перестроить систему борьбы с вредителями сельского и лесного хозяйства, отходя от попыток их полного истребления с помощью пестицидов широкого спектра действия, наносящего большой вред всему биогеоценозу, к действительной регуляции численности определённых видов биологическими и агротехническими методами и только ограниченно.
“Нельзя допустить, чтобы люди направляли на своё собственное уничтожение те силы природы, которые они сумели открыть и покорить”. (Ф. Жолио-Кюри)