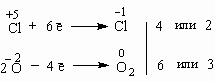28.05.21 г. 303, 306, 208
ГРУППА 303 БИОЛОГИЯ
ТЕМА: Бионика как одно из направлений биологии и кибернетики.
Бионика — одно из направлений биологии и кибернетики, изучающее особенности строения и жизнедеятельности организмов в целях создания более совершенных технических систем или устройств, характеристики которых приближаются к характеристикам живых систем.
Датой рождения бионики считается 13 сентября 1960 г.
В этот день открылся первый международный симпозиум на тему «Живые прототипы искусственных систем — ключ к новой технике».
Но и до официального признания бионика как таковая была известна. Изобретатели уже давно обращали внимание на различные явления природы, закономерности ее развития и находили правильные решения технических задач.
В процессе последовательного, беспощадного естественного отбора природа тысячелетиями совершенствовала свои системы, оттачивала отдельные органы животных.
В жестокой борьбе за существование выживали и давали потомство только самые совершенные формы организмов. В итоге столь продолжительной эволюции природа создала на Земле гигантскую сокровищницу, в которой не счесть изумительных образцов «живых инженерных систем», функционирующих очень точно, надежно и экономично, отличающихся поразительной целесообразностью и гармоничностью действий, способностью реагировать на тончайшие изменения многочисленных факторов внешней среды, запоминать и учитывать эти изменения, отвечать на них многообразными приспособительными реакциями. У природы для этого было много времени, а человек, создающий современные машины, должен решать технические задачи за короткий срок,за десятилетия, даже годы.
Многие «изобретения» природы еще в глубокой древности помогали решать ряд технических задач. Так, арабские врачи уже много сотен лет назад, проводя глазные хирургические операции, получили представление о преломлении световых лучей при переходе из одной прозрачной среды в другую. Изучение хрусталика глаза натолкнуло врачей древности на мысль об использовании линз,изготовленных из хрусталя или стекла, для увеличения изображения.
В области физики изучение многих основных принципов учения об электричестве было начато с исследования так называемого животного электричества. В частности, знаменитые опыты итальянского физиолога XVIII в. Луиджи Гальвани с лапкой лягушки привели в конечном итоге к созданию гальванических элементов —химических источников электрической энергии.
Луиджи Гальвани (1737-1798)
Еще в годы Первой мировой войны британский флот получилна вооружение гидрофоны — приборы для обнаружения германских подводных лодок по шуму их винтов в воде. Конструкция оказалась неудачной. Во время хода судна гидрофоны не воспринимали других звуков, так как все заглушалось шумом машины собственного корабля. На помощь пришли зоологи. Они напомнили,что тюлени прекрасно слышат в воде при любой скорости, и предложили придать гидрофонам форму ушной раковины тюленя. С тех пор англичане стали более успешно бороться с германскими подводными лодками.
Стремление ученых понять,в чем природа совершеннее, умнее, экономнее современной техники, их попытки найти и систематизировать новые методы для коренного усовершенствования существующих и создания принципиально новых машин, приборов, строительных конструкций и технологических процессов и породили новое научное направление, получившее название бионика.
Формы живого в природе и их промышленные аналоги.
Одной из основных задач, решаемых бионикой, является исследование принципов, позволяющих достичь высокой надежности биологических систем, моделирование компенсаторных функций организмов и их способностей к адаптации.
Примером высокой надежности приспособительных механизмов у некоторых организмов являются особые оболочки для защиты от действия окружающей среды и возможного нападения.
ГРУППА 306
ТЕМА: Окислительно-восстановительные реакции. Степень окисления. Окислитель и восстановление. Восстановитель и окисление. Метод электронного баланса для составления уравнений окислительно-восстановительных реакций.
Уравнения окислительно-восстановительных реакций.
Многие химические реакции уравниваются простым подбором коэффициентов. Но иногда возникают сложности: количество атомов какого-нибудь элемента в левой и правой частях уравнения никак не удается сделать одинаковым без того, чтобы не нарушить "равновесия" между атомами других элементов.
Чаще всего такие сложности возникают в уравнениях окислительно-восстановительных реакций. Для их уравнивания используют несколько способов, из которых мы пока рассмотрим один – метод электронного баланса.
Напишем уравнение реакции между алюминием и кислородом:
Al + O2 = Al2O3
Пусть вас не вводит в заблуждение простота этого уравнения. Наша задача – разобраться в методе, который в будущем позволит вам уравнивать гораздо более сложные реакции.
Итак, в чем заключается метод электронного баланса? Баланс – это равенство. Поэтому следует сделать одинаковым количество электронов, которые отдает один элемент и принимает другой элемент в данной реакции. Первоначально это количество выглядит разным, что видно из разных степеней окисления алюминия и кислорода:
0 | 0 | +3 –2 | ||
Al | + | O2 | = | Al2O3 |
Алюминий отдает электроны (приобретает положительную степень окисления), а кислород – принимает электроны (приобретает отрицательную степень окисления). Чтобы получить степень окисления +3, атом алюминия должен отдать 3 электрона. Молекула кислорода, чтобы превратиться в кислородные атомы со степенью окисления -2, должна принять 4 электрона:
`
Чтобы количество отданных и принятых электронов выровнялось, первое уравнение надо умножить на 4, а второе – на 3. Для этого достаточно переместить числа отданных и принятых электронов против верхней и нижней строчки так, как показано на схеме вверху.
Если теперь в уравнении перед восстановителем (Al) мы поставим найденный нами коэффициент 4, а перед окислителем (O2) – найденный нами коэффициент 3, то количество отданных и принятых электронов выравнивается и становится равным 12. Электронный баланс достигнут. Видно, что перед продуктом реакции Al2O3 необходим коэффициент 2. Теперь уравнение окислительно-восстановительной реакции уравнено:
4Al + 3O2 = 2Al2O3
Все преимущества метода электронного баланса проявляются в более сложных случаях, чем окисление алюминия кислородом. Например, известная всем "марганцовка" – марганцевокислый калий KMnO4 – является сильным окислителем за счет атома Mn в степени окисления +7. Даже анион хлора Cl– отдает ему электрон, превращаясь в атом хлора. Это иногда используют для получения газообразного хлора в лаборатории:
+7 | –1 | 0 | +2 | |||||||||
KMnO4 | + | KCl | + | H2SO4 | = | Cl2 | + | MnSO4 | + | K2SO4 | + | H2O |
Составим схему электронного баланса:
Двойка и пятерка – главные коэффициенты уравнения, благодаря которым удается легко подобрать все другие коэффициенты. Перед Cl2 следует поставить коэффициент 5 (или 2·5 = 10 перед KСl), а перед KMnO4 – коэффициент 2. Все остальные коэффициенты привязывают к этим двум коэффициентам. Это гораздо легче, чем действовать простым перебором чисел.
2KMnO4 + 10KCl + 8H2SO4 = 5Cl2 + 2MnSO4 + 6K2SO4 + 8H2O
Чтобы уравнять количество атомов К (12 атомов слева), надо перед K2SO4 в правой части уравнения поставить коэффициент 6. Наконец, чтобы уравнять кислород и водород, достаточно перед H2SO4 и H2O поставить коэффициент 8. Мы получили уравнение в окончательном виде.
Метод электронного баланса, как мы видим, не исключает и обыкновенного подбора коэффициентов в уравнениях окислительно-восстановительных реакций, но может заметно облегчить такой подбор.
** Окислительно-восстановительные реакции играют огромную роль в природе и технике. Без этих реакций невозможна жизнь, потому что дыхание, обмен веществ, синтез растениями клетчатки из углекислого газа и воды – все это окислительно-восстановительные процессы.
В технике с помощью реакций этого типа получают такие важные вещества как аммиак (NH3), серную (H2SO4)и соляную (HCl) кислоты и многие другие продукты. Вся металлургия основана на восстановлении металлов из их соединений – руд. Большинство химических реакций – окислительно-восстановительные. Приведем важнейшие определения, связанные с окислительно-восстановительными реакциями.
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Окислителями называются вещества, присоединяющие электроны. Во время реакции они восстанавливаются.
Восстановителями называются вещества, отдающие электроны. Во время реакции они окисляются.
Поскольку окислитель присоединяет электроны, степень окисления его атомов может только уменьшаться. Наоборот, восстановитель теряет электроны и степень окисления его атомов должна повышаться.
Окисление всегда сопровождается восстановлением и, наоборот, восстановление всегда связано с окислением.
Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
Если каждый атом окислителя может принять иное количество электронов, чем отдает атом восстановителя, то необходимо так подобрать количество атомов того и другого реагента, чтобы количество отдаваемых и принимаемых электронов стало одинаковым. Это требование положено в основу метода электронного баланса, с помощью которого уравнивают уравнения окислительно-восстановительных реакций.
Различают три основных типа окислительно-восстановительных реакций:
1) Реакции МЕЖМОЛЕКУЛЯРНОГО окисления-восстановления (когда окислитель и восстановитель – разные вещества);
2) Реакции ДИСПРОПОРЦИОНИРОВАНИЯ (когда окислителем и восстановителем может служить одно и то же вещество);
3) Реакции ВНУТРИМОЛЕКУЛЯРНОГО окисления-восстановления (когда одна часть молекулы выступает в роли окислителя, а другая – в роли восстановителя).
Рассмотрим примеры реакций трех типов.
1. Реакциями межмолекулярного окисления-восстановления являются все уже рассмотренные нами в этом параграфе реакции.
Рассмотрим несколько более сложный случай, когда не весь окислитель может быть израсходован в реакции, поскольку часть его участвует в обычной – не окислительно-восстановительной реакции обмена:
0 | +5 | +2 | +2 | |||||
Cu | + | HNO3 | = | Cu(NO3)2 | + | NO | + | H2O |
Часть частиц NO3- участвует в реакции в качестве окислителя, давая оксид азота NO, а часть ионов NO3- в неизменном виде переходит в соединение меди Cu(NO3)2. Составим электронный баланс:
Поставим найденный для меди коэффициент 3 перед Cu и Cu(NO3)2. А вот коэффициент 2 следует поставить только перед NO, потому что весь имеющийся в нем азот участвовал в окислительно-восстановительной реакции. Было бы ошибкой поставить коэффициент 2 перед HNO3, потому что это вещество включает в себя и те атомы азота, которые не участвуют в окислении-восстановлении и входят в состав продукта Cu(NO3)2 (частицы NO3- здесь иногда называют “ионом-наблюдателем”).
Остальные коэффициенты подбираются без труда по уже найденным:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
2. Реакции диспропорционирования происходят тогда, когда молекулы одного и того же вещества способны окислять и восстанавливать друг друга. Это становится возможным, если вещество содержит в своем составе атомы какого-либо элемента в ПРОМЕЖУТОЧНОЙ степени окисления. Следовательно, степень окисления способна как понижаться, так и повышаться. Например:
+3 | +5 | +2 | ||||
HNO2 | = | HNO3 | + | NO | + | H2O |
Эту реакцию можно представить как реакцию между HNO2 и HNO2 как окислителем и восстановителем и применить метод электронного баланса:
+3 | +3 | +5 | +2 | |||||
HNO2 | + | HNO2 | = | HNO3 | + | NO | + | H2O |
Получаем уравнение:
2HNO2 + 1HNO2 = 1HNO3 + 2NO + H2O
Или, складывая вместе моли HNO2:
3HNO2 = HNO3 + 2NO + H2O
3. Реакции внутримолекулярного окисления-восстановления происходят тогда, когда в молекуле соседствуют атомы-окислители и атомы-восстановители. Рассмотрим разложение бертолетовой соли KClO3 при нагревании:
+5 | –1 | 0 | ||
KClO3 | = | KCl | + | O2 |
Это уравнение также подчиняется требованию электронного баланса:
Здесь возникает сложность – какой из двух найденных коэффициентов поставить перед KClO3 – ведь эта молекула содержит и окислитель и восстановитель? В таких случаях найденные коэффициенты ставятся перед продуктами:
KClO3 = 2KCl + 3O2
Теперь ясно, что перед KClO3 надо поставить коэффициент 2.
2KClO3 = 2KCl + 3O2
Внутримолекулярная реакция разложения бертолетовой соли при нагревании используется при получении кислорода в лаборатории.
Мы рассмотрели важнейшие типы окислительно-восстановительных реакций и метод электронного баланса, но пока не касались вопроса составления уравнений таких реакций. Распространенное заблуждение заключается в том, что вы можете сразу предсказать продукт (или продукты) окислительно-восстановительной реакции. Это не так. Лишь по мере накопления опыта, особенно в лаборатории, вы сможете делать все больше и больше правильных предсказаний. А пока следует научиться уравнивать реакции, реагенты и продукты которых заранее известны.
Горение алюминия на воздухе.
Алюминий - активный металл, но из-за очень прочной оксидной пленки на его поверхности не реагирует при обычных условиях с водой и не окисляется. Однако если алюминий перевести в раздробленное состояние - алюминиевую пыль, то он легко сгорает на воздухе. Поместим в пробирку немного алюминиевой пыли и закроем ее пробкой с двумя трубками, одна из которых доходит почти до дна, а другая заканчивается недалеко от пробки. По длинной трубке подадим в пробирку ток воздуха. Струю воздуха, выходящую из короткой трубки и содержащую частички алюминия, направим в пламя горелки. Попадая в пламя, алюминий сгорает яркими вспышками.
4Al + 3O2 = 2Al2O3
Оборудование: штатив, пробирка с боковым отростком, газоотводная трубка, горелка, штапель.
Техника безопасности. Соблюдать правила пожарной безопасности и правила работы с нагревательными приборами. Не направлять пламя в сторону находящихся рядом людей.
ГРУППА 208
ТЕМА: Виды и механизмы образования химической связи. Характеристики химической связи.
Виды, характеристики и механизмы образования химической связи
Причины образования химической связи
Известно, что электронные оболочки, содержащие восемь внешних электронов, два из которых находятся на s-орбитали, а шесть — на р-орбиталях, обладают повышенной устойчивостью. Они соответствуют инертным газам: неону, аргону, криптону, ксенону, радону (найдите их в периодической таблице). Еще более устойчив атом гелия, содержащий всего два электрона. Атомы всех других элементов стремятся приблизить свою электронную конфигурацию к электронной конфигурации ближайшего инертного газа. Это возможно сделать двумя путями — отдавая или присоединяя электроны внешнего уровня.
- Атому натрия, имеющему всего один неспаренный электрон, выгоднее его отдать, тем самым атом получает заряд (становится ионом) и приобретает электронную конфигурацию инертного газа неона.
- Атому хлора до конфигурации ближайшего инертного газа недостает всего одного электрона, поэтому он стремится приобрести электрон.
Каждый элемент в большей или меньшей степени обладает способностью притягивать электроны, которая численно характеризуется значением электроотрицательности. Соответственно, чем больше электроотрицательность элемента, тем сильнее он притягивает электроны и тем сильнее выражены его окислительные свойства.
Стремление атомов приобрести устойчивую электронную оболочку объясняет причину образования молекул.
Химическая связь — это взаимодействие атомов, обусловливающее устойчивость химической молекулы или кристалла как целого.
ТИПЫ химической связи
Различают 4 основных типа химической связи:

Рассмотрим взаимодействие двух атомов с одинаковыми значениями электроотрицательности, например двух атомов хлора. Каждый из них имеет по семь валентных электронов. До электронной конфигурации ближайшего инертного газа им не хватает по одному электрону.

Сближение двух атомов до определенного расстояния приводит к образованию общей электронной пары, одновременно принадлежащей обоим атомам. Эта общая пара и представляет собой химическую связь. Аналогично происходит и в случае молекулы водорода. У водорода всего один неспаренный электрон, и до конфигурации ближайшего инертного газа (гелия) ему не хватает еще одного электрона. Таким образом, два атома водорода при сближении образуют одну общую электронную пару.
Связь между атомами неметаллов, возникающая при взаимодействии электронов с образованием общих электронных пар, называется ковалентной.
В случае если взаимодействующие атомы имеют равные значения электроотрицательности, общая электронная пара в равной степени принадлежит обоим атомам, то есть находится на равном расстоянии от обоих атомов. Такая ковалентная связь называется неполярной.
Ковалентная неполярная связь — химическая связь между атомами неметаллов с равными или близкими значениями электроотрицательности. При этом общая электронная пара одинаково принадлежит обоим атомам, смещения электронной плотности не наблюдается.
Ковалентная неполярная связь имеет место в простых веществах-неметаллах:
Связь, образованная элементами-неметаллами с разной электроотрицательностью, называется ковалентной полярной. При этом происходит смещение электронной плотности в сторону более электроотрицательного элемента.
Молекула, в которой разделены центры положительного и отрицательного зарядов, называется диполем. Полярная связь имеет место между атомами с различной, но не сильно различающейся электроотрицательностью, например между различными неметаллами. Примерами соединений с полярными ковалентными связями являются соединения неметаллов друг с другом, а также различные ионы, содержащие атомы неметаллов
В случае если разница электроотрицательностей элементов будет велика, произойдет не просто смещение электронной плотности, а полная передача электрона от одного атома к другому. Рассмотрим это на примере фторида натрия NaF. Как мы видели ранее, атом натрия стремится отдать один электрон, а атом фтора готов его принять. Это легко осуществляется при их взаимодействии, которое сопровождается переходом электрона.

При этом атом натрия полностью передает свой электрон атому фтору: натрий лишается электрона и становится заряженным положительно, а хлор приобретает электрон и становится заряженным отрицательно.
Атомы и группы атомов, несущие на себе заряд, называют ионами.
В образовавшейся молекуле — хлориде натрия
Ионная связь образована за счет сил электростатистического притяжения между разноименно заряженными ионами — катионами и анионами.
Существует еще один тип связи — металлическая, характерная для простых веществ — металлов. Она характеризуется притяжением частично ионизованных атомов металлов и валентных электронов, образующих единое электронное облако («электронный газ»). Валентные электроны в металлах являются делокализованными и принадлежат одновременно всем атомам металла, свободно перемещаясь по всему кристаллу. Таким образом, связь является многоцентровой. В переходных металлах металлическая связь носит частично ковалентный характер, так как дополнена перекрыванием частично заполненных электронами d-орбиталей предвнешнего слоя. Металлы образуют металлические кристаллические решетки. О ней подробно рассказывается в теме «Металлическая связь и ее характеристики».

межмолекулярные взаимодействия
Примером сильного межмолекулярного взаимодействия
 является водородная связь, образующаяся между атомом водорода одной молекулы и атомом с высокой электроотрицательностью (
является водородная связь, образующаяся между атомом водорода одной молекулы и атомом с высокой электроотрицательностью (

Другим примером межмолекулярного взаимодействия являются ван-дер-ваальсовы силы, которые возникают при поляризации молекул и образовании диполей. Они обусловливают связь между слоями атомов в слоистых кристаллах (таких как структура графита).

Характеристики химической связи
Химическая связь характеризуется длиной, энергией, направленностью и насыщаемостью (каждый атом способен образовать ограниченное число связей). Кратность связи равна числу общих электронных пар. Форма молекул определяется типом электронных облаков, участвующих в образовании связи, а также фактом наличия или отсутствия неподеленных электронных пар. Так, например, молекула
Ионная связь реализуется в соединениях типичных металлов с неметаллами и кислотными остатками, а именно в оксидах металлов (
механизмы образования химической связи
- Обменный.
Обменный механизм образования химической связи обусловлен обобществлением неспаренных электронов атомов. Подробно он был рассмотрен выше на примере образования молекулы хлора. - Донорно-акцепторный.
Донор — элемент, предоставляющий пару электронов (например, азот или бор).
Акцептор — элемент, предоставляющий свободную орбиталь для пары электронов другого атома.