ЧЕТВЕРГ, 12.11.20г.
Группа 303
Тема: Ионная связь, как связь между катионами и анионами за счет электростатического притяжения. Классификация ионов: по составу, знаку заряда, наличию гидратной оболочки
Просмотрите видео, прочитайте текст, Выполните необходимые( по вашему мнению) записи, приведите примеры ионных соединений.
Примером связи между атомами типичного металла и типичного неметалла можно назвать связь атомов в хлориде натрия (поваренная соль).
Составляющие ее элементы – натрий и хлор находятся в третьем периоде периодической системы.

Их относительные электроотрицательности соответственно равны у натрия – 1,1, у хлора – 2,8. На внешнем электронном слое у атома натрия находится один неспаренный s-электрон, у атома хлора из 7 внешних электронов один р-электрон неспаренный. За счет неспаренных электронов между атомами натрия и хлора может образоваться химическая связь. Из-за большой разницы электроотрицательности способ ее образования будет иной: за счет отдачи и присоединения электронов.
Отдав свой электрон атому хлора, атом натрия приобретает устойчивую оболочку инертного газа неона и превращается в положительно заряженную частицу – ион Na+. Атом хлора, приобретая электрон натрия, достраивает внешний электронный слой до устойчивой структуры инертного газа аргона – приобретает отрицательный заряд, превращаясь в ион Cl-.
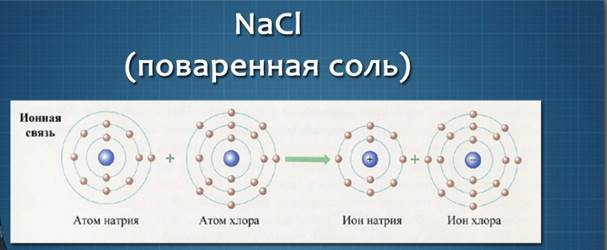
Ионы (от греческого ion – «идущий») – электрически заряженные частицы, которые образуются в результате потери или присоединения электронов атомами или группами атомов. Положительно заряженные ионы называют катионами, а отрицательно заряженные ионы – анионами.

Между ними возникают силы электростатического притяжения. За счет этих сил разноименно заряженные ионы связываются между собой, образуя ионное соединение, например, катионы натрия и хлорид-анионы образуют ионное соединение хлорид натрия.
Следует учитывать, что чем левее и ниже находится в периодической системе элемент, тем легче его атомы переходят в катионы (отдают электроны). А также, чем правее и выше расположен в периодической системе элемент, тем сильнее проявляют его атомы тенденцию переходить в анионы (принимать электроны).
При переходе нейтральных атомов в ионы размер и свойства их меняются.
Связь атомных частиц в ионном соединении объясняется не повышенной плотностью двухэлектронного облака (общей электронной пары), а силами электростатического притяжения ионов.
Химическая связь между ионами, осуществляемая силами их электростатического притяжения, называется ионной связью, а соединения, которые образовались вследствие притяжения ионов, называются ионными.
Ионы в природе существуют вокруг нас. Много разнообразных ионов в морской воде, прибрежный воздух также ионизирован и поэтому весьма полезен для здоровья. Ионы активны, результатом их взаимодействия часто бывают негативные явления: насыщение почв нитрат-анионом NО3-, разрушение мраморных изделий сульфат-анионом SO42-, кислотные дожди, приводящие к появлению в атмосфере катионов водорода, сульфат-анионов, нитрат-анионов, хлорид-анионов, загрязнение воды токсичными катионами металлов.
Важнейшими свойствами ионной связи являются ее прочность, ненасыщенность, ненаправленностъ.
Ионная связь весьма прочная.

Так, например, энергия разрыва связи К–Сl равна 426,1 кДж/моль, связи Li-F – 577,3 кДж/моль, Nа–Сl – 411,3 кДж/моль.
Ненасыщенность ее объясняется тем, что вокруг заряженной частицы – иона создается сферическое электромагнитное поле.
Притяжение противоположно заряженных ионов в сферическом поле происходит во всех направлениях, поэтому ионная связь является ненаправленной.
Мы познакомились с ковалентной (неполярной и полярной) и ионной химическими связями. Природа их одинакова – электрическая. Она связана с электрическим взаимодействием электронов и ядер атомов.
Соединения ионного и ковалентного полярного типа образованы атомами разных элементов с разной электроотрицательностью.
В этих соединение электронные пары, связывающие атомы, смещены к более электроотрицательному элементу. Наиболее полное смещение электронной пары или пар происходит в ионных соединениях. Экспериментальные исследования доказывают, что полного перехода электронов от атомов металлов к атомам неметаллов при образовании ионной связи не происходит.
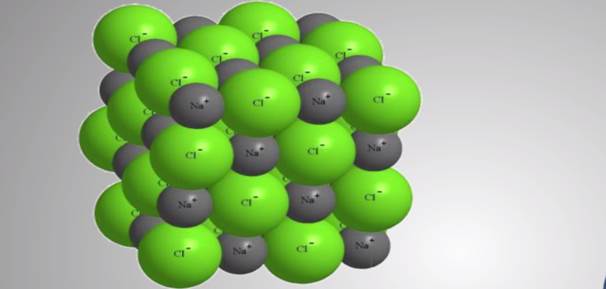
Поэтому в хлориде натрия (Na+Cl-) заряды его ионов не равны единице, а имеют в действительности заряды на ионах, равные +0,8 и –0,8. Реальные заряды на ионах называются эффективными зарядами.
Чем больше разность между значениями относительной электроотрицательности атомов, тем выше степень ионности их соединения. Связи с разностью относительной электроотрицательности больше 2,1 можно отнести к ионным.
Ионную связь можно рассматривать как предельный случай полярности ковалентной связи.
Чисто ионной связи практически не существует. Отсюда деление химической связи на типы – ковалентная и ионная также условно.