Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com Тетрадь привезете, когда перейдем на очную форму обучения.)
Моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
СПРАВА НАХОДИТСЯ АРХИВ- ТАМ СМОТРИМ ДАТУ И ГРУППЫ
РАСПИСАНИЕ ЗАНЯТИЙ НА НЕДЕЛЮ: 24.04.23г. -28.04.23г.
Пн. 24.04: -,506,-,403
Вт. 25.04:403,403,505,-
Ср. 26 .04: 506,-,-, 508
Чт. 27.04: -,-,505, 508
Пт. 28.04: -,-,-,-
ГРУППА 508 ХИМИЯ 48,49
ТЕМА:Решение задач по химическим уравнениям при условии, что одно из реагирующих веществ дано в избытке. Генетическая связь предельных одноатомных спиртов с углеводородами.
Решение задач по химическим уравнениям при условии, что одно из реагирующих веществ дано в избытке.
Повторение основных понятий.
Что такое уравнение химической реакции? (Химическим уравнением называют условную запись химической реакции посредством химических формул и математических знаков)
Что показывает уравнение химической реакции? (оно показывает, какие вещества и в каких количествах вступили и получились в результате химической реакции)
Предположим, что нам надо получить в лаборатории определенное количество какого-либо вещества. Что для этого необходимо? (1. написать уравнение реакции. 2. провести расчет. 3. взвесить и отмерить определенное количество веществ на основании данных расчета по уравнениям реакций. 4. осуществить расчет)
Чтобы провести расчет, какие понятия и физические величины нам можно и нужно использовать при решении задач ( Ar, Mr, ν, M, m)
Где мы возьмем значения относительных атомных масс? (в ПСХЭ Д.И. Менделеева)
Как мы найдем значения относительных молекулярных масс? (для нахождения относительных молекулярных масс надо суммировать значения относительных атомных масс элементов, входящих в состав молекулы вещества, с учетом числа атомов каждого элемента).
При неполном сгорании топлива и других веществ, в частности табака, образуется угарный газ СО, вызывающий кислородное голодание, блокируя гемоглобин крови. Вычислите относительную молекулярную массу этого вещества. (28)
Как рассчитаем молярную массу вещества? (M=Mr)
Как определить по уравнению реакции, в каких мольных отношениях находятся необходимые для расчета вещества? ( по коэффициентам)
Как связаны между собой понятия «количество вещества», «молярная масса» и «масса» (m=νM; ν= m/M)
Суточная потребность организма в кальции в виде СаСО3 составляет 1,2г. Вычислите количество карбоната кальция. (0,012моль)(см. приложение 1)
Какую массу воды получит ваш организм, если вы выпили ее суточную норму – 138,9 моль? (2500,2г)
Железо – важнейшая составная часть организма человека и животных. Для лечения анемии, вызванной дефицитом железа в организме, и для стимуляции работы кроветворных органов используют восстановленное железо. Вычислите массу железа, которая может быть восстановлена алюминием из 1,5 моль оксида железа (III). 2Al + Fe2О3 = Al2О3 + 2Fe (168г)
Интеллектуальная разминка
Вещество, 5%-ная спиртовая настойка которого используется в качестве дезинфицирующего и кровоостанавливающего средства. (иод)
Вещество, которое применяется внутрь при повышении кислотности желудочного сока. Наружно оно употребляется как слабая щелочь для полоскания, промывания и ингаляций при насморке. (питьевая сода)
Вещество, 0,9%-ный водный раствор которого называется изотоническим (физиологическим) и применяют для внутривенных вливаний при большой потере крови. В быту оно находит применение как пищевая добавка при приготовлении пищи. (Поваренная соль)
Меня в составе мрамора найди,
Я твердость придаю кости,
В составе извести меня найдешь,
Теперь меня ты твердо назовешь.
(кальций)
В виде таблеток это вещество применяют внутрь при пищевых отравлениях. Получают его при прокаливании древесины (березы) без доступа воздуха с последующей обработкой. (Активированный уголь, углерод)
Она образует два аллотропных видоизменения: бывает кристаллическая и пластическая, входит в состав мазей и присыпок, способствует заживлению ран. (сера)
Изучение нового материала
Задача. Рассчитайте массу питьевой соды (гидрокарбоната натрия), используемой в народной и традиционной медицине для полоскания и ингаляций, которая образуется при пропускании 2,64г углекислого газа через раствор, содержащий 2г гидроксида натрия. (см. приложение 2)
(Записываем, дано, что надо найти, составляем уравнение реакции. Пишем над формулами веществ их массы. Под формулами веществ записываем количество вещества, молярную массу и массу. По ходу решения вывешивается алгоритм решения задачи.)
? Что необычного вы встретили в условии данной задачи? (в условии задачи указаны массы всех исходных веществ)
? Проблема: по массе какого вещества следует вычислять массу соды?
Тема урока: Расчеты по химическим уравнениям: одно из реагирующих веществ дано в избытке.
Иногда встречаются задачи, в которых даются массы или объемы двух реагирующих веществ (как в данном случае).
Для расчета по уравнению реакции было бы вполне достаточно знать или массу углекислого газа или массу гидроксида натрия. Зачем в условии задачи лишние данные? Дело в том, что мольные соотношения реагирующих веществ в данном случае могут быть не эквивалентны, поэтому одно из них в процессе израсходуется полностью, а часть другого останется не прореагировавшей. Очевидно, если находить массу конечного продукта, используя данные о веществе, оказавшемся в избытке, мы получим неправильный ответ. Как определить это вещество? Для этого найдем количества веществ реагентов.
(Учащиеся записывают алгоритм решения задачи в тетрадях, который отдельными блоками вывешивается на доске в виде таблицы «Алгоритм решения». Учитель записывает решение задачи на доске)
2,64г 2г x
СО2 + NaOH = NaHCO3
1 моль 1 моль 1 моль
44г/моль 40г/моль 84г/моль
44г 40г 84г
Находим ν (СО2)
ν= m/ M ν (СО2) = 2,64г/44г/моль = 0,06 моль
Находим ν (NaOH)
ν(NaOH) = 2г/40г/моль = 0,05моль
Находим избыток
По ур. р. ν(СО2) : ν (NaOH) = 1:1 => чтобы прореагировало 0,05 моль NaOH требуется 0,05 моль СО2, а дано 0,06 моль => СО2 в избытке.
Находим массу NaHCO3
Массу гидрокарбоната натрия следует находить, используя для расчета гидроксид натрия.
Из 40г NaOH – 84г NaHCO3
Из 2г NaOH – x
2г ∙ 84г
X = = 4,2г
= = 4,2г
40г
Ответ: 4,2г
(Затем учитель предлагает еще раз внимательно посмотреть на записи решения на доске, после чего закрывает их, а учащиеся самостоятельно воспроизводят их в тетрадях, используя имеющийся алгоритм. Затем они сверяют их с записями на доске.)
ТЕМА2: Генетическая связь предельных одноатомных спиртов с углеводородами.
Свойства углеводородов зависят от химического, пространственного, электронного строения молекул и характера химических связей.
Изучение строения, химических свойств и способов получения углеводородов различных групп показывает, что все они генетически связаны между собой, т.е. возможны превращения одних углеводородов в другие:

Это позволяет осуществлять целенаправленный синтез заданных соединений, используя ряд необходимых химических реакций (цепь превращений).
Задача 1. Назвать промежуточные продукты в схеме превращений:



 Этиловый спирт H2SO4 (k), t X HBr Y Na Z Cr2O3 Al2O3 бутадиен-1,3
Этиловый спирт H2SO4 (k), t X HBr Y Na Z Cr2O3 Al2O3 бутадиен-1,3
-H2
Решение. В данной цепи превращений, включающей 4 реакции, из этилового спирта С2Н5ОН должен быть получен бутадиен-1,3 СН2=СН–СН=СН2.
1. При нагревании спиртов с концентрированной серной кислотой
H2SO4 (водоотнимающее средство) происходит их дегидратация с образованием алкена Отщепление воды от этилового спирта приводит к образованию этилена:
![]()
2. Этилен – представитель алкенов. Являясь ненасыщенным соединением, он способен вступать в реакции присоединения . В результате гидробромирования этилена:
![]()
3.При нагревании бромэтана в присутствии металлического натрия (реакция Вюрца, образуется н-бутан (вещество Z):
![]()
4.Дегидрирование н-бутана в присутствии катализатора – один из способов получения бутадиена-1,3 СН2=СН–СН=СН2
(раздел 5.4. Получение алкадиенов).
Ответ: 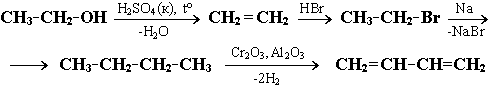
Осуществить превращения:
1 2 3 4 5
СаC2 → A → Б → H3C-CH2-Cl → В → Н3С-СН2-О-С3Н7
+2Н2 +КОН
СаС2 + 2Н2О → НС≡СН + Са(ОН)2 А
2) НС≡СН + 2Н2 → Н3С-СН3 Б
3) Н3С-СН3 + С12 → Н3С-СН2-С1 + НС1
4) Н3С-СН2-С1 + КОН (водн.) → Н3С-СН2-ОН + КС1 В
5) Н3С-СН2-ОН +НО-С3Н7 → Н3С-СН2-О-С3Н7 + Н2О
ГРУППА 506 ХИМИЯ33,34
ТЕМА33: Контрольная работа №2
 Содержание
Содержание
- Общие свойства кислот
- Окраска некоторых индикаторов в нейтральной и кислой среде
- Специфические свойства некоторых кислот
Химические свойства кислот можно разделить на две группы: общие для всех кислот, связанные с наличием в их растворах ионов водорода
 Общие свойства кислот
Общие свойства кислот
К общим свойствам кислот относятся:
1. Взаимодействие с металлами, расположенными в ряду напряжений до водорода, с выделением водорода, например:
2. Взаимодействие с основными и амфотерными оксидами, например:
3. Взаимодействие с основаниями и амфотерными гидроксидами, например:
4. Взаимодействие с солями, если образуется малорастворимое, летучее или малодиссоциирующее вещество, например:
Некоторые кислоты разлагаются при нагревании:
Кислоты можно распознавать с помощью индикаторов.
 Окраска некоторых индикаторов в нейтральной и кислой среде
Окраска некоторых индикаторов в нейтральной и кислой среде
| Название индикатора | Окраска индикатора в нейтральной среде | Окраска индикатора в кислой среде |
|---|---|---|
| Лакмус | Фиолетовая | Красная |
| Метиловый оранжевый (метилоранж) | Оранжевая | Красно-розовая |
| Фенолфталеин | Бесцветная | Бесцветная |
 Специфические свойства кислот
Специфические свойства кислот
Специфические свойства кислот обусловлены особенностями анионов кислотного остатка, в том числе оксилительно-восстановительными. Бескислородные галогеноводородные кислоты (
Кислородсодержащие кислоты, в которых центральный атом, входящий в состав аниона, находится в промежуточной степени окисления, могут проявлять как восстановительные, так и окислительные свойства, например:
Восстановитель
Окислитель
Многие кислородсодержащие кислоты, в которых центральный атом имеет максимальную степень окисления (
 Коротко о главном
Коротко о главном
Общие химические свойства кислот обусловлены наличием катиона водорода в их составе. К общим свойствам кислот относятся: изменение окраски индикаторов; взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода, с выделением водорода; взаимодействие с основными и амфотерными оксидами, основаниями и амфотерными гидроксидами; взаимодействие с солями, если в результате реакции образуются осадок, газ или малодиссоциирующее соединение. Специфические свойства кислот обусловлены особенностями анионов кислотного остатка.
 Вопросы для самоконтроля
Вопросы для самоконтроля
С какими из указанных веществ способна взаимодействовать разбавленная серная кислота: оксид алюминия, хлорид магния, цинк, нитрат свинца(
), серебро, гидроксид хрома( ), гидроксид цинка, сульфид натрия? Составьте уравнения соответствующих реакций. С какими из указанных веществ способна взаимодействовать разбавленная соляная кислота: оксид цинка, нитрат серебра, магний, карбонат кальция, медь, гидроксид меди(
), оксид железа( ), сульфат натрия? Составьте уравнения соответствующих реакций. Относится ли реакция взаимодействия азотной кислоты с серебром к общим свойствам кислот? Аргументируйте свой ответ.
 Методы получения кислот
Методы получения кислот
| Методы получения кислот | |
|---|---|
| Бескислородных | Кислородосодержащих |
Растворением в воде соответствующих водородных соединений ( | 1) взаимодействием кислотных оксидов с водой 2) по реакции обмена |
 Взаимодействия кислот со спиртами
Взаимодействия кислот со спиртами
При взаимодействии со спиртами неорганические и органические кислоты образуют сложные эфиры: