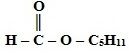ЧЕТВЕРГ 28.10.21г. 308, 401, 406
моя почта : rimma.lu@gmail.com
ГРУППА 308 ХИМИЯ 21, 22
ТЕМА: СТРОЕНИЕ И СВОЙСТВА СЛОЖНЫХ ЭФИРОВ, ИХ ПРИМЕНЕНИЕ.
I. Состав и строение сложных эфиров
Сложные эфиры – функциональные производные карбоновых кислот, в молекулах которых гидроксильная группа (-ОН) замещена на остаток спирта (-OR).
Сложные эфиры карбоновых кислот – соединения с общей формулой R–COOR', где R и R' – углеводородные радикалы.

II. Физические свойства и нахождение сложных эфиров в природе
- Летучие, бесцветные жидкости
- Плохо растворимы в воде
- Чаще с приятным запахом
- Легче воды
Сложные эфиры содержатся в цветах, фруктах, ягодах.
Они определяют их специфический запах.
Являются составной частью эфирных масел (известно около 3000 эф.м. – апельсиновое, лавандовое, розовое и т. д.)
Эфиры низших карбоновых кислот и низших одноатомных спиртов имеют приятный запах цветов, ягод и фруктов. Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
CH3(CH2)14–CO–O–(CH2)29CH3
Аромат. Структурная формула. | Название сложного эфира |
Яблоко  | Этиловый эфир 2-метилбутановой кислоты
|
Вишня  | Амиловый эфир муравьиной кислоты
|
Груша  | Изоамиловый эфир уксусной кислоты
|
Ананас  | Этиловый эфир масляной кислоты (этилбутират) |
Банан  | Изобутиловый эфир уксусной кислоты (у изоамилацетата так же напоминает запах банана) |
Жасмин  | Бензиловый эфир уксусной (бензилацетат)
|
Запахи эфиров:
Рис. 1.
Сложные эфиры нерастворимы в воде, но хорошо смешиваются со многими органическими веществами. Именно поэтому они используются как растворители для лаков и красок. Рис. 1. Этилацетат и метил ацетат – основа растворителя – жидкости для снятия лака с ногтей.
Температуры кипения сложных эфиров меньше, чем температуры кипения кислот и спиртов с близкой молярной массой. Почему? Сложные эфиры, в отличие от кислот и спиртов, не способны образовывать водородные связи между молекулами.
Сравнение температуры кипения эфиров
III. Номенклатура сложных эфиров
Краткие названия сложных эфиров строятся по названию радикала (R') в остатке спирта и названию группы RCOO- в остатке кислоты. Например, этиловый эфир уксусной кислоты CH3COOC2H5 называется этилацетат.
Названия по ИЮПАК выделены жирным шрифтом:
H–COO–C2H5 | CH3–COO–CH3–CH3 | CH2CH2–COO–C2H5 |
Этилформиат, этилметаноат; этиловый эфир муравьиной кислоты | Метилацетат, метилэтаноат; метиловый эфир уксусной кислоты | Этилбутират, этилбутаноат; этиловый эфир бутановой кислоты |

IV. Применение
- В качестве отдушек и усилителей запаха в пищевой и парфюмерной (изготовление мыла, духов, кремов) промышленности;
- В производстве пластмасс, резины в качестве пластификаторов.
Пластификаторы – вещества, которые вводят в состав полимерных материалов для придания (или повышения) эластичности и (или) пластичности при переработке и эксплуатации.
Применение в медицине
В конце XIX — начале ХХ века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
V. Получение сложных эфиров
Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.

Видео-опыт: «Получение уксусноэтилового эфира»
Видео-опыт: «Получение борноэтилового эфира»
Реакция этерификации в условиях кислотного катализа обратима. Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.
RCOOR' + H2O (H+)↔ RCOOH + R'OH
Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат-анион RCOO– не вступает в реакцию с нуклеофильным реагентом – спиртом).
Эта реакция называется омылением сложных эфиров (по аналогии со щелочным гидролизом сложноэфирных связей в жирах при получении мыла).
VI. Тренажеры
Тренажер №1: “Реакция этерификации”
ЦОРы
Видео-опыт: «Получение уксусноэтилового эфира»
Видео-опыт: «Получение борноэтилового эфира»
ТЕМА: ЖИРЫ:СТРОЕНИЕ , СВОЙСТВА И ПРИМЕНЕНИЕ.
Жиры, их строение, свойства и применение
Жиры – ценный химический продукт, один из главных компонентов животных и растительных клеток. Этот урок будет посвящен изучению строения и наиболее характерных свойств жиров.
«Химия везде, химия во всем:
Во всем, чем мы дышим,
Во всем, что мы пьем,
Во всем, что едим».




I. Жиры в природе и их роль
Люди давно научились выделять жир из натуральных объектов и использовать его в повседневной жизни. Жир сгорал в примитивных светильниках, освещая пещеры первобытных людей, жиром смазывали полозья, по которым спускали на воду суда. Жиры – основной источник нашего питания. Но неправильное питание, малоподвижный образ жизни приводит к избыточному весу. Животные пустынь запасают жир как источник энергии и воды. Толстый жировой слой тюленей и китов помогает им плавать в холодных водах Северного Ледовитого океана.
Жиры широко распространены в природе. Наряду с углеводами и белками они входят в состав всех животных и растительных организмов и составляют одну из основных частей нашей пищи. Источниками жиров являются живые организмы. Среди животных это коровы, свиньи, овцы, куры, тюлени, киты, гуси, рыбы (акулы, тресковые, сельди). Из печени трески и акулы получают рыбий жир – лекарственное средство, из сельди – жиры, используемые для подкормки сельскохозяйственных животных. Растительные жиры чаще всего бывают жидкими, их называют маслами. Применяются жиры таких растений, как хлопок, лен, соя, арахис, кунжут, рапс, подсолнечник, горчица, кукуруза, мак, конопля, кокос, облепиха, шиповник, масличная пальма и многих других.
Жиры выполняют различные функции: строительную, энергетическую (1 г жира дает 9 ккал энергии), защитную, запасающую. Жиры обеспечивают 50% энергии, требуемой человеку, поэтому человеку необходимо потреблять 70–80 г жиров в день. Жиры составляют 10–20% от массы тела здорового человека. Жиры являются незаменимым источником жирных кислот. Некоторые жиры содержат витамины А, D, Е, К, гормоны.
Многие животные и человек используют жир в качестве теплоизолирующей оболочки, например, у некоторых морских животных толщина жирового слоя достигает метра. Кроме того, в организме жиры являются растворителями вкусовых веществ и красителей. Многие витамины, например витамин А, растворяются только в жирах.
Некоторые животные (чаще водоплавающие птицы) используют жиры для смазки своих собственных мышечных волокон.
Жиры повышают эффект насыщения пищевыми продуктами, т. к. они перевариваются очень медленно и задерживают наступление чувства голода.
II. История открытия жиров
Еще в 17 в. немецкий ученый, один из первых химиков-аналитиков Отто Тахений (1652–1699) впервые высказал предположение, что жиры содержат «скрытую кислоту».
В 1741 французский химик Клод Жозеф Жоффруа (1685–1752) обнаружил, что при разложении кислотой мыла (которое готовили варкой жира со щелочью) образуется жирная на ощупь масса.
То, что в состав жиров и масел входит глицерин, впервые выяснил в 1779 знаменитый шведский химик Карл Вильгельм Шееле.
Впервые химический состав жиров определил в начале прошлого века французский химик Мишель Эжен Шеврёль, основоположник химии жиров, автор многочисленных исследований их природы, обобщенных в шеститомной монографии "Химические исследования тел животного происхождения".
1813 г Э. Шеврёль установил строение жиров, благодаря реакции гидролиза жиров в щелочной среде.Он показал, что жиры состоят из глицерина и жирных кислот, причем это не просто их смесь, а соединение, которое, присоединяя воду, распадается на глицерин и кислоты.
III. Синтез жиров

В 1854 французский химик Марселен Бертло (1827–1907) провел реакцию этерификации, то есть образования сложного эфира между глицерином и жирными кислотами и таким образом впервые синтезировал жир.

Общая формула жиров (триглицеридов):

Жиры – сложные эфиры глицерина и высших карбоновых кислот. Общее название таких соединений – триглицериды.



Животные жиры содержат главным образом глицериды предельных кислот и являются твердыми веществами.
Растительные жиры, часто называемые маслами, содержат глицериды непредельных карбоновых кислот. Это, например, жидкие подсолнечное, конопляное и льняное масла.

Природные жиры содержат следующие жирные кислоты
Насыщенные: стеариновая (C17H35COOH) пальмитиновая (C15H31COOH) масляная (C3H7COOH) | В составе животных жиров |
Ненасыщенные: олеиновая (C17H33COOH, 1 двойная связь) линолевая (C17H31COOH, 2 двойные связи) линоленовая (C17H29COOH, 3 двойные связи) арахидоновая (C19H31COOH, 4 двойные связи, реже встречается) | В составе растительных жиров |
Жиры содержатся во всех растениях и животных. Они представляют собой смеси полных сложных эфиров глицерина и не имеют чётко выраженной температуры плавления.
V. Физические свойства жиров
При комнатной температуре жиры (смеси триглицеридов) – твердые, мазеобразные или жидкие вещества. Как любая смесь веществ, они не имеют четкой температуры плавления (т.е. плавятся в некотором диапазоне температур). Определенной температурой плавления характеризуются лишь индивидуальные триглицериды.
Консистенция жиров зависит от их состава:
- в твердых жирах преобладают триглицериды с остатками насыщенных кислот, имеющие относительно высокие температуры плавления;
- для жидких жиров (масел), напротив, характерно высокое содержание триглицеридов ненасыщенных кислот с низкими температурами плавления.
Причиной снижения температуры плавления триглицеридов с остатками ненасыщенных кислот является наличие в них двойных связей с цис-конфигурацией. Это приводит к существенному изгибу углеродной цепи, нарушающему упорядоченную (параллельную) укладку длинноцепных радикалов кислот.
Сравним пространственное строение ненасыщенной и насыщенной и кислот с равным числом углеродных атомов в цепи: олеиновой C17H33COOH и стеариновой C17H35COOH.

На молекулярной модели олеиновой кислоты виден изгиб цепи по связи С=С, препятствующий плотной упаковке молекул.

В углеродной цепи стеариновой кислоты отсутствуют изгибы, поэтому ее молекулы способны к плотной параллельной укладке.
Чем плотнее упаковка молекул вещества, тем выше температуры его фазовых переходов (т.плав., т.кип.). Соответственно, температура плавления тристеарата глицерина (71 oC) существенно больше, чем у триолеата (–17 oC).
Жиры практически не растворимы в воде, но при добавлении мыла или других поверхностно-активных веществ (эмульгаторов), они способны образовывать стойкие водные эмульсии. Жиры ограниченно растворимы в спирте и хорошо растворимы во многих неполярных и малополярных растворителях – эфире, бензоле, хлороформе, бензине.
- Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твердыми веществами с невысокой температурой плавления (исключение – рыбий жир). В твёрдых жирах преобладают остатки насыщенных кислот.
- Растительные жиры – масла (подсолнечное, соевое, хлопковое и др.) – жидкости (исключение – кокосовое масло, масло какао-бобов). Масла содержат в основном остатки ненасыщенных (непредельных) кислот.
Видео-опыт: "Определение непредельности жиров"
Особенно важны полиненасыщенные кислоты с несколькими двойными связями:
- линолевая CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH,
- линоленовая CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH,
- арахидоновая CH3(CH2)4CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOH
VI. Химические свойства жиров
1. Гидролиз, или омыление
Происходит под действием воды, с участием ферментов или кислотных катализаторов (обратимо) , при этом образуются спирт - глицерин и смесь карбоновых кислот:

или щелочей (необратимо). При щелочном гидролизе образуются соли высших жирных кислот, называемые мылами. Мыла получаются при гидролизе жиров в присутствии щелочей:
Мыла — это калиевые и натриевые соли высших карбоновых кислот.
2. Гидрирование жиров
Это превращение жидких растительных масел в твердые жиры – имеет большое значение для пищевых целей. Продукт гидрогенизации масел – твердый жир (искусственное сало, саломас). Маргарин – пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкого и др.), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др.).
Так в промышленности получают маргарин:

- Пищевая промышленность
- Фармацевтика
- Производство мыла и косметических изделий
- Производство смазочных материалов
Животные жиры и растительные масла, наряду с белками и углеводами – одна из главных составляющих нормального питания человека. Они являются основным источником энергии: 1 г жира при полном окислении (оно идет в клетках с участием кислорода) дает 9,5 ккал (около 40 кДж) энергии, что почти вдвое больше, чем можно получить из белков или углеводов. Кроме того, жировые запасы в организме практически не содержат воду, тогда как молекулы белков и углеводов всегда окружены молекулами воды. В результате один грамм жира дает почти в 6 раз больше энергии, чем один грамм животного крахмала – гликогена. Таким образом, жир по праву следует считать высококалорийным «топливом». В основном оно расходуется для поддержания нормальной температуры человеческого тела, а также на работу различных мышц, поэтому даже когда человек ничего не делает (например, спит), ему каждый час требуется на покрытие энергетических расходов около 350 кДж энергии, примерно такую мощность имеет электрическая 100-ваттная лампочка.
Известно, что значительную долю потребляемого жира должны составлять растительные масла, которые содержат очень важные для организма соединения – полиненасыщенные жирные кислоты с несколькими двойными связями. Эти кислоты получили название «незаменимых». Как и витамины, они должны поступать в организм в готовом виде. Из них наибольшей активностью обладает арахидоновая кислота (она синтезируется в организме из линолевой), наименьшей – линоленовая (в 10 раз ниже линолевой). По разным оценкам суточная потребность человека в линолевой кислоте составляет от 4 до 10 г. Больше всего линолевой кислоты (до 84%) в сафлоровом масле, выжимаемом из семян сафлора – однолетнего растения с ярко-оранжевыми цветками. Много этой кислоты также в подсолнечном и ореховом масле.
По мнению диетологов, в сбалансированном рационе должно быть 10% полиненасыщенных кислот, 60% мононенасыщенных (в основном это олеиновая кислота) и 30% насыщенных. Именно такое соотношение обеспечивается, если треть жиров человек получает в виде жидких растительных масел – в количестве 30–35 г в сутки. Эти масла входят также в состав маргарина, который содержит от 15 до 22% насыщенных жирных кислот, от 27 до 49% ненасыщенных и от 30 до 54% полиненасыщенных. Для сравнения: в сливочном масле содержится 45–50% насыщенных жирных кислот, 22–27% ненасыщенных и менее 1% полиненасыщенных. В этом отношении высококачественный маргарин полезнее сливочного масла.
Необходимо помнить
Насыщенные жирные кислоты отрицательно влияют на жировой обмен, работу печени и способствуют развитию атеросклероза. Ненасыщенные (особенно линолевая и арахидоновая кислоты) регулируют жировой обмен и участвуют в выведении холестерина из организма. Чем выше содержание ненасыщенных жирных кислот, тем ниже температура плавления жира. Калорийность твердых животных и жидких растительных жиров примерно одинакова, однако физиологическая ценность растительных жиров намного выше. Более ценными качествами обладает жир молока. Он содержит одну треть ненасыщенных жирных кислот и, сохраняясь в виде эмульсии, легко усваивается организмом. Несмотря на эти положительные качества, нельзя употреблять только молочный жир, так как никакой жир не содержит идеального состава жирных кислот. Лучше всего употреблять жиры как животного, так и растительного происхождения. Соотношение их должно быть 1:2,3 (70% животного и 30% растительного) для молодых людей и лиц среднего возраста. В рационе питания пожилых людей должны преобладать растительные жиры.
Жиры не только участвуют в обменных процессах, но и откладываются про запас (преимущественно в брюшной стенке и вокруг почек). Запасы жира обеспечивают обменные процессы, сохраняя для жизни белки. Этот жир обеспечивает энергию при физической нагрузке, если с пищей жира поступило мало, а также при тяжелых заболеваниях, когда из-за пониженного аппетита его недостаточно поступает с пищей.
Обильное потребление с пищей жира вредно для здоровья: он в большом количестве откладывается про запас, что увеличивает массу тела, приводя порой к обезображиванию фигуры. Увеличивается его концентрация в крови, что, как фактор риска, способствует развитию атеросклероза, ишемической болезни сердца, гипертонической болезни и др.
IX. Тренажеры
Тренажер №1: “Гидролиз жиров. Гидрирование жидких жиров”
Тренажер №2: “Классификация жиров”
Тренажер №3: “Строение жиров”
Тестовые задания по теме "Сложные эфиры. Жиры"
ЦОРы
Видео-опыт: "Определение непредельности жиров"
ГРУППА 401 биология 12,13
Фотосинтез – это процесс образования органических веществ в зелёных растениях. Фотосинтез создал всю массу растений на Земле и обогатил атмосферу кислородом.
Как питается растение?
Раньше люди были уверены, что все вещества для своего питания растения берут из почвы. Но один опыт показал, что это не так.
В горшок с землёй было посажено дерево. При этом измерили массу и земли, и дерева. Когда через несколько лет снова взвесили то и другое, оказалось, что масса земли уменьшилась всего на несколько граммов, а масса растения увеличилась на много килограмм.
В почву вносили только воду. Откуда же взялись эти килограммы растительной массы?
Из воздуха. Все органические вещества растений созданы из углекислого газа атмосферы и почвенной воды.
Энергия
Животные и человек питаются растениями, чтобы получить энергию для жизни. Эта энергия содержится в химических связях органических веществ. Откуда она там?
Известно, что растение не может нормально расти без света. Свет и является энергией, с помощью которой растение строит органические вещества своего тела.
Не важно какой это свет, солнечный или электрический. Любой луч света несёт энергию, которая становится энергией химический связей и как клей удерживает атомы в больших молекулах органических веществ.
Где идёт фотосинтез
Фотосинтез проходит только в зелёных частях растений, а точнее, в особых органах растительных клеток – хлоропластах.
Хлоропласты являются разновидностью пластид. Они всегда зелёные, т. к. содержат вещество зелёного цвета – хлорофилл.
Хлоропласт отделён от остального объёма клетки мембраной и имеет вид зёрнышка. Внутреннее пространство хлоропласта называется стромой. В ней и начинаются процессы фотосинтеза.
Хлоропласты являются как бы фабрикой, на которую поступает сырьё:
- углекислый газ (формула – СО₂);
- вода (Н₂О).
Вода поступает из корней, а углекислый газ – из атмосферы через особые отверстия в листьях-устьица. Свет является энергией для работы фабрики, а полученные органические вещества – продукцией.
Сначала производятся углеводы (глюкоза), но впоследствии из них образуется множество веществ разнообразных запахов и вкусов, которые так любят животные и люди.
Из хлоропластов полученные вещества транспортируются в разные органы растения, где откладываются в запас, либо используются для процессов жизнедеятельности.
Реакция фотосинтеза
В общем виде уравнение фотосинтеза выглядит так:
СО₂(углекислый газ) + Н₂О(вода) = органические вещества(глюкоза) + О₂ (кислород)
Зелёные растения входят в группу автотрофов (в переводе – «сам питаюсь») – организмов, которым для получения энергии не нужны другие организмы.
Основная функция фотосинтеза – создание органических веществ, из которых строится тело растений.
Выделение кислорода – побочный эффект процесса.
Значение фотосинтеза
Роль фотосинтеза в природе чрезвычайно велика. Благодаря ему создан весь растительный мир и озоновый экран нашей планеты.
Благодаря фотосинтезу растения:
- являются источником кислорода для атмосферы;
- переводят энергию солнца в доступную для животных и человека форму.
Жизнь на Земле стала возможной при накоплении достаточного количества кислорода в атмосфере. Ни человек, ни животные не смогли бы жить в те далёкие времена, когда его не было, или было мало.
Какая наука изучает процесс фотосинтеза
Фотосинтез изучают разные науки, но больше всего ботаника и физиология растений.
Ботаника – это наука о растениях и, поэтому изучает его как важный жизненный процесс растений.
Наиболее подробно изучает фотосинтез физиология растений. Учёные-физиологи определили, что этот процесс сложный и имеет стадии:
- световую;
- темновую.
Это значит, что фотосинтез начинается на свету, но заканчивается в темноте.

Что мы узнали?
Изучив данную тему по биологии 5 класса, можно объяснить кратко и понятно фотосинтез как процесс образования в растениях органических веществ из неорганических (СО₂ и Н₂О). Его особенности: проходит в зелёных пластидах (хлоропластах), сопровождается выделением кислорода, осуществляется под действием света.
Тест по теме
Подробнее: https://obrazovaka.ru/biologiya/fotosintez-kratko-5-klass.html
ТЕМА: Биологическое окисление.
Биологическое окисление. Анаэробный этап клеточного дыхания.
И гетеротрофные, и автотрофные организмы способны получать энергию для обеспечения клеточных нужд (биосинтез различных веществ, транспорт и движение) путём окисления органических веществ. Для гетеротрофов окисление органических веществ является единственным способом получения энергии. Фотоавтотрофы используют энергию света для того, чтобы синтезировать сахара, а полученные сахара используются либо для синтеза других веществ и построения тела в ходе процессов анаболизма, либо как источник энергии в катаболизме. Фотосинтезирующие организмы расходуют свои запасы органических веществ случае отсутствия света, например, в темное время суток, а также в клетках, которые находятся в тех частях организма, куда не проникает свет.
суть биологического окисления
Окисление — это процесс отдачи веществом электронов окислителю. Окисление может происходить в ходе различных процессов:
- Отдача веществом только электронов. Такое окисление имеет место, например, при превращении
в составе цитохромов или же как реакция свободного железа при хемосинтезе. - Окислительно-восстановительные реакции органических веществ в клетках часто сопровождаются передачей не только электронов, но и атомов О или Н.
а) Поскольку атом О обладает большей электроотрицательностью, чем атом С, увеличение количества атомов кислорода в соединении считается окислением.
При этом степень окисления углерода в соединении увеличивается (электроны от него смещаются к кислороду,-заряд на атоме С увеличивается).
Пример — окисление альдегида до карбоновой кислоты.б) Поскольку связь С–Н гораздо менее полярная, чем С–О, степень окисления углерода в соединениях с большим количеством атомов Н меньше (менее положительная), чем в соединениях с меньшим количеством атомов Н (при наличии других электроотрицательных атомов — О, N…).
Поэтому окислением может называться отдача органическим веществом атомов водорода.
Пример — окисление спирта в альдегид.
переносчики водорода
Итак, биологическое окисление органических веществ часто происходит путем отдачи атомов водорода [H], то есть протонов
Таким образом, НАД переносит 2 электрона и 1 протон, второй протон выделяется в раствор. ФАД переносит 2 электрона и 2 протона.
Принимая на себя атомы водорода,
этапы окисления энергетических субстратов
Процесс катаболизма энергетических субстратов (органических веществ) протекает с выделением энергии. Он состоит из следующих этапов:
- Подготовительный этап идет в полости пищеварительной системы или — при внутриклеточном пищеварении — во вторичных лизосомах. При этом полимеры расщепляются на мономеры, которые можно перенести через мембрану в цитоплазму клеток (или сначала в кровь, а затем в тканевую жидкость и в цитоплазму). Расщепление катализируют литические ферменты. Например, амилазы и мальтазы расщепляют в тонком кишечнике крахмал до глюкозы.
Энергия на этом этапе выделяется в виде тепла, АТФ не образуется.
Основным источником энергии для многих клеток служит окисление глюкозы или других сахаров, поэтому рассматривается в первую очередь механизм окисления глюкозы, хотя и другие вещества могут окисляться с целью получения энергии (аминокислоты, жирные кислоты…).
Внутриклеточное окисление глюкозы включает два этапа:
а) анаэробный этап в цитоплазме — гликолиз. У анаэробов на этом окисление глюкозы заканчивается, так как нет молекулярного кислорода для дальнейшего окисления;
б) аэробный этап в митохондриях при участии молекулярного кислорода.
гликолиз
Первый этап внутриклеточного окисления углеводов осуществляется без участия кислорода и называется гликолиз (от «гликис» — сладкий, «лизис» — распад). Он происходит в цитоплазме.
На первых этапах гликолиза тратится две молекулы АТФ на фосфорилирование 1 молекулы сахара. Образующаяся гексоза (С6), несущая два остатка фосфорной кислоты, распадается на две фосфорилированные триозы (2*С3). Затем происходит окисление фосфотриозы (фосфорилированного C3-сахара — «половинки» глюкозы) до фосфоглицериновой кислоты (ФГК). Это окисление осуществляется путем отнятия двух атомов водорода и переноса их на
Образовавшаяся ФГК превращается далее в пировиноградную кислоту (ПВК), или пируват, при этом синтезируется еще две молекулы АТФ в расчете на 1 молекулу глюкозы. Таким образом, расщепление в гликолизе одной молекулы глюкозы дают в результате выигрыш в 2 молекулы АТФ. Пируват — это конечный продукт гликолиза.
В результате этого процесса в клетке будет накапливаться НАД∙Н, который необходимо снова превратить в
В условиях же бескислородной среды окисление НАДН до
Различают разные типы брожения:
а) Молочнокислое брожение. ПВК (пируват) превращается в молочную кислоту (лактат). Так происходит, например, при частых сокращениях мышц, когда поступление кислорода недостаточно, и основная часть АТФ получается за счет гликолиза. Накопление молочной кислоты является основным фактором усталости мышц. Аналогичный процесс происходит при росте ряда микроорганизмов в анаэробных условиях. Накапливающаяся при этом молочная кислота подавляет рост гнилостных бактерий и служит консервантом продуктов при приготовлении простокваши, йогурта, квашеной капусты, силоса на корм скоту.
б) Спиртовое брожение. Дрожжи на завершающем этапе гликолиза отщепляют от пировиноградной кислоты карбоксильную группу в форме углекислого газа, в результате чего образуется уксусный альдегид. Он восстанавливается путем переноса водородов с НАД∙Н до этилового спирта. На этом процессе основано пивоварение, виноделие, а также поднятие дрожжевого теста (за счет пузырьков образующегося углекислого газа).
ТЕМА:Электролитическая диссоциация. Электролиты и неэлектролиты.
ТЕМА:Механизмы электролитической диссоциации для веществ с различными типами химической связи. Гидратированные и негидратированные ионы.
Хорошо известно, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят. Это можно наблюдать с помощью простого прибора 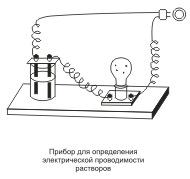 . Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара, то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия.
. Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара, то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия.
Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами.
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам – большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
Электролиты – проводники второго рода. В растворе или расплаве они распадаются на ионы, благодаря чему и протекает ток. Очевидно, чем больше ионов в растворе, тем лучше он проводит электрический ток. Чистая вода электрический ток проводит очень плохо.
Распад электролитов на ионы при растворении их в воде называется элекролитической диссоциацией.
Так, хлорид натрия NaСl при растворении в воде полностью распадается на ионы натрия Na+ и хлорид–ионы Cl–. Вода образует ионы водорода Н+ и гидроксид–ионы ОН– лишь в очень незначительных количествах.
Различают сильные и слабые электролиты.
Сильные электролиты при растворении в воде диссоциируют на ионы.
1) почти все соли;
2) многие минеральные кислоты, например Н2SO4, HNO3, НСl, HBr, HI, НМnО4, НСlО3, НСlО4;
3) основания щелочных и щелочноземельных металлов.
Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы.
К ним относятся:
1) почти все органические кислоты;
2) некоторые минеральные кислоты, например H2СО3, Н2S, НNO2, HClO, H2SiO3;
3) многие основания металлов (кроме оснований щелочных и щелочноземельных металлов), а также NH4OH, который можно изображать как гидрат аммиака NH3∙H2O.
К слабым электролитам относится вода.
Слабые электролиты не могут дать большой концентрации ионов в растворе.
Электролитическая диссоциация
Понятие электролитов впервые ввел М. Фарадей в первой половине XIX века. Согласно его определению:
Электролитами называют вещества, водные растворы или расплавы которых проводят электрический ток.
Опустим в стакан с водой графитовые стержни, присоединенные к источнику тока и связанные цепью с электрической лампой. При включении рубильника никаких видимых изменений не происходит. Это означает, что вода не проводит электрический ток, то есть не является электролитом. Внесем в стакан с водой поваренную соль – хлорид натрия,
Атомы и группы атомов, несущие электрический заряд, называют ионами. Положительно заряженные ионы называют катионами, отрицательно заряженные ионы - анионами.
Проведя дополнительный опыт, можно убедиться, что сухая поваренная соль не проводит электрический ток. Таким образом, можно сделать вывод, что свободные ионы появляются в расплаве и при растворении соли в воде.
Рассмотрим на атомарном уровне, что происходит с кристаллом поваренной соли при попадании его в воду. Соль – вещество с ионной кристаллической решеткой, в узлах которой расположены катионы натрия и анионы хлора. Они удерживаются друг около друга благодаря силам электростатического притяжения.
Молекула воды представляет собой диполь, так как на атомах водорода локализованы частичные положительные заряды, на на атоме кислорода – отрицательный.

В молекуле воды атомные орбитали кислорода находятся в
Для объяснения свойств водных растворов электролитов С. Аррениус в 1887 году предложил теорию электролитической диссоциации. Эта теория объясняла, почему растворы некоторых веществ проводят электрический ток, но не отвечала на вопрос, почему одни вещества являются электролитами, а другие - нет. Более подробно особенности поведения веществ в растворах описал Д.И. Менделеев, который экспериментально доказал, что при растворении электролитов происходит химическое взаимодействие между молекулами растворенного вещества и молекулами растворителя. Сущность процесса электролитической диссоциации было объяснено на основании природы химической ионной связи.
Согласно теории Д.И. Менделеева, электролитическая диссоциация молекул электролитов протекает в три стадии. Рассмотрим эти стадии на примере поваренной соли NaCl.
1. При попадании в воду, молекулы воды окружают кристаллы поваренной соли, притягиваясь к катионам натрия своими отрицательно заряженными концами, а к анионам хлора - положительно заряженными. Эта стадия называется ассоциация.
2. За счет электростатического взаимодействия, молекулы воды "растаскивают" молекулу электролита, связь между ионами в кристалле ослабевает и разрывается, то есть происходит непосредственно диссоциация (распад) молекул.
3. Диполи воды полностью окружают образовавшиеся при распаде ионы, катионы и анионы, образуя гидратную оболочку. Гидратированные ионы переходят в раствор.

В неводных растворах в качестве диполей может выступать не вода, а другой полярный растворитель, например, этанол. В таком случае ионы окружены молекулами растворителя (образуют сольватную оболочку) и называются сольватированными.
Ионы в водном растворе окружены молекулами воды, то есть имеют гидратную оболочку, и называются гидратированными.

Таким образом, описанный выше процесс можно описать уравнением:
где
В большинстве случаев этот процесс записывают упрощенно, не указывая гидратированное состояние ионов:
Процесс распада вещества на ионы при растворении в воде или расплавлении называют электролитической диссоциацией.
Электролитическая диссоциация состоит из двух одновременно протекающих обратных процессов: из диссоциации (распад молекул на ионы) и ассоциации (процесс образования молекул из ионов). Поэтому в уравнении электролитической диссоциации всегда ставят знак
В водных растворах диссоциации подвержены кислоты, сильные основания и растворимые соли:
При диссоциации происходит резкое увеличение числа частиц в растворе – это отличает растворы электролитов от растворов неэлектролитов. Именно поэтому растворы солей замерзают при более низкой температуре, чем растворы неэлектролитов.
Особенно сильно гидратирован ион водорода
Основные положения Теории электролитической диссоциации
Согласно теории электролитической диссоциации С. Аррениуса и Д. И. Менделеева можно сформулировать основные положения теории электролитической диссоциации (ТЭД):
- При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
- Электролитическая диссоциация - процесс обратимый (обратная реакция называется ассоциацией).
Степень электролитической диссоциации
Основываясь на теории электролитической диссоциации можно дать определения важнейшим классам неорганических соединений
| Название | Определение | Уравнение диссоциации |
| Оксиды | Неэлектролиты, состоят из атомов элемента и кислорода | Не диссоциируют в водных растворах |
| Кислоты | Электролиты, при диссоциации образуют катионы водорода | |
| Основания | Электролиты, при диссоциации образуют гидроксид-анионы.Растворимые в воде основания называют щелочами | |
| Соли | Электролиты, при диссоциации образуют катионы металла и анионы кислотного остатка | |