14.11.22г. ПОНЕДЕЛЬНИК 501,406,405
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 501 ХИМИЯ 9,10
ТЕМА 9: Периодическая таблица химических элементов – графическое отображение периодического закона. Структура периодической таблицы: периоды (малые и большие), группы (главная и побочная).




- постепенно ослабляются металлические свойства простых веществ и усиливаются неметаллические;
- высшая валентность элементов по кислороду возрастает от
I (у щелочных металлов) доVII (у галогенов); - валентность элементов неметаллов в летучих водородных соединениях уменьшается от
IV доI (у галогенов); - свойства высших оксидов и гидроксидов постепенно изменяются от основных через амфотерные до кислотных.
ТЕМА10:Строение атома и периодический закон Д.И. Менделеева. Атом – сложная частица. Ядро (протоны и нейтроны) и электронная оболочка. Изотопы.
ПОСМОТРИ ВИДЕО И СДЕЛАЙ ЗАПИСИ.
ГРУППА 406 ХИМИЯ 20,21,22
ТЕМА 20,21,22: Алканы: гомологический ряд, изомерия и номенклатура алканов. Химические свойства алканов (метана, этана): горение, замещение, разложение, дегидрирование.Применение алканов на основе свойств. Ознакомление с коллекцией образцов нефти и продуктов ее переработки.
Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Гомологический ряд алканов
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Все алканы легче воды, не растворимы в воде и не смешиваются с ней.
Строение алканов
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp3:
При образовании связи С–С происходит перекрывание sp3-гибридных орбиталей атомов углерода:
При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода |

Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
| Наример, пространственное строение н-бутана — зигзагообразное |
Изомерия алканов
Структурная изомерия
Для алканов характерна структурная изомерия – изомерия углеродного скелета.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
| Например. Для н-бутана (алкана с линейной цепью) существует изомер с разветвленным углеродным скелетом – изобутан |
| Бутан | Изобутан |
 |  |
С увеличением числа атомов углерода в молекуле увеличивается количество изомеров, соответствующих данной формуле. У метана CH4, этана C2H6 и пропана C3H8 структурных изомеров нет.
Количество изомеров в ряду алканов:
| Молекулярная формула | Число структурных изомеров |
| C4H10 | 2 |
| C5H12 | 3 |
| C6H14 | 5 |
| C7H16 | 9 |
| C8H18 | 18 |
| C9H20 | 35 |
| C10H22 | 75 |
Оптическая изомерия
Если атом углерода в молекуле связан с четырьмя различными заместителями (атомами или атомными группами), например:
то возможно существование двух соединений с одинаковой структурой, но различным пространственным строением.Молекулы таких соединений относятся друг к другу, как зеркальные изображение и предмет. При этом никаким вращением нельзя получить одну молекулу из другой.
Номенклатура алканов
В названиях алканов используется суффикс -АН.
| Например, алкан имеет название 2-метилпропан. |
Для простейших алканов (метан, этан, пропан, бутан и изобутан) используют тривиальные названия. Начиная с пятиатомного углероводорода, в названии неразветвленных (нормальных) алканов используют корень, который показывает число атомов углерода в молекуле, и добавляют соответствующий суффикс (для алканов – ан, для алкенов – ен, и т.д.).
Название разветвленных алканов строится по следующим правилам:
1. Выбирают главную углеродную цепь. При этом считают, что углеводородные радикалы, которые не входят в главной цепь, являются в ней заместителями. При этом главная цепь должна быть самой длинной. Например, в молекуле на рисунке главной является цепь, отмеченная на рисунке а:
| а | б |
 |  |
Главная цепь должна быть самой разветвленной.
Например, в молекуле, изображенной на рисунках а и б, выделены цепи с одинаковым числом атомов углерода. Но главной будет цепь, изображенная на рисунке а, т.к. от нее отходит 2 заместителя, а от цепи на рисунке б – только один:
| а | б |
 |  |
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода, которые соединены с заместителями, получили минимальные возможные номера. Причем нумерацию следует начинать с более близкого к старшей группе конца цепи.
3. Называют все радикалы, указывая впереди цифры, которые обозначают их расположение в главной цепи.
Например, 2-метилпропан:
Для одинаковых заместителей эти цифры указывают через запятую, при этом количество одинаковых заместителей обозначается приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д.
Например, 2,2-диметилпропан или 2,2,3-триметилпентан.
4. Названия заместителей со всеми приставками и цифрами располагают в алфавитном порядке.
Например: 2,2-диметил-3-этилпентан.
5. Называют главную углеродную цепь, т.е. соответствующий нормальный алкан.
Например, название молекулы на рисунке:
2,2,4-триметил-4-этилгексан
Физические и химические свойства алканов
Метан и его газообразные гомологи (до бутана включительно) содержатся в природном и попутном нефтяном газах. Жидкие алканы — основная часть нефти. Твёрдые предельные углеводороды (парафин) растворены в нефти, которая и служит источником их получения.
При обычных условиях алканы не реагируют с концентрированными кислотами и щелочами, не окисляются сильными окислителями, такими как перманганат калия.
Однако при нагревании химическое поведение алканов резко меняется. Все алканы горят бледно-голубым пламенем с образованием углекислого газа и воды:
Горение алканов сопровождается выделением большого количества теплоты, что определяет их использование в качестве топлива.
Следует помнить, что углеводороды относятся к пожаро- и взрывоопасным веществам. Утечка бытового газа грозит страшными последствиями. Для того чтобы вовремя обнаружить наличие в воздухе бытового газа, к нему добавляют вещества с резким неприятным запахом — одоранты. Если вы почувствовали на кухне, в подъезде или на улице запах газа, следует немедленно обратиться в экстренную службу по телефону 104, проветрить помещение и ни в коем случае не пользоваться открытым огнём или электроприборами. В случае пожара службу спасения вызывают по телефону 101 или 112 (с сотового телефона бесплатно).
Предельные углеводороды используют не только как топливо, но и в качестве сырья для химической промышленности, поскольку их свойства отнюдь не ограничиваются реакцией горения.
В предельных углеводородах атомы водорода могут замещаться другими атомами или группами, в частности атомами галогенов (хлора и брома). Эти реакции замещения протекают ступенчато при освещении смеси газов: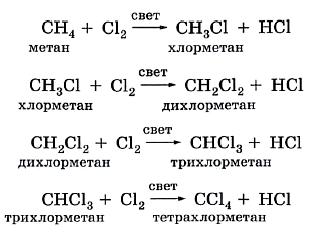
Галогенпроизводные алканов — прекрасные растворители, хладагенты (рабочие жидкости, которыми заправляют бытовые холодильники и промышленные холодильные установки), реагенты для органического синтеза.
Если предельные углеводороды нагревать без доступа воздуха при более высокой температуре, то они не выдерживают такого воздействия и разлагаются. Например, из метана при нагревании свыше 1000 °С образуется два ценных продукта — сажа (углерод) и водород:![]()
Сажу, полученную таким образом, используют для изготовления автомобильных шин и резины, она входит в состав красок и туши.
Алканы с неразветвлённой цепью углеродных атомов при нагревании превращаются в более устойчивые соединения с разветвлённой цепью. Например, из н-бутана можно получить изобутан:
Поскольку состав исходного вещества и продукта реакции одинаков, эти соединения являются изомерами. Именно поэтому такой процесс получил название реакция изомеризации.
При нагревании в присутствии катализатора алканы способны вступать в реакцию отщепления. Что же могут отщеплять молекулы предельных углеводородов? Если предположить, что углеродная цепь остаётся без изменения, то отщепляться могут только молекулы водорода.
| Реакцию, при которой от молекулы органического вещества отщепляется молекула водорода, называют реакцией дегидрирования. |
При дегидрировании этана образуются два продукта — этилен и водород:
Этилен С2Н4 — представитель непредельных углеводородов, о которых пойдёт речьПОЗЖЕ .
Тема: Применение алканов на основе свойств.
Области применения алканов связаны с их физико-химическими свойствами:
Таблица «Предельные углеводороды
(алканы, парафины)»










