ВТОРНИК,19.10.21 г. 206, 308,401, 403
МОЯ ЭЛЕКТРОННАЯ ПОЧТА: rimma.lu@gmail.com
ВНИМАНИЕ!!! ОЛИМПИАДА ПО БИОЛОГИИ И ХИМИИ!!! ЗАДАНИЯ НА ВКЛАДКЕ НАШЕГО САЙТА http://kka.zorinsk.net/index.php/obuchayushchimsya/olimpiadnye-zadaniya
ГРУППА 206 БИОЛОГИЯ 29, 30
ТЕМА: Дифференцировка клеток. Развитие взрослого организма.
При прямом развитии на свет появляется особь, похожая на взрослую, но значительно меньших размеров. Её дальнейшее развитие сводится главным образом к росту и половому созреванию.




- развитие организма во взрослую особь (ювенильный период) обычно проходит за более короткий промежуток времени;
- не происходит существенной перестройки организма, и поэтому требуется меньше энергии и питательных веществ.
- для осуществления эмбрионального развития требуется большое количество питательных веществ в яйцеклетках или внутриутробное развитие потомства;
- при перенаселении обостряется внутривидовая конкуренция между молодыми и зрелыми особями, так как им необходимы одинаковые жизненные ресурсы.
- у многих видов животных личинки и взрослые особи занимают разные экологические ниши — это снижает внутривидовую конкуренцию;
- у малоподвижных или прикреплённых животных личинки способствуют расселению вида, расширению его ареала.
- развитие во взрослую особь обычно занимает длительный промежуток времени;
- для метаморфоза требуется много пищи и энергии.
6)Онтогенез это а)период развития от зиготы до смерти б)развитие от рождения до старости в)психическая болезнь г)историческое развитие вида
7) Отцом эмбриологии является а)Дарвин б)МечникоКонтрольная работа по теме «Организм. Размножение и онтогенез»
Вариант №1
1). В процессе митоза образуется а)3 клетки б)ничего в)2 клетки г)4 клетки
2). Диплоидным набором хромосом называют а)двойной б)одинарный в)тройной г) полинабор
3) Гаметы это а) стволовые клетки б)половые клетки в)соматические клетки г)акробатические клетки
4)митоз происходит а) во всех клетках б)в половых в)в волосяных г)в природе нет такого явления
5) Вегетативное размножение это а)размножение семенами б)размножение спорами в)размножение бактериями г)частями растенияв в)Бэр г)Бор
8) Двойное оплодотворение у растений происходит а)в тычинках б)в пыльниках в)в пестике г)в чашелистиках
9) Наука, изучающая законы индивидуального развития организмов на стадии зародыша называется
а) эмбриология б) палеонтология в) экология г) генетика
10) Как называются подвижные мужские половые клетки а)яйцеклетки б)клетки со жгутиком в)сперматозоиды г)акросомы
Задания с развернутым ответом
1)Напишите о влиянии алкоголя на организм.
2)Напишите отличия бесполого размножения и полового.
3)Назовите три способа вегетативного размножения растений, приведите примеры
4)Дайте определение процессу оплодотворения.
ГРУППА 308 БИОЛОГИЯ 3,4
ТЕМА: ПРОИСХОЖДЕНИЕ ЧЕЛОВЕКА. БЛИЖАЙШИЕ "РОДСТВЕННИКИ" ЧЕЛОВЕКА.
Доказательство общности происхождения человека и животных
- Анатомическое сходство: общность плана строения органов и систем органов.
- Эмбриональное сходство: на ранних этапах зародыш человека трудно отличить от зародышей других позвоночных животных. В возрасте 1,5 — 3 месяцев у него имеются жаберные щели, а позвоночник оканчивается хвостом. Очень долго сохраняется сходство зародышей человека и обезьяны. Специфические (видовые) человеческие особенности возникают лишь на самых поздних стадиях развития.
- Рудименты — органы, находящиеся в редуцированном состоянии вследствие утраты функций. Рудиментов в теле человека около 90: копчиковая кость (хвостовые позвонки); складка в уголке глаза (остаток мигательной перепонки); тонкие волосы на теле (остаток шерсти); отросток слепой кишки — аппендикс и др.
- Атавизмы — органы, утраченные в процессе эволюции предковыми формами, но появившиеся у отдельного организма (одной особи): хвостатость, обильный волосяной покров на лице и теле, многососковость, сильно развитые клыки и др.
Происхождение человека
Антропогенез — раздел антропологии, изучающий происхождение человека.
По строению и физиологическим особенностям наиболее близкие родственники человека — человекообразные обезьяны: шимпанзе, горилла, орангутанг.
О близком родстве между человеком и человекообразными обезьянами свидетельствуют сходные детали строения:
- общий характер телосложения;
- редукция хвоста;
- хватательная кисть с плоскими ногтями и противопоставленным большим пальцем;
- форма глаз и ушей;
- зубная формула: одинаковое число резцов, клыков и коренных зубов;
- физиологическое сходство: общие группы крови, болезни и паразиты (например, головная вошь); генетическое сходство: диплоидное число хромосом (2n) у всех человекообразных обезьян — 48, у человека — 46. Различие в хромосомных числах обусловлено тем, что хромосома человека образована слиянием двух хромосом, гомологичных таковым у шимпанзе;
- сходство поведенческих реакций.
Однако между человеком и человекообразными обезьянами есть и коренные отличия:
- прямохождение и связанные с этим особенности строения: S-образный позвоночник с отчетливыми шейными и поясничными изгибами, низкий расширенный таз, уплощенная в спинно-брюшном направлении грудная клетка, сводчатая стопа с массивным приведенным большим пальцем, особенности мускулатуры и расположения внутренних органов;
- кисть человека способна выполнять самые разнообразные и высокоточные движения;
- череп человека более высокий и округленный, не имеет сплошных надбровных дуг; мозговая часть преобладает над лицевой, лоб высокий, челюсти слабые, с маленькими клыками, подбородочный выступ отчетливо выражен;
- мозг человека примерно в 2,5 раза больше мозга человекообразных обезьян. У человека сильно развита кора больших полушарий мозга, в которых расположены важнейшие центры психики и речи.
Предпосылки антропогенеза
Предполагается, что общими предками человекообразных обезьян и человека были стадные узконосые обезьяны, жившие на деревьях в тропических лесах.
Движущие силы антропогенеза
На ранних этапах антропогенеза решающую роль играли биологические факторы эволюции, в дальнейшем основной движущей силой стали социальные факторы.
| Биологические факторы | Социальные факторы |
|---|---|
| мутационная изменчивость | мышление |
| изоляция | звуковая сигнализация (на поздних этапах — речь) |
| дрейф генов | использование орудий труда |
| популяционные волны | общественный образ жизни |
| борьба за существование | использование огня |
| естественный отбор | творчество |
этапы антропогенеза
| Период (млн лет назад) | Этап | Характеристика |
| 60 | первые приматы | древесный образ жизни ключица вращательные движения в плечевом суставе |
| 25 | дриопитеки — общие предки 2 семейств: понгид, или антропоморфных обезьян (гиббон, горилла, орангутанг, шимпанзе), и гоминид (людей) | древесный образ жизни (кожный узор на подушечках пальцев) стадность |
| 3,5–4 | австралопитеки | мозг — до 550 куб. см прямохождение примитивные орудия труда (палки, камни, кости) стадность |
| 1,5–2,7 | человек умелый | мозг — 600 куб. см обрабатывают камни с целью изготовления орудий |
1,2–0,2 | архантропы (древнейшие люди): вид человек прямоходящий Подвиды: питекантроп (о. Ява) синантроп (Китай) гейдельбергский человек | мозг — до 1000 г жили в пещерах использовали огонь |
0,13–0,03 | палеоантропы (древние люди): неандертальцы | мозг — 1500 г зачаточная речь изготовление сложных орудий труда совершенствование речи и племенных отношений |
| 0,2–н. в. | неоантропы (современные люди): кроманьонцы человек разумный | членораздельная речь общественный труд одомашнивание растений и животных обряды |
Понгиды, оставаясь жить в лесу, сохранили древесный образ жизни. Предки же гоминид начали осваивать открытые пространства. Предпосылкой для такого перехода была уже приобретенная способность к наземному обитанию, использование различных предметов для добычи пищи и защиты, а значит, освобождение рук от участия в передвижении, развитие хождения на двух ногах.
ГРУППА 401 ХИМИЯ 13
ТЕМА:. Электронные конфигурации атомов химических элементов
Моделирование построения Периодической таблицы химических элементов.
Химия: Электронные конфигурации атомов химических элементов.
ЗАДАНИЕ СМ. ВНИЗУ.
Швейцарский физик В. Паули в 1925 г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского «веретено»), то есть обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемой оси: по часовой или против часовой стрелки. Этот принцип носит название принципа Паули.
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, то есть электроны с противоположными спинами.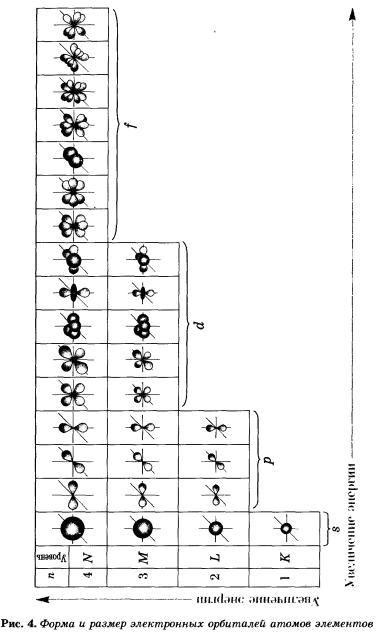
На рисунке 5 показана схема подразделения энергетических уровней на подуровни.
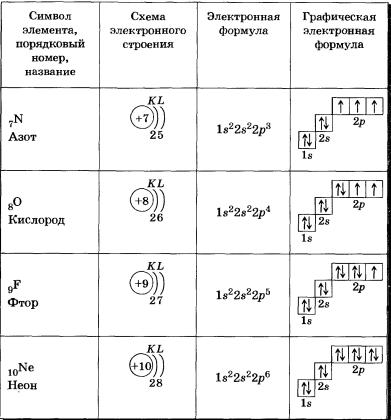
s-Орбиталь, как вы уже знаете, имеет сферическую форму. Электрон атома водорода (s = 1) располагается на этой ор-битали и неспарен. Поэтому его электронная формула или электронная конфигурация будет записываться так: 1s1. В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой (1 ...), латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа вверху от буквы (как показатель степени), показывает число электронов на подуровне.
Для атома гелия Не, имеющего два спаренных электрона на одной s-орбитали, эта формула: 1s2.
Электронная оболочка атома гелия завершена и очень устойчива. Гелий — это благородный газ.
На втором энергетическом уровне (n = 2) имеется четыре орбитали: одна s и три р. Электроны s-орбитали второго уровня (2s-орбитали) обладают более высокой энергией, так как находятся на большем расстоянии от ядра, чем электроны 1s-орбитали (n = 2).
Вообще, для каждого значения n существует одна s-орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере увеличения значения n.
р-Орбиталь имеет форму гантели или объемной восьмерки. Все три р-орбитали расположены в атоме взаимно перпендикулярно вдоль пространственных координат, проведенных через ядро атома. Следует подчеркнуть еще раз, что каждый энергетический уровень (электронный слой), начиная с n = 2, имеет три р-орбитали. С увеличением значения n электроны анимают р-орбитали, расположенные на больших расстояниях от ядра и направленные по осям х, у, г.
У элементов второго периода (n = 2) заполняется сначала одна в-орбиталь, а затем три р-орбитали. Электронная формула 1л: 1s22s1. Электрон слабее связан с ядром атома, поэтому атом лития может легко отдавать его (как вы, очевидно, помните, этот процесс называется окислением), превращаясь в ион Li+.
В атоме бериллия Ве0 четвертый электрон также размещается на 2s-орбитали: 1s22s2. Два внешних электрона атома бериллия легко отрываются — Ве0 при этом окисляется в катион Ве2+.
У атома бора пятый электрон занимает 2р-орбиталь: 1s22s22р1. Далее у атомов С, N, О, Е идет заполнение 2р-орбиталей, которое заканчивается у благородного газа неона: 1s22s22р6.
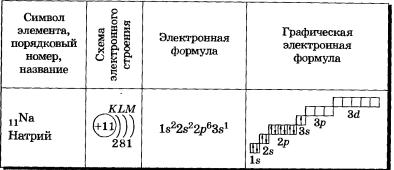
У элементов третьего периода заполняются соответственно Зв- и Зр-орбитали. Пять d-орбиталей третьего уровня при этом остаются свободными:
11Nа 1s22s2Зв1; 17С11в22822р63р5; 18Аг П^Ёр^Зр6.
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, то есть записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул.
У элементов больших периодов (четвертого и пятого) первые два электрона занимают соответственно 4я- и 5я-орбитали: 19К 2, 8, 8, 1; 38Sr 2, 8, 18, 8, 2. Начиная с третьего элемента каждого большого периода, последующие десять электронов поступят на предыдущие 3d- и 4d- орбитали соответственно (у элементов побочных подгрупп): 23V 2, 8, 11, 2; 26Tr 2, 8, 14, 2; 40Zr 2, 8, 18, 10, 2; 43Тг 2, 8, 18, 13, 2. Как правило, тогда, когда будет заполнен предыдущий d-подуровень, начнет заполняться внешний (соответственно 4р- и 5р ) р-подуровень.
У элементов больших периодов — шестого и незавершенного седьмого — электронные уровни и подуровни заполняются электронами, как правило, так: первые два электрона поступят на внешний в-подуровень: 56Ва 2, 8, 18, 18, 8, 2; 87Гг 2, 8, 18, 32, 18, 8, 1; следующий один электрон (у Nа и Ас) на предыдущий (p-подуровень:57Lа 2, 8, 18, 18, 9, 2 и 89Ас 2, 8, 18, 32, 18, 9, 2.
Затем последующие 14 электронов поступят на третий снаружи энергетический уровень на 4f- и 5f-орбитали соответственно у лантаноидов и актиноидов.
Затем снова начнет застраиваться второй снаружи энергетический уровень (d-подуровень): у элементов побочных подгрупп: 73Та 2, 8,18, 32,11, 2; 104Rf 2, 8,18, 32, 32,10, 2, — и, наконец, только после полного заполнения десятью электронами сйгоду-ровня будет снова заполняться внешний р-подуровень:
86Rn 2, 8, 18, 32, 18, 8.
Очень часто строение электронных оболочек атомов изображают с помощью энергетических или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки (орбитали), располагаются в них сначала по одному и имеют при этом одинаковое значение спина, а лишь затем спариваются, но спины при этом по принципу Паули будут уже противоположно направленными.
В заключение еще раз рассмотрим отображение электронных конфигураций атомов элементов по периодам системы Д. И. Менделеева. Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).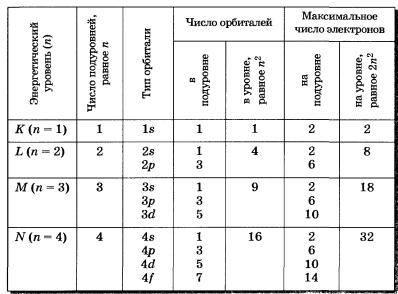
В атоме гелия первый электронный слой завершен — в нем 2 электрона.
Водород и гелий — s-элементы, у этих атомов заполняется электронами s-орбиталь.
Элементы второго периода
У всех элементов второго периода первый электронный слой заполнен и электроны заполняют е- и р-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала s-, а затем р ) и правилами Паули и Хунда (табл. 2).
В атоме неона второй электронный слой завершен — в нем 8 электронов.
Таблица 2 Строение электронных оболочек атомов элементов второго периода
Li, Ве — в-элементы.
В, С, N, О, F, Nе — р-элементы, у этих атомов заполняются электронами р-орбитали.
Элементы третьего периода
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать Зs-, 3р- и Зd-подуровни (табл. 3).
Таблица 3 Строение электронных оболочек атомов элементов третьего периода
У атома магния достраивается Зs-электронная орбиталь. Nа и Mg— s-элементы.
В атоме аргона на внешнем слое (третьем электронном слое) 8 электронов. Как внешний слой, он завершен, но всего в третьем электронном слое, как вы уже знаете, может быть 18 электронов, а это значит, что у элементов третьего периода остаются незаполненными Зd-орбитали.
Все элементы от Аl до Аг — р-элементы. s- и р-элементы образуют главные подгруппы в Периодической системе.
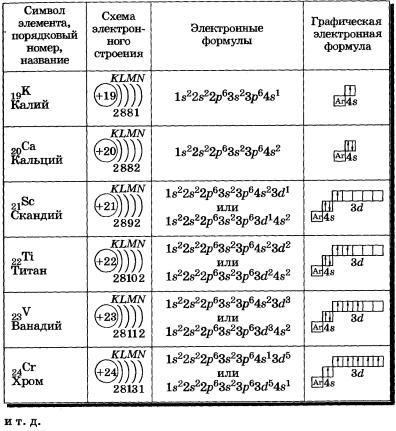
У атомов калия и кальция появляется четвертый электронный слой, заполняется 4s-подуровень (табл. 4), так как он имеет меньшую энергию, чем Зй-подуровень. Для упрощения графических электронных формул атомов элементов четвертого периода: 1) обозначим условно графическую электронную формулу аргона так:
Аr;
2) не будем изображать подуровни, которые у этих атомов не заполняются.
Таблица 4 Строение электронных оболочек атомов элементов четвертого периода
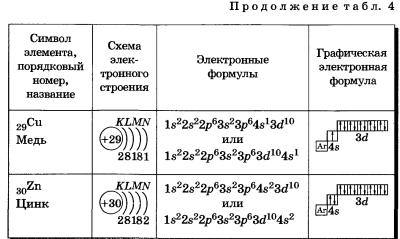
К, Са — s-элементы, входящие в главные подгруппы. У атомов от Sс до Zn заполняется электронами Зй-подуровень. Это Зй-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с 4я- на Зй-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций Зd5 и Зd10:
В атоме цинка третий электронный слой завершен — в нем заполнены все подуровни 3s, Зр и Зd, всего на них 18 электронов.
У следующих за цинком элементов продолжает заполняться четвертый электронный слой, 4р-подуровень: Элементы от Gа до Кr — р-элементы.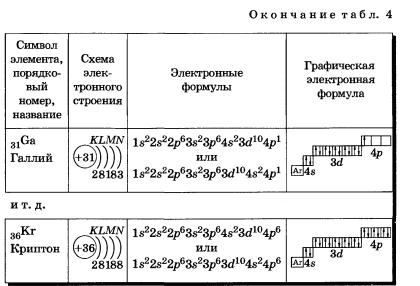
У атома криптона внешний слой (четвертый) завершен, имеет 8 электронов. Но всего в четвертом электронном слое, как вы знаете, может быть 32 электрона; у атома криптона пока остаются незаполненными 4d- и 4f- подуровни.
У элементов пятого периода идет заполнение подуровней в следующем порядке: 5s-> 4d -> 5р. И также встречаются исключения, связанные с «провалом» электронов, у 41Nb, 42MO и т.д.
В шестом и седьмом периодах появляются элементы, то есть элементы, у которых идет заполнение соответственно 4f- и 5f-подуровней третьего снаружи электронного слоя.
4f-Элементы называют лантаноидами.
5f-Элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: 55Сs и 56Ва — 6s-элементы;
57Lа... 6s25d1 — 5d-элемент; 58Се — 71Lu — 4f-элементы; 72Hf — 80Нg — 5d-элементы; 81Тl— 86Rn — 6р-элементы. Но и здесь встречаются элементы, у которых «нарушается» порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных f подуровней, то есть nf7 и nf14.
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, как вы уже поняли, делят на четыре электронных семейства или блока (рис. 7).
1) s-Элементы; заполняется электронами в-подуровень внешнего уровня атома; к s-элементам относятся водород, гелий и элементы главных подгрупп I и II групп;
2) р-элементы; заполняется электронами р-подуровень внешнего уровня атома; к р элементам относятся элементы главных подгрупп III—VIII групп;
3) d-элементы; заполняется электронами d-подуровень предвнешнего уровня атома; к d-элементам относятся элементы побочных подгрупп I—VIII групп, то есть элементы вставных декад больших периодов, расположенные между s- и р-элементами. Их также называют переходными элементами;
4) f-элементы, заполняется электронами f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и актиноиды.
ЗАДАНИЕ: ПРОЧИТАЙТЕ ВИМАТЕЛЬНО.
1. ПРЕПИШИТЕ И ВЫУЧИТЕ ПРАВИЛА ПАУЛИ И ХУНДА
2. Составьте схемы электронного строения, электронные формулы и графические электронные формулы атомов следующих химических элементов: Са, Fе, Zr, Sn, Nb, Hf, Ра.
ГРУППА 403 ХИМИЯ 16,17
ТЕМА: Ионные кристаллические решетки. Свойства веществ с ионным типом кристаллической решетки.
ИОННАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА.
Ионные кристаллические решетки. Свойства веществ с ионным типом кристаллической решетки
 Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью. Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов. Рассмотрим строение кристалла поваренной соли, в узлах которого находятся ионы хлора и натрия. Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью. Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов. Рассмотрим строение кристалла поваренной соли, в узлах которого находятся ионы хлора и натрия. |
Связи между ионами в кристалле очень прочные и устойчивые.Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи.
Вещества с ионной кристаллической решеткой обладают следующими свойствами:
1. Относительно высокой твердостью и прочностю;
2. Хрупкостью;
3. Термостойкостью;
4. Тугоплавкостью;
5. Нелетучестью.
Примеры: соли – хлорид натрия, карбонат калия, основания – гидрооксид кальция, гидрооксид натрия.
.
Химическая связь
Все взаимодействия, приводящие к объединению химических частиц (атомов, молекул, ионов и т. п.) в вещества делятся на химические связи и межмолекулярные связи (межмолекулярные взаимодействия).
Химические связи - связи непосредственно между атомами. Различают ионную, ковалентную и металлическую связь.
Межмолекулярные связи - связи между молекулами. Это водородная связь, ион-дипольная связь (за счет образования этой связи происходит, например, образование гидратной оболочки ионов), диполь-дипольная (за счет образования этой связи объединяются молекулы полярных веществ, например, в жидком ацетоне) и др.
Ионная связь - химическая связь, образованная за счет электростатического притяжения разноименно заряженных ионов. В бинарных соединениях (соединениях двух элементов) она образуется в случае, когда размеры связываемых атомов сильно отличаются друг от друга: одни атомы большие, другие маленькие - то есть одни атомы легко отдают электроны, а другие склонны их принимать (обычно это атомы элементов, образующих типичные металлы и атомы элементов, образующих типичные неметаллы); электроотрицательность таких атомов также сильно отличается.
Ионная связь ненаправленная и не насыщаемая.
Ковалентная связь - химическая связь, возникающая за счет образования общей пары электронов. Ковалентная связь образуется между маленькими атомами с одинаковыми или близкими радиусами. Необходимое условие - наличие неспаренных электронов у обоих связываемых атомов (обменный механизм) или неподеленной пары у одного атома и свободной орбитали у другого (донорно-акцепторный механизм):
| а) | H· + ·H | H-H | H2 | (одна общая пара электронов; H одновалентен); |
| б) | N | N2 | (три общие пары электронов; N трехвалентен); | |
| в) | H-F | HF | (одна общая пара электронов; H и F одновалентны); | |
| г) | NH4+ | (четыре общих пары электронов; N четырехвалентен) |
- По числу общих электронных пар ковалентные связи делятся на
- простые (одинарные) - одна пара электронов,
- двойные - две пары электронов,
- тройные - три пары электронов.
Двойные и тройные связи называются кратными связями.
По распределению электронной плотности между связываемыми атомами ковалентная связь делится на неполярную и полярную. Неполярная связь образуется между одинаковыми атомами, полярная - между разными.
Электроотрицательность - мера способности атома в веществе притягивать к себе общие электронные пары.
Электронные пары полярных связей смещены в сторону более электроотрицательных элементов. Само смещение электронных пар называется поляризацией связи. Образующиеся при поляризации частичные (избыточные) заряды обозначаются ![]() + и
+ и ![]() -, например:
-, например: ![]() .
.
По характеру перекрывания электронных облаков ("орбиталей") ковалентная связь делится на ![]() -связь и
-связь и ![]() -связь.
-связь.![]() -Связь образуется за счет прямого перекрывания электронных облаков (вдоль прямой, соединяющей ядра атомов),
-Связь образуется за счет прямого перекрывания электронных облаков (вдоль прямой, соединяющей ядра атомов), ![]() -связь - за счет бокового перекрывания (по обе стороны от плоскости, в которой лежат ядра атомов).
-связь - за счет бокового перекрывания (по обе стороны от плоскости, в которой лежат ядра атомов).
Ковалентная связь обладает направленностью и насыщаемостью, а также поляризуемостью.
Для объяснения и прогнозирования взаимного направления ковалентных связей используют модель гибридизации.