РАСПИСАНИЕ ЗАНЯТИЙ НА НЕДЕЛЮ: 23.01.23г.-27.01.23г.
Ср. 25.01: 406, 505, 401, ----
Пт. 27.01: 401, 505, ----, 501
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 505 БИОЛОГИЯ 13,14
ТЕМА 13,14:Биологическое окисление.Генетическая информация. Удвоение ДНК.
Биологическое окисление. Анаэробный этап клеточного дыхания.
И гетеротрофные, и автотрофные организмы способны получать энергию для обеспечения клеточных нужд (биосинтез различных веществ, транспорт и движение) путём окисления органических веществ. Для гетеротрофов окисление органических веществ является единственным способом получения энергии. Фотоавтотрофы используют энергию света для того, чтобы синтезировать сахара, а полученные сахара используются либо для синтеза других веществ и построения тела в ходе процессов анаболизма, либо как источник энергии в катаболизме. Фотосинтезирующие организмы расходуют свои запасы органических веществ случае отсутствия света, например, в темное время суток, а также в клетках, которые находятся в тех частях организма, куда не проникает свет.
суть биологического окисления
Окисление — это процесс отдачи веществом электронов окислителю. Окисление может происходить в ходе различных процессов:
- Отдача веществом только электронов. Такое окисление имеет место, например, при превращении
в составе цитохромов или же как реакция свободного железа при хемосинтезе. - Окислительно-восстановительные реакции органических веществ в клетках часто сопровождаются передачей не только электронов, но и атомов О или Н.
а) Поскольку атом О обладает большей электроотрицательностью, чем атом С, увеличение количества атомов кислорода в соединении считается окислением.
При этом степень окисления углерода в соединении увеличивается (электроны от него смещаются к кислороду,-заряд на атоме С увеличивается).
Пример — окисление альдегида до карбоновой кислоты.б) Поскольку связь С–Н гораздо менее полярная, чем С–О, степень окисления углерода в соединениях с большим количеством атомов Н меньше (менее положительная), чем в соединениях с меньшим количеством атомов Н (при наличии других электроотрицательных атомов — О, N…).
Поэтому окислением может называться отдача органическим веществом атомов водорода.
Пример — окисление спирта в альдегид.
переносчики водорода
Итак, биологическое окисление органических веществ часто происходит путем отдачи атомов водорода [H], то есть протонов
Таким образом, НАД переносит 2 электрона и 1 протон, второй протон выделяется в раствор. ФАД переносит 2 электрона и 2 протона.
Принимая на себя атомы водорода,
этапы окисления энергетических субстратов
Процесс катаболизма энергетических субстратов (органических веществ) протекает с выделением энергии. Он состоит из следующих этапов:
- Подготовительный этап идет в полости пищеварительной системы или — при внутриклеточном пищеварении — во вторичных лизосомах. При этом полимеры расщепляются на мономеры, которые можно перенести через мембрану в цитоплазму клеток (или сначала в кровь, а затем в тканевую жидкость и в цитоплазму). Расщепление катализируют литические ферменты. Например, амилазы и мальтазы расщепляют в тонком кишечнике крахмал до глюкозы.
Энергия на этом этапе выделяется в виде тепла, АТФ не образуется.
Основным источником энергии для многих клеток служит окисление глюкозы или других сахаров, поэтому рассматривается в первую очередь механизм окисления глюкозы, хотя и другие вещества могут окисляться с целью получения энергии (аминокислоты, жирные кислоты…).
Внутриклеточное окисление глюкозы включает два этапа:
а) анаэробный этап в цитоплазме — гликолиз. У анаэробов на этом окисление глюкозы заканчивается, так как нет молекулярного кислорода для дальнейшего окисления;
б) аэробный этап в митохондриях при участии молекулярного кислорода.
гликолиз
Первый этап внутриклеточного окисления углеводов осуществляется без участия кислорода и называется гликолиз (от «гликис» — сладкий, «лизис» — распад). Он происходит в цитоплазме.
На первых этапах гликолиза тратится две молекулы АТФ на фосфорилирование 1 молекулы сахара. Образующаяся гексоза (С6), несущая два остатка фосфорной кислоты, распадается на две фосфорилированные триозы (2*С3). Затем происходит окисление фосфотриозы (фосфорилированного C3-сахара — «половинки» глюкозы) до фосфоглицериновой кислоты (ФГК). Это окисление осуществляется путем отнятия двух атомов водорода и переноса их на
Образовавшаяся ФГК превращается далее в пировиноградную кислоту (ПВК), или пируват, при этом синтезируется еще две молекулы АТФ в расчете на 1 молекулу глюкозы. Таким образом, расщепление в гликолизе одной молекулы глюкозы дают в результате выигрыш в 2 молекулы АТФ. Пируват — это конечный продукт гликолиза.
В результате этого процесса в клетке будет накапливаться НАД∙Н, который необходимо снова превратить в
В условиях же бескислородной среды окисление НАДН до
Различают разные типы брожения:
а) Молочнокислое брожение. ПВК (пируват) превращается в молочную кислоту (лактат). Так происходит, например, при частых сокращениях мышц, когда поступление кислорода недостаточно, и основная часть АТФ получается за счет гликолиза. Накопление молочной кислоты является основным фактором усталости мышц. Аналогичный процесс происходит при росте ряда микроорганизмов в анаэробных условиях. Накапливающаяся при этом молочная кислота подавляет рост гнилостных бактерий и служит консервантом продуктов при приготовлении простокваши, йогурта, квашеной капусты, силоса на корм скоту.
б) Спиртовое брожение. Дрожжи на завершающем этапе гликолиза отщепляют от пировиноградной кислоты карбоксильную группу в форме углекислого газа, в результате чего образуется уксусный альдегид. Он восстанавливается путем переноса водородов с НАД∙Н до этилового спирта. На этом процессе основано пивоварение, виноделие, а также поднятие дрожжевого теста (за счет пузырьков образующегося углекислого газа).
ТЕМА: Генетическая информация. Удвоение ДНК.
1. ДНК — матрица для синтеза белков. Каким же образом в эритроцитах здорового человека образуются миллионы идентичных молекул гемоглобина, как правило, без единой ошибки в расположении аминокислот? Почему в эритроцитах больных серповидноклеточной анемией все молекулы гемоглобина имеют одну и ту же ошибку в одном и том же месте?
Для ответа на эти вопросы обратимся к примеру, с книгопечатанием. Учебник, который вы держите в руках, издан тиражом п экземпляров. Все п книг отпечатаны с одного шаблона — типографской матрицы, поэтому они совершенно одинаковы. Если бы в матрицу вкралась ошибка, то она была бы воспроизведена во всех экземплярах. Роль матрицы в клетках живых организмов выполняют молекулы ДНК. ДНК каждой клетки несет информацию не только о структурных белках, определяющих форму клетки (вспомните эритроцит), но и обо всех белках-ферментах, белках-гормонах и других белках.
Углеводы и липиды образуются в клетке в результате сложных химических реакций, каждая из которых катализируется своим белком-ферментом. Владея информацией о ферментах, ДНК программирует структуру и других органических соединений, а также управляет процессами их синтеза и расщепления.
Поскольку молекулы ДНК являются матрицами для синтеза всех белков, в ДНК заключена информация о структуре и деятельности клеток, о всех признаках каждой клетки и организма в целом.
Каждый белок представлен одной или несколькими полимерными цепями. Участок молекулы ДНК, служащий матрицей для синтеза одной полипептидной цепи, т. е. в большинстве случаев одного белка, называют геном. Каждая молекула ДНК содержит множество разных генов. Всю информацию, заключенную в молекулах ДНК, называют генетической. Идея о том, что генетическая информация записана на молекулярном уровне и что синтез белков идет по матричному принципу, впервые была сформулирована еще в 20-х годах выдающимся отечественным биологом Н. К. Кольцовым.
2. Удвоение ДНК. Молекулы ДНК обладают поразительным свойством, не присущим ни одной другой из известных молекул, — способностью к удвоению. Что представляет собой процесс удвоения? Вы помните, что двойная спираль ДНК построена по принципу комплементарности. Этот же принцип лежит в основе удвоения молекул ДНК. С помощью специальных ферментов водородные связи, скрепляющие нити ДНК, разрываются, нити расходятся, и к каждому нуклеотиду каждой из этих нитей последовательно пристраиваются комплементарные нуклеотиды. Разошедшиеся нити исходной (материнской) молекулы ДНК являются матричными — они задают порядок расположения нуклеотидов во вновь синтезируемой цепи. В результате действия сложного набора ферментов происходит соединение нуклеотидов друг с другом. При этом образуются новые нити ДНК, комплементарные каждой из разошедшихся цепей. Таким образом, в результате удвоения создаются две двойные спирали ДНК (дочерние молекулы), каждая из них имеет одну нить, полученную от материнской молекулы, и одну нить, синтезированную вновь.
Дочерние молекулы ДНК ничем не отличаются друг от друга и от материнской молекулы. При делении клетки дочерние молекулы ДНК расходятся по двум образующимся клеткам, каждая из которых вследствие этого будет иметь ту же информацию, которая содержалась в материнской клетке. Так как гены — это участки молекул ДНК, то две дочерние клетки, образующиеся при делении, имеют одинаковые гены.
Каждая клетка многоклеточного организма возникает из одной зародышевой клетки в результате многократных делений, поэтому все клетки организма имеют одинаковый набор генов. Случайно возникшая ошибка в гене зародышевой клетки будет воспроизведена в генах миллионов ее потомков. Вот почему все эритроциты больного серповидноклеточной анемией имеют одинаково «испорченный» гемоглобин. Дети, больные анемией, получают «испорченный» ген от родителей через их половые клетки. Информация, заключенная в ДНК клеток (генетическая информация), передается не только из клетки в клетку, но и от родителей к детям. Ген является единицей генетической, или наследственной, информации.
ГРУППА 501 ХИМИЯ 29,30
ТЕМА29,30: Электролитическая диссоциация. Электролиты и неэлектролиты. Механизмы электролитической диссоциации для веществ с различными типами химической связи. Гидратированные и негидратированные ионы.
Электролитическая диссоциация
Понятие электролитов впервые ввел М. Фарадей в первой половине XIX века. Согласно его определению:
Электролитами называют вещества, водные растворы или расплавы которых проводят электрический ток.
Опустим в стакан с водой графитовые стержни, присоединенные к источнику тока и связанные цепью с электрической лампой. При включении рубильника никаких видимых изменений не происходит. Это означает, что вода не проводит электрический ток, то есть не является электролитом. Внесем в стакан с водой поваренную соль – хлорид натрия,
Атомы и группы атомов, несущие электрический заряд, называют ионами. Положительно заряженные ионы называют катионами, отрицательно заряженные ионы - анионами.
Проведя дополнительный опыт, можно убедиться, что сухая поваренная соль не проводит электрический ток. Таким образом, можно сделать вывод, что свободные ионы появляются в расплаве и при растворении соли в воде.
Рассмотрим на атомарном уровне, что происходит с кристаллом поваренной соли при попадании его в воду. Соль – вещество с ионной кристаллической решеткой, в узлах которой расположены катионы натрия и анионы хлора. Они удерживаются друг около друга благодаря силам электростатического притяжения.
Молекула воды представляет собой диполь, так как на атомах водорода локализованы частичные положительные заряды, на на атоме кислорода – отрицательный.

В молекуле воды атомные орбитали кислорода находятся в
Для объяснения свойств водных растворов электролитов С. Аррениус в 1887 году предложил теорию электролитической диссоциации. Эта теория объясняла, почему растворы некоторых веществ проводят электрический ток, но не отвечала на вопрос, почему одни вещества являются электролитами, а другие - нет. Более подробно особенности поведения веществ в растворах описал Д.И. Менделеев, который экспериментально доказал, что при растворении электролитов происходит химическое взаимодействие между молекулами растворенного вещества и молекулами растворителя. Сущность процесса электролитической диссоциации было объяснено на основании природы химической ионной связи.
Согласно теории Д.И. Менделеева, электролитическая диссоциация молекул электролитов протекает в три стадии. Рассмотрим эти стадии на примере поваренной соли NaCl.
1. При попадании в воду, молекулы воды окружают кристаллы поваренной соли, притягиваясь к катионам натрия своими отрицательно заряженными концами, а к анионам хлора - положительно заряженными. Эта стадия называется ассоциация.
2. За счет электростатического взаимодействия, молекулы воды "растаскивают" молекулу электролита, связь между ионами в кристалле ослабевает и разрывается, то есть происходит непосредственно диссоциация (распад) молекул.
3. Диполи воды полностью окружают образовавшиеся при распаде ионы, катионы и анионы, образуя гидратную оболочку. Гидратированные ионы переходят в раствор.

В неводных растворах в качестве диполей может выступать не вода, а другой полярный растворитель, например, этанол. В таком случае ионы окружены молекулами растворителя (образуют сольватную оболочку) и называются сольватированными.
Ионы в водном растворе окружены молекулами воды, то есть имеют гидратную оболочку, и называются гидратированными.

Таким образом, описанный выше процесс можно описать уравнением:
где
В большинстве случаев этот процесс записывают упрощенно, не указывая гидратированное состояние ионов:
Процесс распада вещества на ионы при растворении в воде или расплавлении называют электролитической диссоциацией.
Электролитическая диссоциация состоит из двух одновременно протекающих обратных процессов: из диссоциации (распад молекул на ионы) и ассоциации (процесс образования молекул из ионов). Поэтому в уравнении электролитической диссоциации всегда ставят знак
В водных растворах диссоциации подвержены кислоты, сильные основания и растворимые соли:
При диссоциации происходит резкое увеличение числа частиц в растворе – это отличает растворы электролитов от растворов неэлектролитов. Именно поэтому растворы солей замерзают при более низкой температуре, чем растворы неэлектролитов.
Особенно сильно гидратирован ион водорода
Основные положения Теории электролитической диссоциации
Согласно теории электролитической диссоциации С. Аррениуса и Д. И. Менделеева можно сформулировать основные положения теории электролитической диссоциации (ТЭД):
- При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
- Электролитическая диссоциация - процесс обратимый (обратная реакция называется ассоциацией).
Степень электролитической диссоциации
Как электролиты, все вещества делятся на три класса.
а) Кислоты – это электролиты, которые диссоциируют на катионы водорода и анионы кислотного остатка. Например: HNO3 = H+ + NO3-; H2SO4 = 2H+ + SO42-.
б) Основания – это электролиты, которые диссоциируют на катионы металла и гидроксид-анионы. Например: KOH = K+ + OH-; Ba(OH)2 = Ba2+ + 2OH-.
в) Соли – это электролиты, которые диссоциируют на катионы металла (или аммония) и анионы кислотного остатка. Например: Fe(NO3)3 = Fe3+ + 3NO3-; AlCl3 = Al3+ + 3Cl-.
ГРУППА 306 БИОЛОГИЯ 26
ТЕМА 26: Образование половых клеток и оплодотворение.
Образование половых клеток. Мейоз
Вспомните!
Где в организме человека происходит образование половых клеток?
Какой набор хромосом содержат гаметы? Почему?
Для осуществления полового размножения необходимы специализированные клетки – гаметы, содержащие одинарный (гаплоидный) набор хромосом. При их слиянии (оплодотворении) происходит образование диплоидного набора, в котором каждая хромосома имеет пару – гомологичную хромосому. В каждой паре гомологичных хромосом одна хромосома получена от отца, а вторая – от матери.
У животных процесс образования половых клеток – гаметогенез – протекает в специальных органах – половых железах (гонадах). У большинства животных мужские половые клетки (сперматозоиды) образуются в семенниках, женские гаметы (яйцеклетки) – в яичниках. Развитие яйцеклеток называют овогенезом или оогенезом, а сперматозоидов – сперматогенезом.
Строение половых клеток.
Яйцеклетки – это относительно крупные неподвижные клетки округлой формы. У некоторых рыб, пресмыкающихся и птиц они содержат большой запас питательных веществ в виде желтка и имеют размеры от 10 мм до 15 см. Яйцеклетки млекопитающих, в том числе и человека, гораздо мельче (0,1–0,3 мм) и желтка практически не содержат.
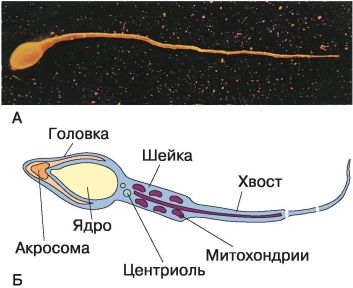
Рис. 63. Сперматозоид млекопитающего: А – электронная фотография; Б – схема строения
Сперматозоиды впервые были описаны голландским естествоиспытателем А. Левенгуком в 1677 г. Он же и ввёл этот термин – сперматозоид (от греч. sperma – семя и zoon – живое существо), т. е. живое семя. Яйцеклетка млекопитающих была открыта в 1827 г. российским учёным К. М. Бэром.
Образование половых клеток. Развитие половых клеток подразделяют на несколько стадий: размножение, рост, созревание, а в процессе сперматогенеза выделяют ещё и стадию формирования (рис. 64).
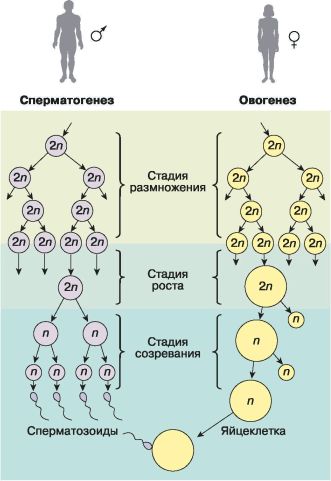
Рис. 64. Гаметогенез у человека
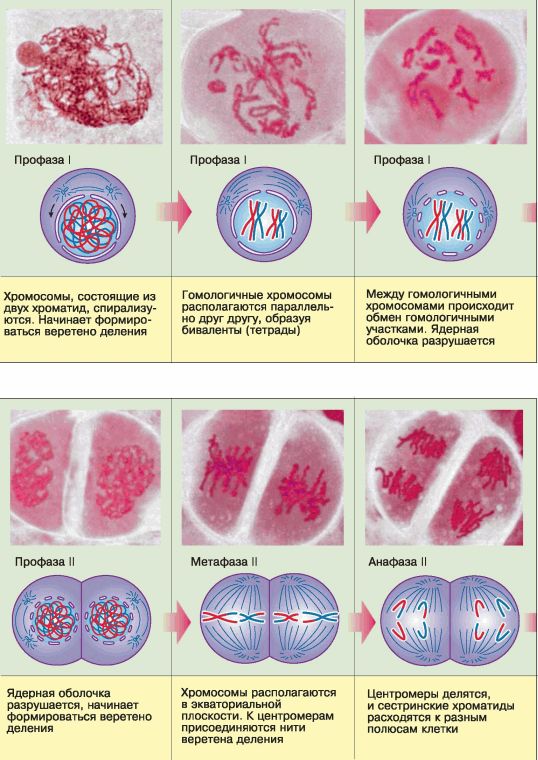
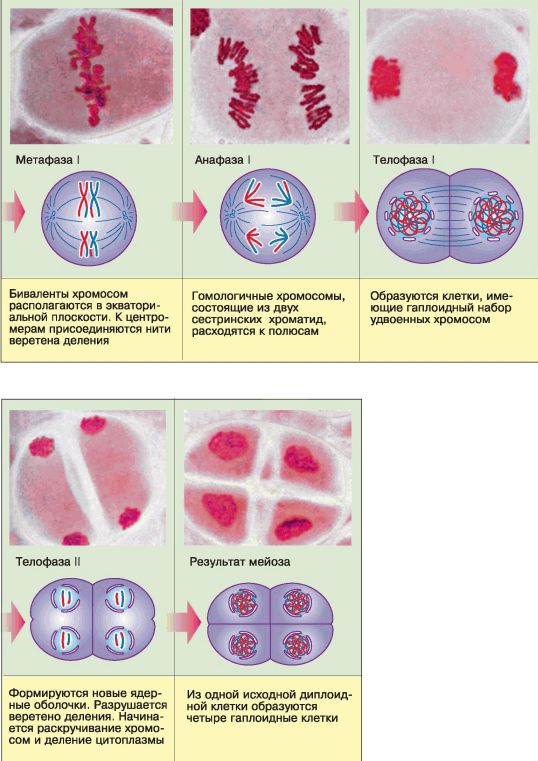
Рис. 65. Фазы мейоза
Стадия размножения. На этой стадии клетки, формирующие стенки половых желёз, активно делятся митозом, образуя незрелые половые клетки. Эта стадия у мужчин начинается с наступлением половой зрелости и продолжается почти всю жизнь. У женщин образование первичных половых клеток завершается ещё в эмбриональном периоде, т. е. общее количество яйцеклеток, которые у женщины будут созревать в течение её репродуктивного периода, определяется уже на ранней стадии развития женского организма. На стадии размножения первичные половые клетки, как и все остальные клетки тела, диплоидны.
Стадия роста. На стадии роста, которая гораздо лучше выражена в овогенезе, происходит увеличение цитоплазмы клеток, накопление необходимых веществ и редупликация ДНК (удвоение хромосом).
Стадия созревания. Третья стадия – это мейоз. Мейоз – это особый способ деления клеток, приводящий к уменьшению числа хромосом вдвое и к переходу клетки из диплоидного состояния в гаплоидное.
Будущие гаметы на стадии созревания делятся дважды. Клетки, приступающие к мейозу, содержат диплоидный набор уже удвоенных хромосом. В процессе двух мейотических делений из одной диплоидной клетки образуются четыре гаплоидные.
Мейоз состоит из двух последовательных делений, которым предшествует однократное удвоение ДНК, осуществлённое на стадии роста. В каждом делении мейоза выделяют четыре фазы, характерные и для митоза (профазу, метафазу, анафазу, телофазу), однако они отличаются некоторыми особенностями (рис. 65).
Профаза первого мейотического деления (профаза I) значительно длиннее, чем профаза митоза. В это время удвоенные хромосомы, каждая из которых состоит уже из двух сестринских хроматид, спирализуются и приобретают компактные размеры. Затем гомологичные хромосомы располагаются параллельно друг другу, образуя так называемые биваленты или тетрады, состоящие из двух хромосом (четырёх хроматид). Между гомологичными хромосомами может произойти обмен соответствующими гомологичными участками (кроссинговер), что приведёт к перекомбинации наследственной информации и образованию новых сочетаний отцовских и материнских генов в хромосомах будущих гамет (рис. 66).
К концу профазы I ядерная оболочка разрушается.
В метафазе I гомологичные хромосомы попарно в виде бивалентов, или тетрад, располагаются в экваториальной плоскости клетки, и к их центромерам присоединяются нити веретена деления.
В анафазе I гомологичные хромосомы из бивалента (тетрады) расходятся к полюсам. Следовательно, в каждую из двух образующихся клеток попадает только одна из каждой пары гомологичных хромосом – число хромосом уменьшается в два раза, хромосомный набор становится гаплоидным. Однако каждая хромосома при этом всё ещё состоит из двух сестринских хроматид.
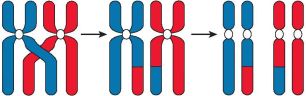
Рис. 66. Перекрёст хромосом и обмен гомологичными участками
В телофазе I образуются клетки, имеющие гаплоидный набор хромосом и удвоенное количество ДНК.
Спустя короткий промежуток времени клетки приступают ко второму мейотическому делению, которое протекает как типичный митоз, но отличается тем, что участвующие в нём клетки гаплоидны.
В профазе II разрушается ядерная оболочка. В метафазе II хромосомы выстраиваются в экваториальной плоскости клетки, нити веретена деления соединяются с центромерами хромосом. В анафазе II центромеры, соединяющие сестринские хроматиды, делятся, хроматиды становятся самостоятельными дочерними хромосомами и расходятся к разным полюсам клетки. Телофаза II завершает второе деление мейоза.
В результате мейоза из одной исходной диплоидной клетки, содержащей удвоенные молекулы ДНК, образуется четыре гаплоидные клетки, каждая хромосома которых состоит из одиночной молекулы ДНК.
При сперматогенезе на стадии созревания в результате мейоза образуется четыре одинаковые клетки – предшественники сперматозоидов, которые на стадии формирования приобретают характерный вид зрелого сперматозоида и становятся подвижными.
Мейотические деления в овогенезе характеризуются рядом особенностей. Профаза I завершается ещё в эмбриональном периоде, т. е. к моменту рождения девочки в её организме уже имеется полный набор будущих яйцеклеток. Остальные события мейоза продолжаются только после полового созревания женщины. Каждый месяц в одном из яичников у женщины продолжает развитие одна из остановившихся в своем делении клеток. В результате первого деления мейоза образуется крупная клетка – предшественник яйцеклетки и маленькое, так называемое полярное, тельце, которые вступают во второе деление мейоза. На стадии метафазы II предшественница яйцеклетки овулирует, т. е. выходит из яичника в брюшную полость, откуда попадает в яйцевод. Если происходит оплодотворение, второе мейотическое деление завершается – образуется зрелая яйцеклетка и второе полярное тельце. Если слияния со сперматозоидом не происходит, не закончившая деление клетка погибает и выводится из организма.
Полярные тельца служат для удаления избытка генетического материала и перераспределения питательных веществ в пользу яйцеклетки. Спустя некоторое время после деления они погибают.
Значение гаметогенеза. В результате гаметогенеза образуются половые клетки, содержащие гаплоидный набор хромосом, что позволяет при оплодотворении восстанавливать число хромосом, характерное для вида. В отсутствие мейоза слияние гамет приводило бы к удвоению числа хромосом у каждого последующего поколения, возникающего в результате полового размножения. Этого не происходит благодаря существованию особого процесса – мейоза, во время которого диплоидное число хромосом (2n) сокращается до гаплоидного (1n). Таким образом, биологическая роль мейоза заключается в поддержании постоянства числа хромосом в ряду поколений вида.
Вопросы для повторения и задания
1. Сравните строение мужских и женских половых клеток. В чём их сходство и отличия?
2. От чего зависит размер яйцеклеток? Объясните, почему яйцеклетки млекопитающих – одни из самых мелких.
3. Какие периоды выделяют в процессе развития половых клеток?
4. Расскажите, как протекает период созревания (мейоз) в процессе сперматогенеза; овогенеза.
5. Перечислите отличия мейоза от митоза.
6. В чём заключается биологический смысл и значение мейоза?
Подумайте! Выполните!
1. Организм развился из неоплодотворённой яйцеклетки. Являются ли его наследственные признаки точной копией признаков материнского организма?
2. Объясните, почему для обозначения мужских половых клеток существует два термина: спермии (например, у покрытосеменных растений) и сперматозоиды.
ГРУППА 508 ХИМИЯ 24,25
ТЕМА 24,25:Правило Марковникова.
Правило Марковникова. При присоединении галогеноводородов и воды к алкенам атом водорода присоединяется к более гидрогенизированному атому углерода двойной связи.
Интересно знать
Правило Марковникова носит имя его первооткрывателя — русского химика Владимира Васильевича Марковникова, ученика А. М. Бутлерова. В. В. Марковников внёс значительный вклад в развитие положений теории строения органических соединений, касающихся изомерии и взаимного влияния атомов в молекулах органических веществ. В. В. Марковников открыл циклоалканы в составе кавказских нефтей, известны его работы по исследованию состава соляных источников и соляных озер России.
Объяснение правила Марковникова. Электронодонорные и электроноакцепторные заместители
Правило Марковникова объясняется влиянием заместителей на электроны π-связи. По этому признаку все заместители можно разделить на две группы:
1. Заместители, которые притягивают электроны π-связи. Такие заместители называются электроноакцепторными (от англ. to accept — принимать). Примеры электроноакцепторных заместителей: карбоксильная группа COOH и нитрогруппа
NO2. Смещение электронов π-связи под действием электроноакцепторного заместителя показано на рисунке 15-1.2:
2. Заместители, которые отталкивают электроны π-связи (электронодонорные заместители). К электронодонорным заместителям относятся алкильные радикалы CH3,
C2H5 и др., гидроксильная группа
OH и аминогруппа
NH2. Смещение электронов π-связи под действием электронодонорного заместителя показано на рисунке 15-1.3:
Рассмотрим присоединение хлороводорода к пропену с учётом влияния заместителей на электроны π-связи:
Положительно заряженный атом водорода молекулы хлороводорода присоединяется к атому углерода двойной связи, несущему отрицательный заряд. Этим атомом углерода является более гидрогенизированный атом C(1), что соответствует правилу Марковникова.
Присоединение галогеноводородов и воды к несимметричным алкенам протекает по правилу Марковникова — водород присоединяется к более гидрогенизированному атому углерода двойной связи.
Правило Марковникова объясняется влиянием заместителей на электроны π-связи. Электроноакцепторные заместители ( COOH,
NO2) притягивают электроны π-связи, электронодонорные (алкильные радикалы,
OH,
NH2) – отталкивают.
Правило, устанавливающее направление реакции присоединения галогеноводородов (гидрогалогенирование) и воды (гидратация), сформулировал русский химик В.В. Марковников в 1869 г.
Правило Марковникова о присоединении по двойной связи объясняется смещением электронной плотности в молекулах несимметричных алкенов.
Механизм присоединения по правилу Марковникова
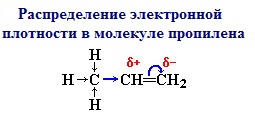
Электронная плотность в молекуле СН3-СН=СН2 до вступления в реакцию распределена неравномерно. Это обусловлено тем, что метильная группа СН3 за счет суммирования небольшой полярности трех С-Н-связей является донором электронов, т.е. проявляет +I-эффект ссылка по отношению к соседним атомам углерода.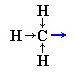
Это вызывает смещение подвижности π-электронов двойной связи в сторону более гидрогенизированного атома углерода и появлению на нем частичного отрицательного заряда (δ-).
На другом, менее гидрогенизированном, атоме углерода возникает частичный положительный заряд (δ+). Поэтому атака электрофильной частицы Н+ происходит по более гидрогенизированному углеродному атому, а атом галогена или группа –ОН присоединяются к менее гидрогенизированному атому углерода.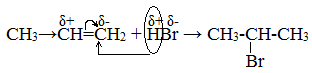
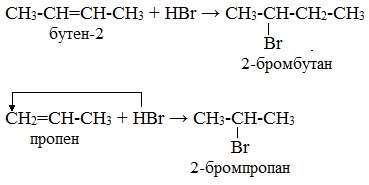
Например, гидробромирование бутена-2 и пропена:
Бутен-2 является симметричным алкеном, оба углеродных атома относительно двойной связи совершенно равноценны. В результате первой реакции образуется один продукт – 2-бромбутан.
Пропен – несимметричный алкен. Один углеродный атом при двойной связи более гидрогенизирован, т.е. содержит большее число атомов водорода. Поэтому продуктом реакции является 2-бромпропан.
Присоединение воды к несимметричным алкенам также происходит по правилу Марковникова.
Например, гидратация пропена и бутена-1: 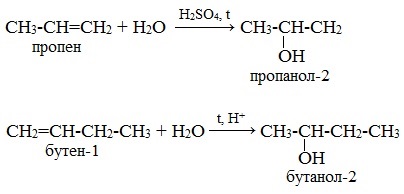
В результате гидратации пропена образуется пропанол-2, а не пропанол-1. А в результате гидратации бутена-1 – бутанол-2, а не бутанол-1.
Если же в алкене присутствует электроноакцепторный заместитель, т.е. группа, обладающая способностью оттягивать на себя электронную плотность, более стабильным может оказаться первичный катион и реакция пойдет против правила Марковникова, например гидрогалогенирование трифторпропена.
Практическая работа №2. Получение этилена и изучение его свойств.
Практическая работа №2. Получение этилена и изучение его свойств.
Цель: научиться получать в лаборатории этилен; изучить физические и химические свойства этилена.
Оборудование: пробирки, пробка с газоотводной трубкой, штатив, спиртовая горелка, спички.
Реактивы: C2H5OH, H2SO4(конц.), песок, бромная вода (Br2), KMnO4.
Ход работы
С правилами техники безопасности ознакомлен(а) и обязуюсь их выполнять.
В пробирку налили 1 мл этилового спирта и осторожно добавьте 6—9 мл концентрированной серной кислоты. Затем всыпали немного прокаленного песка (чтобы предотвратить толчки жидкости при кипении). Закрыли пробирку пробкой с газоотводной трубкой, закрепили ее в штативе и осторожно нагрели содержимое пробирки.

В пробирке начинается выделяться газ - этилен.
С2H5OH C2H4↑ + H2O.
В ходе реакции концентрированная серная кислота забирает воду из спирта, врезультате образуется этилен.
Такую реакцию называют – реакция дегидратации.
2.
Изучение свойств этилена.
В другую пробирку налили 2-3 мл бромной воды. Опустили газоотводную трубку первой пробирки до дна пробирки с бромной водой и пропускали через неё выдедяющийся газ.

При пропускании газа через бромную воду, происходит обесцвечивание бромной воды.
H2C=CH2 + Br2 → CH2Br – CH2Br
В ходе реакции происходит окисление этилена бромной водой по двойной связи.
В третью пробирку налили 2-3 мл разбавленного раствора KMnO4, поодкисленного серной кислотой, и пропустили через него газ.

При пропускании газа через подкисленный раствор KMnO4, происходит обесцвечивание раствора KMnO4.
5C2H4+12KMnO4+18H2SO4→10CO2+6K2SO4+
+12MnSO4+28H2O.
В ходе реакции происходит окисление этилена подкисленным раствором перманганата калия.
Выделяющиеся газ первой пробирки подожгли.

Этилен на воздухе горит ярким светящимся пламенем.
С2Н4 + 3О2 → 2СО2+2Н2О.
Этилен горит ярким светящимся пламенем, что доказывает наличие кратных связей.
Вывод: на данной практической работе мы научились получать в лаборатории этилен реакцией дегидратации спиртов; изучили химические свойства этилена, а именно, действие этилена на бромную воду и подкисленный раствор перманганата калия.