|
ССЫЛКА: ПРАКТИЧЕСКАЯ РАБОТА №__
«Решение экспериментальных задач на получение и распознавание органических веществ"
ПРАКТИЧЕСКАЯ РАБОТА
Решение экспериментальных задач на получение и распознавание неорганических веществ
Цель работы: повторить основные качественные реакции органических веществ, научиться решать экспериментальные задачи на распознавание органических веществ.
Реактивы и оборудование: раствор KMnO4(розовый), Аммиачный раствор оксида серебра – реактив Толленса[Ag(NH3)2]OH (упрощённо +Ag2O NH3 раствор→), раствор FeCl3(светло-жёлтый), свежеосаждённый гидроксид меди (II) в сильнощелочной среде, лакмус, фенолфталеин, насыщенный раствор соли кальция.
Литература: Г.Е.Рудзитис, Ф.Г.Фельдман, химия 10 класс, стр.149
С правилами по технике безопасности ознакомлен:______________________(подпись)
Ход работы:
Оформить работу в виде отчетной таблицы.
Отчетная таблица
Что делали | Что наблюдали | Уравнения реакций | Выводы |
|
|
|
|
|
|
|
1.Распознавание уксусной кислоты (уксусная кислота –одна из самых древних кислот ,которую удалось выделить и использовать человечеству. В организме человека за сутки образуется до 400 грамм этой кислоты)
СuSО4 + 2NаОН → | Сu(ОН)2 ↓ | + Nа2SО4 |
голубой осадок |
2СН3 – СООН + Сu(ОН)2 → (СН3 – СОО)2Сu + Н2О
Получить свежеосажденный гидроксид меди. Прилить к нему 1 – 2 мл этанола. Голубой осадок растворяется, образуя раствор такого же цвета.
2. Распознавание глюкозы
СuSО4 + 2NаОН → | Сu(ОН)2 ↓ | + Nа2SО4 |
голубой осадок |
СН2ОН – (СНОН)4 – СНО + 2Сu(ОН)2 ![]() СН2ОН – (СНОН)4 – СООН + Сu2О↓ +2Н2О
СН2ОН – (СНОН)4 – СООН + Сu2О↓ +2Н2О
К 1 – 2 мл глюкозы прилить свежеосажденный гидроксид меди. Сначала осадок растворяется, затем при нагревании раствор приобретает окраску от красной до желто – оранжевой. Это свидетельствует о наличии в исследуемой жидкости глюкозы.
3. Распознавание глицерина(глицерин входит в состав мазей, в пищевой промышленности глицерин под кодом Е-422).
2СН2ОН – СНОН – СН2ОН + Сu(ОН)2 → глицерат меди (II) + 2Н2О
К 2 мл глицерина прилить свежеосажденный гидроксид меди. Раствор окрашивается в ярко – синий цвет в результате образования комплексного соединения глицерата меди (II).
4. Распознавание сахарозы. Сахар-сложное орган.в-во, содержащее много С. Чтобы доказать возьмем немного сахара и добавим к нему серную кислоту. Она забирает воду, получается свободный углерод(черное в-во) С12Н22О11-----серн.к-та------------12С+11Н2О
5.Распознавание крахмала. Капнем р-ром иода на картофель и белый хлеб. Если образуется синее пятно, то они содержат крахмал.
6. Определение кислотности р-ров глицерина и мыла с помощью имеющихся индикаторов.
(лакмус, фенолфталеин,метилоранж). Глицерин имеет слабокислую среду, а мыло-щелочную.
Общий вывод(на основе цели)!
(((
1. Распознавание уксусной кислоты (уксусная кислота – одна из самых древних кислот, которую удалось выделить и использовать человечеству. В организме человека за сутки образуется до 400 грамм этой кислоты) СuSО4 + 2NаОН →Сu(ОН)2 ↓+ Nа2SО4
2СН3 – СООН + Сu(ОН)2 → (СН3 – СОО)2Сu + Н2О
Получить свежеосажденный гидроксид меди. Прилить к нему 1 – 2 мл этанола. Голубой осадок растворяется, образуя раствор такого же цвета.
2. Распознавание глюкозы
СuSО4 + 2NаОН → Сu(ОН)2 ↓ + Nа2SО4
СН2ОН – (СНОН)4 – СНО + 2Сu(ОН)2 СН2ОН – (СНОН)4 – СООН + Сu2О↓ +2Н2О
К 1 – 2 мл глюкозы прилить свежеосажденный гидроксид меди. Сначала осадок растворяется, затем при нагревании раствор приобретает окраску от красной до желто – оранжевой. Это свидетельствует о наличии в исследуемой жидкости глюкозы.
3. Распознавание глицерина (глицерин входит в состав мазей, в пищевой промышленности глицерин под кодом Е-422).
2СН2ОН – СНОН – СН2ОН + Сu(ОН)2 → глицерат меди (II) + 2Н2О
К 2 мл глицерина прилить свежеосажденный гидроксид меди. Раствор окрашивается в ярко – синий цвет в результате образования комплексного соединения глицерата меди (II).
4. Распознавание сахарозы. Сахар-сложное орган. в-во, содержащее много С. Чтобы доказать возьмем немного сахара и добавим к нему серную кислоту. Она забирает воду, получается свободный углерод (черное в-во) С12Н22О11---серн.к-та--12С+11Н2О
5. Распознавание крахмала. Капнем р-ром иода на картофель и белый хлеб. Если образуется синее пятно, то они содержат крахмал.
6. Определение кислотности р-ров глицерина и мыла с помощью имеющихся индикаторов.
(лакмус, фенолфталеин,метилоранж). Глицерин имеет слабокислую среду, а мыло-щелочную.)))_
Влияние различных факторов на скорость химической реакции.
Цель: рассмотреть влияние различных факторов на скорость химической реакции.
Оборудование и реактивы: пробирки, спиртовка, держатель, штатив для пробирок, цинк, магний, железо: гранулы и порошок, растворы серной (1:5, 1:10) и соляной кислоты, пероксид водорода, оксид марганца (IV), оксид меди (II).
Ход работы:
Вспомните правила техники безопасности при выполнении химического эксперимента.
Ø Многие вещества при попадании на кожу могут вызвать ожоги. Никогда не берите вещества руками.
Ø Некоторые вещества имеют неприятный запах, а их пары могут вызвать отравление. Не подносите близко к лицу открытую склянку.
Ø В химической лаборатории не пробуют на вкус даже известные вещества, они могут содержать примеси, ядовитые для человека.
Ø Кислоты – едкие вещества. Разрушают и раздражают кожу, слизистые оболочки.
Ø Если кислота или щёлочь попала на кожу, её надо немедленно промыть большим количеством проточной воды.
Ø Если зажечь спиртовку сразу же после снятия колпачка, загорается плёнка спирта на горлышке спиртовки как раз на том месте, где колпачок прилегает к горлышку. Пламя проникает под диск с трубкой, и пары спирта внутри резервуара загораются. Может произойти взрыв и выброс диска вместе с фитилём. Чтобы избежать этого, приподнимите на несколько секунд диск с фитилём для удаления паров. Если случится воспламенение паров, быстро отставьте в сторону предметы (тетрадь для практических работ) и позовите учителя.
Ø Зажигать спиртовку только спичками, гасить крышкой или колпачком, накрывая сверху.
Ø Запрещается передавать зажжённую спиртовку и зажигать одну спиртовку от другой.
Ø При нагревании вещества в пробирке её необходимо сначала прогреть, отверстие пробирки во время нагревания должно быть направлено от себя и соседа.
Ø Стекло – хрупкий материал, имеющий малое сопротивление при ударе и незначительную прочность при изгибе. Категорически запрещается использовать посуду, имеющую трещины и отбитые края.
Ø Пробирку закрепляют в держателе так, чтобы от горлышка пробирки до держателя было расстояние 1 – 1, 5 см.
Ø Опыты проводить с таким количеством веществ, которые указаны в методическом руководстве по проведению каждого опыта.
Ø Без разрешения учителя, ничего на столах не трогать.
Ø Во время проведения эксперимента или оформлении отчёта соблюдайте тишину.
Ø После работы приведи порядок на рабочем месте.
ХОД РАБОТЫ.
Рассматриваемый фактор, влияющий на скорость хим. реакции | Описание эксперимента | Наблюдения, позволяющие судить о скорости реакции | Уравнения реакций | Вывод |
Опыт 1. Влияние природы реагирующих веществ. | Налейте в три пробирки по 2 мл раствора соляной кислоты. Положите в первый стакан кусочек магния, во второй стакан - гранулу цинка, в третий – кусочек железа. Наблюдайте скорость трех реакций. Какая из реакций самая быстрая и почему? | Выделение газа наиболее бурно происходит в пробирке с магнием. | Мg + 2HCl → MgCl2 +H2↑ Zn + 2HCl → ZnCl2 + H2↑ Fe + 2HCl → FeCl2 + H2↑ | Скорость химической реакции зависит от природы реагирующих веществ. Магний обладает наиболее сильными восстановительными свойствами. |
Опыт 2. Влияние концентрации реагирующих веществ. | В две пробирки, наклонив их, опустите по грануле цинка, осторожно прилейте растворы серной кислоты: в первую пробирку раствор кислоты 1:5, во вторую – 1:10. В какой из них реакция идет быстрее? | В первой пробирке газ выделяется более интенсивно. | Zn + H2SO4 → ZnSO4 + H2↑ | Чем выше концентрация реагирующих веществ, тем чаще столкновения их частиц и тем выше скорость химической реакции. |
Опыт 3. Влияние площади соприкосновения реагирующих веществ. | В одну пробирку насыпьте немного порошка железа, в другую – положите железную скрепку и в обе пробирки прилить по 2 мл разбавленной соляной кислоты (1:2). В какой из пробирок реакция идет быстрее? Почему? | Выделение газа идет быстрее в пробирке с порошком железа. | Fe + 2HCl → FeCl2 + H2↑ | Чем больше площадь соприкосновения реагирующих веществ, тем выше скорость химической реакции. |
Опыт 4. Влияние температуры. | В две пробирки поместите немного черного порошка оксида меди (II), прилейте в обе пробирки раствор серной кислоты. Одну из пробирок нагрейте. В какой из пробирок реакция идет быстрее? Почему? | Растворение оксида меди (II) и образование раствора голубого цвета идет быстрее при нагревании. |
СuO + H2SO4 CuSO4 + H2O | При повышении температуры возрастает скорость движения частиц и скорость химической реакции. |
Опыт 5. Влияние катализатора. | В две пробирки налейте по 2 мл пероксида водорода Н2О2, в одну из пробирок добавьте несколько кристалликов оксида марганца (IV) MnO2. В какой из пробирок реакция идет быстрее? Почему? | В присутствии оксида марганца (IV) происходит бурное выделение пузырьков газа. |
2Н2О2 2Н2О + О2↑ | Оксид марганца (IV) – катализатор, ускоряет реакцию разложения пероксида водорода. |
Вывод: Скорость химической реакции зависит от условий: от природы реагирующих веществ, от площади соприкосновения, от концентрации, от температуры, от присутствия катализаторов.
ПРАКТИЧЕСКАЯ РАБОТА №2 |
Получение, собирание и распознавание газов.
Задачи
1
Условие:
Получение, собирание и распознавание водорода.
Решение:
При добавлении к цинку соляной кислоты наблюдается выделение бесцветного газа — водорода.
При поднесении к спиртовке слышен свистящий звук. Следовательно, водород не чистый, а смешан с воздухом.
Водород собирают в перевернутую пробирку, т. к. он легче воздуха.
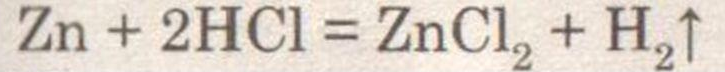
2
Условие:
Получение, собирание и распознавание кислорода.
Решение:
При добавлении оксида марганца (IV) пероксид водорода бурно разлагается.
При внесении в пробирку тлеющей лучинки, она разгорается, что свидетельствует о наличии кислорода.
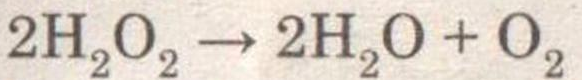
3
Условие:
Получение, собирание и распознавание углекислого газа.
Решение:
При добавлении раствора уксусной кислоты к мрамору (мелу) наблюдается бурное выделение углекислого газа.
При внесении в пробирку горящей лучины, она гаснет.
При пропускании углекислого газа через раствор известковой воды она мутнеет, а потом вновь становится прозрачной.
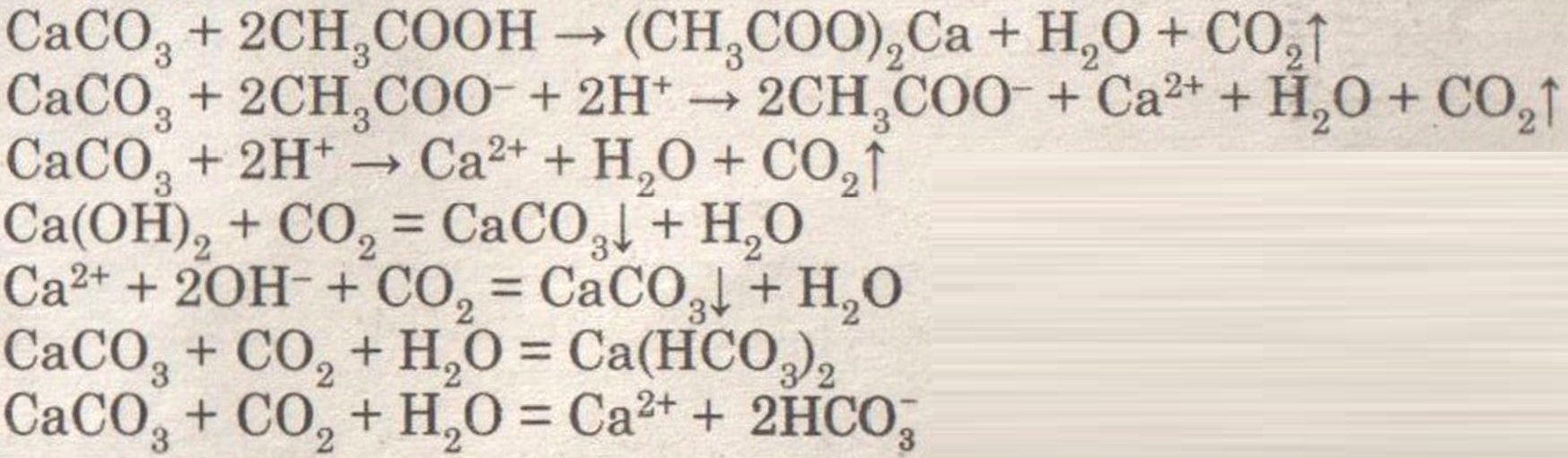
4
Условие:
Получение, собирание и распознавание аммиака.
Решение:
Ощущается запах аммиака.
Влажная лакмусовая бумажка синеет.
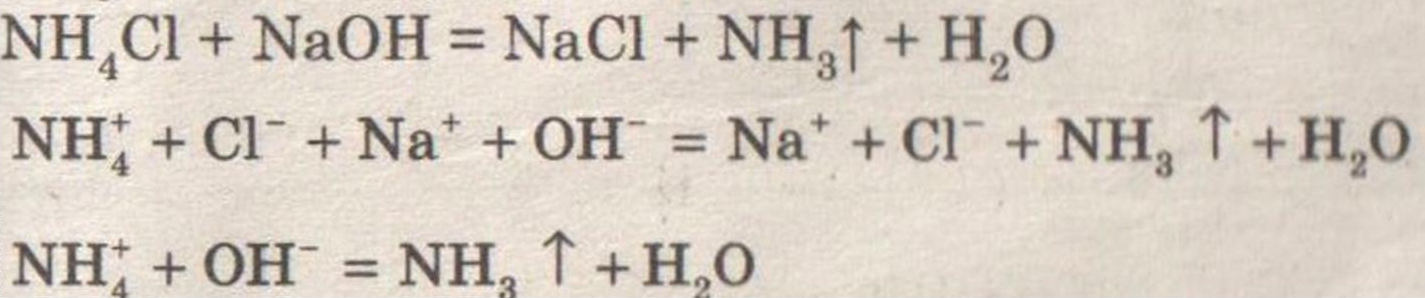
Аммиак имеет резкий запах!
Сравнение клеток растений, животных, грибов, бактерий.
На данный момент различают прокариотические и эукариотические организмы (клетки). К первым принадлежат сине-зеленые водоросли, актиномицеты, бактерии, спирохеты, микоплазмы, риккетсии и хламидии. Ко вторым принадлежат большинство водорослей, грибы и лишайники, растения и животные. В отличие от прокариотической, эукариотическая клетка имеет ядро, ограниченное оболочкой из двух мембран, и большое количество мембранных органелл.
Признаки | Прокариотические клетки (Прокариоты) | Эукариотические клетки (Эукариоты) |
Клеточная организация | В основном одноклеточные организмы | В основном многоклеточные организмы с выраженной дифференцировкой клеток и тканей |
Размеры клеток | 1-10 мкм | 10 -100 мкм |
Энергетический обмен | Аэробный или анаэробный | Аэробный |
Органеллы | Отсутствуют или весьма малочисленные | Многочисленные |
Синтез РНК и белка | В цитоплазме | Разделен: синтез и процессинг РНК - в ядре, синтез белка -в цитоплазме |
Плазматическая мембрана | Имеется | Имеется |
Ядерная оболочка | Отсутствует | Имеется |
Хромосомы | Одиночные оголенные структуры, состоящие только из ДНК кольцевой формы | Несколько структур, состоящих из ДНК и белка |
Митохондрии | Отсутствуют | Имеются |
Цитоплазматическая сеть | Отсутствует | Имеется |
Аппарат Гольджи | Отсутствует | Имеется |
Рибосомы | Имеются - 70 S | Имеются - 80 S (в цитоплазме), 70 S (в органеллах) |
Клеточная стойка | Имеется, состоит из аминосахаров и мурамовой кислоты | Отсутствует у животных клеток, у растительных клеток состоит главным образом из целлюлозы |
Капсула | Если имеется, то состоит из мукополисахаридов | Отсутствует |
Вакуоли | Отсутствуют | Имеются (особенно у растительных клеток) |
Лизосомы | Отсутствуют | Имеются |
Фотосинтетический аппарат | Мембраны с хлорофиллом и фикоцианином у сине-зеленых водорослей и с бактериохлоро-филлом у некоторых бактерий | Хлоропласты, содержащие хлорофиллы А и В, собранные в стопки (у растений) |
Жгутики | Имеются у некоторых видов, но лишены структуры (9 + 2) | Имеются у некоторых видов и обладают структурой (9 + 2) |
Ядрышко | Отсутствует | Имеется |
Цитоскелет | Отсутствует | Имеется |
Амебоидное движение | Отсутствует | Имеется |
Ток цитоплазмы | Отсутствует | Самостоятельный |
Эндоцитоз. ЭКЗОЦИТОЗ | Отсутствуют | Имеются |
Внутриклеточное пищеварение | Отсутствует | Имеется |
Деление клеток | Бинарное | Митоз (у половых клеток - мейоз) |
ЗАПИШИТЕ ВЫВОД: Растительная, животная, грибная и бактериальная клетки сходны тем, что имеют:
- мембрану, которая их ограничивает
- цитоплазму, которая обеспечивает транспорт веществ и связывает органоиды клетки
- рибосомы, синтезирующие белки
Различия заключаются в том, что
-грибная, животная и растительная клетки имеют ядро и являются эукариотами. Бактериальная клетка ядра не имеет и является прокариотической.
--грибная, животная и растительная клетки имеют мем бранные органоиды ( ЭПС, аппарат Гольджи, митохондрии, пластиды, лизосомы). У бактериальной клетки их нет. Функции пластид и митохондрий выполняют особые образования клеточной мембраны мезосомы.
- грибная, животная и растительная клетки имеют линейные хромосомы, расположенные в ядре. Бактериальная клетка имеет кольцевую голую (без белков) ДНК-нуклеоид, лежащую в цитоплазме
- грибная, растительная и бактериальная клетка имеют клеточную стенку поверх мембраны, у животной клетки клеточной стенки нет.
-грибная клеточная стенка состоит из хитина, у растительной-из целлюлозы, у бактериальной-из муреина.
-Растительная клетка и некоторые бактериальные имеют пластиды, у грибной и животной их нет.
ТЕМА: Лаб.работа№1 «Каталитическая активность ферментов в живых тканях»
(ТЕОРИЯ (не пишите):Пероксид водорода – ядовитое вещество, образующееся в клетке в процессе жизнедеятельности. Принимая участие в обезвреживании ряда токсических веществ, он может вызвать самоотравление (денатурацию белков, в частности, ферментов). Накоплению Н2О2 препятствует фермент каталаза, распространенный в клетках, способных существовать в кислородной атмосфере. Фермент каталаза, расщепляя Н2О2 на воду и кислород, играет защитную роль в клетке. Фермент функционирует с очень большой скоростью, одна его молекула расщепляет за 1с 200 000 молекул Н2О2:2 Н2О2 2 Н2О2 + О2 )
Цель: наблюдать проявление активности фермента каталаза в растительных и животных тканях. Сделать вывод о различии активности фермента в живых и мёртвых тканях.
Оборудование: таблетка гидроперита 1,5 г; стакан с водой 15 мл; ложечка; кусочки сырого и варёного картофеля; кусочки сырого и варёного мяса.
Ход работы.
Добавьте таблетку гидроперита в стакан с водой, чтобы получить свежий 3% - ный раствор пероксида водорода. Помешивая раствор ложечкой, дождитесь полного растворения таблетки в воде.
Добавляйте понемногу раствор пероксида водорода к образцам животных и растительных тканей.
Наблюдайте происходящие процессы в тканях.
Опишите наблюдаемые явления.
Объясните наблюдаемые явления, используя знания о белковой природе ферментов.
Результаты занесите в таблицу:
Образцы тканей | Наблюдаемые явления | Объяснение наблюдаемых явлений |
Сырой картофель | выделяются пузырьки | образовался кислород из перекиси водорода |
Варёный картофель | ничего не происходит | фермент разрушен, перекись водорода не расщепляется |
Сырое мясо | ||
Варёное мясо | |
Практическая работа № __. Получение и свойства карбоновых кислот.
Практическая работа № 6(н). Получение, собирание и распознавание газов
Вариант 1.
Опыт 1.
Получение, собирание и распознавание водорода
Соберите прибор для получения газов и проверьте его на герметичность. В пробирку положите 1—2 гранулы цинка и прилейте в нее 1—2 мл соляной кислоты. Закройте пробирку пробкой с газоотводной трубкой (см. рис. 43) и наденьте на кончик трубки еще одну пробирку. Подождите некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Снимите пробирку с водородом и, не переворачивая ее, поднесите к горящей спиртовке. Если водород взрывается с глухим хлопком, то он чистый, а если с «лающим» звуком, значит, водород собран в смеси с воздухом («гремучий газ»).
Вопросы и задания
1. Что происходит при взаимодействии цинка с соляной кислотой? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.
3. Опишите физические свойства водорода, непосредственно наблюдаемые при проведении опыта.
4. Опишите, как можно распознать водород.
Ответы:
Собрали прибор для получения газов и проверили его на герметичность. В пробирку положили 1-2 гранулы цинка и прилили в нее 1-2 мл соляной кислоты. Закрыли пробирку пробкой с газоотводной трубкой и надели на кончик трубки еще одну пробирку, подождали некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Сняли пробирку с водородом и не переворачивая ее поднесли к горящей спиртовке. Чистый водород взрывается с глухим хлопком.
Опыт 2.
Получение, собирание и распознавание аммиака
Соберите прибор, как показано на рисунке 113, и проверьте его на герметичность.
В фарфоровую чашку насыпьте хлорид аммония и гидроксид кальция объемом по одной ложечке для сжигания веществ. Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте ее пробкой и укрепите в лапке штатива (обратите внимание на наклон пробирки относительно отверстия!). На газоотводную трубку наденьте сухую пробирку для собирания аммиака.
Пробирку со смесью хлорида аммония и гидроксида кальция прогрейте сначала всю (2—3 движения пламени), а затем в том месте, где находится смесь.
Для обнаружения аммиака поднесите к отверстию перевернутой вверх дном пробирки влажную фенолфталеиновую бумажку.
Прекратите нагревание смеси. Пробирку, в которой собран аммиак, снимите с газоотводной трубки. Конец газоотводной трубки сразу же закройте кусочком мокрой ваты.
Немедленно закройте отверстие снятой пробирки большим пальцем и опустите в сосуд с водой. Палец отнимите только под водой. Что вы наблюдаете? Почему вода поднялась в пробирке? Закройте пальцем отверстие пробирки под водой и выньте ее из сосуда. Добавьте в пробирку 2—3 капли раствора фенолфталеина. Что наблюдаете?
Проведите аналогичную реакцию между растворами щелочи и соли аммония при нагревании. Поднесите к отверстию пробирки влажную индикаторную бумажку. Что наблюдаете?
Вопросы и задания
1. Что происходит при взаимодействии хлорида аммония и гидроксида кальция? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Опишите физические свойства аммиака, непосредственно наблюдаемые в опыте.
3. Опишите не менее двух способов распознавания аммиака.
Ответы:
Собрали прибор для получения аммиака и проверили его на герметичность. В фарфоровую чашку насыпали хлорид аммония и гидроксид кальция объемом по 1 ложечке для окисления веществ. Смесь перемешали стеклянной палочкой и высыпали в сухую пробирку. Закрыли ее пробкой и укрепили на лапке штатива. На газоотводную трубку надели сухую пробирку для собирания аммиака. Пробирку со смесью хлорида аммония и гидроксида кальция нагрели.
Вариант 2.
Опыт 1.
Получение, собирание и распознавание кислорода
Соберите прибор, как показано на рисунке 114, и проверьте его на герметичность. В пробирку насыпьте примерно на ¼ ее объема перманганата калия KMnO4 и у отверстия пробирки положите рыхлый комочек ваты. Закройте пробирку пробкой с газоотводной трубкой. Укрепите пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород. Наличие кислорода в сосуде проверьте тлеющей лучинкой.
Вопросы и задания
1. Что происходит при нагревании перманганата калия? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.
3. Опишите физические свойства кислорода, непосредственно наблюдаемые в опыте.
4. Опишите, как вы распознавали кислород.
Ответы:
Собрали прибор для получения кислорода и проверили его на герметичность. В пробирку насыпали примерно на 1/4 ее объема перманганата калия у отверстия пробирки положили рыхлый комочек ваты.
Закрыли пробирку пробкой с газоотводной трубкой. Укрепили пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород.
Опыт 2.
Получение, собирание и распознавание оксида углерода (IV)
В пробирку поместите несколько кусочков мела или мрамора и прилейте 1—2 мл разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку, в которой находится 2—3 мл известковой воды.
Несколько минут наблюдайте, как через известковую воду проходят пузырьки газа.
Вопросы и задания
1. Что происходит при взаимодействии мела или мрамора с соляной кислотой? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите проведенную реакцию в свете теории электролитической диссоциации.
3. Опишите физические свойства оксида углерода (IV), непосредственно наблюдаемые в опыте.
4. Опишите, как вы распознавали оксид углерода (IV).
Ответы:
В пробирку поместили несколько кусочков мела и прилили 1 мл разбавленной соляной кислоты. Закрыли пробирку пробкой с газоотводной трубкой. Конец трубки опустили в другую пробирку, в которой находится 2-3 мл известковой воды. Наблюдаем как через известковую воду проходят пузырьки газа.
Эта реакция является качественной на углекислый газ.
Практическая работа№3. Получение и свойства карбоновых кислот.
Практическая работа № 3. Получение и свойства карбоновых кислот
Цель работы: Получить уксусную кислоту и изучить её свойства.
Реактивы и оборудование: ацетат натрия, серная кислота (конц.), уксусная кислота, магний (порошок), цинк, гидроксид натрия, карбонат натрия, фенолфталеин, универсальная индикаторная бумага, прибор для получения и собирания кислоты, спиртовка, пробирку, вата, спички.
Ход работы:
Внимание!!! Работа с кислотами!! Соблюдайте ТБ!
Опыт 1. Получение уксусной кислоты.
В пробирку с ацетатом натрия прибавить 1- 2 мл концентрированной серной кислоты. Закрыть пробирку пробкой с газоотводной трубкой, конец которой опустите в другую пробирку вход в пробирку прикрыть ваткой, смотрите рисунок:
Смесь в пробирке осторожно нагревайте до тех пор, пока в приёмнике – пробирке не соберётся 1 -2 мл жидкости. Прекратите нагревание, закройте спиртовку.
Опустите в пробирку с образовавшейся жидкости универсальную индикаторную бумагу. Как изменился цвет индикатора? Почему? Запишите уравнение диссоциации уксусной кислоты.
Опишите запах, образовавшейся жидкости? Соблюдайте осторожность при определении запаха! Составьте уравнение данной химической реакции.
Опыт 2. Взаимодействие уксусной кислоты с металлами.
Посмотрите видео-опыт «Взаимодействие уксусной кислоты с металлами»
В одну пробирку положите гранулу цинка, в другую порошок магния. В обе пробирки прилейте 1 мл уксусной кислоты. Что наблюдаете? Сравните скорость этих реакций? Запишите соответствующие уравнения химических реакций, назовите продукты, укажите тип реакции.
Опыт 3. Взаимодействие уксусной кислоты с основаниями.
Посмотрите видео-опыт «Взаимодействие уксусной кислоты с основаниями»
В пробирку налейте 1 мл гидроксида натрия и добавьте 1 каплю фенолфталеина. Что наблюдаете? Почему?
Затем добавьте к содержимому пробирки уксусную кислоту. Почему происходит обесцвечивание? Запишите УХР (УРАВНЕНИЕ ХИМИЧЕСКОЙ РЕАКЦИИ), назовите продукты.
Название опыта. Что делали. | УХР. Наблюдения. Выводы |
опыт 2 опыт 3 | 2СН3СООН + Мg = H2↑ + ( CH3COO)2 Mg- выдел. газ 2СН3СООН + Zn = H2 ↑ + ( CH3COO)2 Zn - выдел. газ |
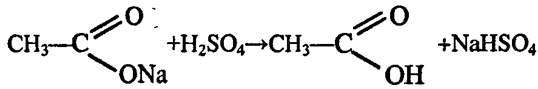
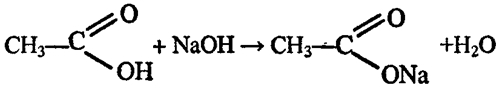
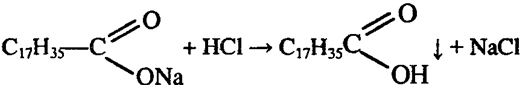
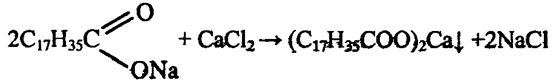 Эта реакция иллюстрирует, что моющая способность мыла
Эта реакция иллюстрирует, что моющая способность мыла

Комментариев нет:
Отправить комментарий