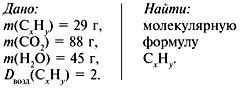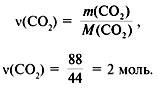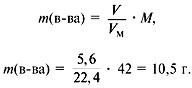ГРУППА 305 ХИМИЯ 56, 57
ТЕМА: ДИФФЕРЕНЦИРОВАННЫЙ ЗАЧЕТ
Вариант 1
1. Одноосновная бескислородная кислота
А) H2S Б) H2CO3 В) HF Г) HNO3
2. Сумма коэффициентов в полном ионном уравнении BaCl2 + H2SO4=
А) 11 Б) 10 В) 7 Г) 9
3. Коэффициенты перед AlCL3 и NH4Cl в уравнении реакции NH4NO3 + AlCL3 = Al(NO3)3 + NH4Cl соответственно равны…
А) 1 и 2 Б) 1 и 3 В) 3 и 1 Г) 2 и 1
4. Элементы только побочных подгрупп находятся в ряду
А) Sc, Mo, W Б) Ta, Ca, Mn В) As, Br, Cr Г) Sb, Co, Ge
5. Металлические свойства убывают в ряду
А) Ge, Sn, Pb Б) Sr, Y, Mo В) Tc, Nb, Sr Г) K, Rb, Cs
6. Самый активный неметалл
А) At Б) F В) B Г) Si
7. Максимальная валентность атома Se равна
А) 2 Б) 4 В) 8 Г) 6
8. Относительная молекулярная масса K2S
А) 71 Б) 110 ат. ед. м. В) 110 Г) 71 ат. ед. м.
9. Электронное строение атома калия соответствует выражению
А) 1S22S22P63S23P64S1 Б) 1S22S22P63S23P63d1
В) 1S22S22P63S23P7 Г) 1S22S22P63S23P64S2
10. Количество элементов в 5 периоде
А) 18 Б) 32 В) 8 Г) 24
11. Максимальное число электронов на р-орбиталях:
А) 2; Б) 6; В) 10; Г) 14.
12. Число нейтронов в атоме цинка равно:
А) 65; Б) 22; В) 30; Г) 35.
13. В периоде слева направо уменьшается
А) число уровней Б) число валентных электронов
В) радиус атома Г) активность неметаллов
14. Степень окисления атома углерода в соединении Ca(ClO2)2 равна
А ) -4 Б) -3 В) +4 Г) +3
15. Сумма коэффициентов в полном ионном уравнении реакции взаимодействия хлорида кальция и нитрата серебра
А) 10 Б) 8 В) 14 Г) 12
16. Сокращённое ионное уравнение: Fe2+ + 2OH- = Fe (OH)2 соответствует взаимодействию
А) FeCO3 + 2NaOH В) Fe(NO3)2 + 2NaOH С) FeSiO3 + LiOH
D) FeCl2 + Cu(OH)2 Е) FeS+ 2KOH
17. Изомером бутина-1 является вещество:
A) СН2=СН - С2Н5
Б) СН3 – СН – СН3
׀
СН3
В) НС ≡С – С2Н5
Г) Н2С = СН – СН2 – СН3
18. При повышении давления химическое равновесие сместится в сторону исходных веществ в системе…
А)2SO2 + O2
Б) CH4 + H2O
В) CO + 2H2
Г) 4HCl + O2
19. «Бесцветная жидкость с резким запахом, легче воды, хорошо растворим в воде, гигроскопичен, обладает бактерицидными свойствами» - данные свойства соответствуют:
А) бензол Б) этиловый спирт В) сахароза Г) бензол
20. Название вещества
а) 3 метал 5 пропил гептан б) 3 пропил 5 метил гептен3
в) 3 пропил 5 метил гептан г) 2, 5 диметил 3этил гептен 3
21. (Выбрать несколько вариантов ответа)С какими веществами взаимодействует HNO3
а) HCL б) Mg в) P2O5 г) Fe2O3
22. (Выбрать несколько вариантов ответа)Выбрать кислоты:
А) MgCl2 Б) Al(OH)3 В) H3PO4 Г) HF Д) NaOH Е) CO2
23. (Выбрать несколько вариантов ответа)Прочитать текст.
Для изготовления активированного угля используют различные углеродсодержащие материалы органического происхождения: торф, каменноугольный кокс, древесный и коксовый угли. В результате получают вещество, обладающее высокими адсорбирующими и каталитическими свойствами. Именно большое количество пор обуславливает мощную впитывающую способность активированного угля, который используют для поглощения токсических веществ, газообразных соединений. Однако при этом уголь слабо поглощает такие соединения, как щелочи и кислоты. Использование активированного угля эффективно впервые 12 часов после отравления. При отравлении, в том числе тяжелом, активированный уголь нужно принимать еще до промывания желудка. Принимать уголь нужно в расчете 1 таблетка на 10 кг веса. Попадая в организм уголь, подобно губке, впитывает в себя вредные вещества и спустя некоторое время естественным путем выводится вместе с ними.
Выбрать истинные суждения, согласно тексту.(Ответов несколько)
А) Активированный уголь делают из древесного угля
Б) Лучше всего уголь использовать после промывания желудка
В) Активированный уголь эффективен при любых отравлениях
Г) Для подростка весом 60кг нужно выпить 3 таблетки угля
Д) Для подростка весом 60кг нужно выпить 6 таблеток угля
Е) Активированный уголь является адсорбентом
Ж) Эффективнее использовать порошок угля чем таблетки
Часть В
1. Соотнести виды химической связи и формулу вещества
1) ковалентная полярная
2) ионная
А) NaCl Б) HCl В) Mg(OH)2 Г) Cl2 Д) NO2
Ответ оформите в виде таблицы:
1 | 2 |
|
|
2. Соотнести название продукта и тип дисперсной системы:
1) суспензия
2) порошок
3) гель
А) мука Б) компот В) цукаты Г) холодец
Ответ оформите в виде таблицы:
1 | 2 | 3 |
|
|
|
3.Соотнести формулы веществ и класс углеводородов. Ответ представить в виде таблицы.
Формулы Класс углеводородов
А) С4Н10 1) Алканы
Б) С6Н12 2) Алкены
В) С2Н6 3) Алкины
Г) С4Н8
Д) С8Н16
Е) С5Н8
Часть С
21. В 15%-ном раствор кислоты массой 300 г добавили 30г. Рассчитайте массовую долю серной кислоты в полученном растворе.
30.Записать два изомера и два гомолога для 2- метил пентана
31.Осуществить схему превращений:
CH3 ─ CH3 → CH2 ═CH2 → CH ≡CH
ГРУППА 405 ХИМИЯ 56, 57
ТЕМА: Взаимодействие железа с кислотами. Получение гидроксида железа(II) и взаимодействие его с кислотами. Получение гидроксида железа(III) и взаимодействие его с кислотами. Получение гидроксида хрома (III) и исследование его свойств.
ВЗАИМОДЕЙСТВИЕ ЖЕЛЕЗА С КИСЛОТАМИ ОЗНАКОМЬТЕСЬ С ТЕКСТОМ ЗДЕСЬ
Получение гидроксида железа (II) и взаимодействие его с кислотами
Получим гидроксид железа (II) Fe(OH)2. Для этого воспользуемся реакцией растворимой соли железа (II) со щелочью: соединим сульфат железа (II) и гидроксид калия.
FeSO4 + 2KOH = Fe(OH)2↓ + K2SO4
Образуется серо-зеленый осадок гидроксида железа (II). Вспомним, что гидроксид железа (III) – бурый. По цвету получаемого осадка гидроксида различают соли железа (II) и железа (III). Как подействует кислота на серо-зеленый осадок гидроксида? Добавляем раствор соляной кислоты.
Fe(OH)2 + 2HCl = FeCl2 + 2H2O
Осадок гидроксида растворяется. Образуется раствор хлорида железа (II).
Оборудование: колба, пипетка.
Техника безопасности. Соблюдать правила обращения с растворами кислот и щелочей. Избегать попадания кислот и щелочей на кожу и слизистые оболочки.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Получение гидроксида железа (III) и взаимодействие его с кислотами
Получим гидроксид железа (III) Fe(OH)3 взаимодействием растворов хлорида железа (III) FeCl3 и гидроксида калия KOH. Это обычный способ получения нерастворимых оснований – реакция обмена растворимой соли и щелочи.
FeCl3 + 3KOH = Fe(OH)3 ↓+ 3KCl
Выпадает бурый осадок. Это гидроксид железа (III). Как гидроксид реагирует с кислотами? Добавим раствор соляной кислоты.
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Осадок гидроксида железа растворяется, образуется желтый раствор хлорида железа (III). Реакции обмена с кислотами могут превращать нерастворимые основания в растворимые соли.
Оборудование: колба, пипетка.
Техника безопасности.
Соблюдать правила обращения с растворами кислот и щелочей. Избегать попадания кислот и щелочей на кожу и слизистые оболочки.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
ПОЛУЧАЕМ гидроксид хрома (III) взаимодействием хлорида хрома (III) и по каплям приливаемого гидроксида натрия.ОБРАЩАЕМ внимание на получаемый осадок, затем приливаем избыток щелочи: осадок растворился. Уравнение реакции получения гидроксида хрома (III):
CrCl3 + 3NaOH → Cr(ОН)3 ↓+ 3NaCl;
Таким образом, гидроксид хрома (III) проявляет амфотерные свойства.
Сr(ОН)3 ↓+ 3NaOH → Na3[Cr(ОН)6] (раствор)
ТЕМА: Электрохимический ряд напряжений металлов. Металлотермия.
В таблице Д. И. Менделеева Металлы располагаются ниже диагонали бор-астат.

Рис. 2 Положение металлов в периодической системе Д.И.Менделеева.
Объединены эти элементы в группу металлов по нескольким сходным признакам: относительно большие радиусы атомов, во внешнем слое малое количество электронов (1-3). Например, для атомов калия и железа:


При сближении атомов, валентные орбитали соседних атомом перекрываются, образуется металлическая связь.

Рис.3 Металлическая связь
Вещества с металлической связью реализуют металлические кристаллические решетки, в которых узлы представлены атомами или катионами, а обобществлённые электроны электростатически притягиваются катионами, обеспечивая стабильность и прочность. Такое строение объясняет физические и химические свойства металлов.
Кроме сходного строения атомов у металлов можно выделить группу общих физических свойств: электро- и теплопроводность, пластичность, ковкость, металлический блеск. Эти свойства позволяют человеку широко применять металлы в жизни.
Атомы металлов имеют небольшие значения электроотрицательности:

Все металлы имеют исключительно восстановительные свойства, т.е. способны только отдавать электроны.
Силу восстановительных свойств можно отобразить в электрохимическом ряду напряжения металлов. Используя эти данные, можно записать уравнения взаимодействия металлов с водой. 
Например:
Ba + 2H2O → Ba(OH)2 + H2↑
3Fe+ 4H2O = Fe3O4 + 4H2
Электрохимический ряд напряжения металлов можно использовать для прогнозирования взаимодействия и получения металлов: Металл способен вытеснять (восстанавливать) из солей те металлы, которые стоят правее него, а также вытеснять водород из разбавленных кислот.
 Например:
Например:
CuSO4 + Fe –> FeSO4 + Cu
NiSO4 + Zn –> Ni + ZnSO4
Zn + 2HCl → ZnCl2 + H2
Основные способы получения металлов: пирометаллургия, гидрометаллургия, электрометаллургия.
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, медь восстанавливают из куприта Cu2O прокаливанием с углем (коксом):
SnО2+ 2С = Sn + 2СО↑; Cu2O + С = 2Cu+ СО ↑.
Алюминотермия и магниетермия способы получения металлов, основанные на восстановлении металлов из их соединений (оксидов, галогенидов и др.) более активными металлами (Al и Mg). Например:
tо
2Al + 3BaO → 3Ba + Al2O3
TiCl4 + 2Mg → Ti + 2MgCl2
Металлотермические опыты получения металлов впервые осуществил русский ученый Н. Н. Бекетов в XIX в.
Восстановительные свойства металлов проявляются при взаимодействии с неметаллами. Например:
H2O
2Al + 3I2 → 2AlI3 (инициатором реакции является вода)
to
2Fe + 3Cl2 → 2FeCl3 (реакция горения)
2Na + S → Na2S (реакция идет самопроизвольно при смешивании серы и натрия)
Основными восстановителями для получения металлов являются С, СО, Н2.
Например:

Кроме восстановителей для получения металлов ещё используют электрохимический способ – электролиз.
Электролиз получил широкое распространение в металлургии цветных металлов и в ряде химических производств. Такие металлы, как алюминий, цинк, магний, получают главным образом путём электролиза.
Сущность электролиза заключается в выделении из электролита частиц вещества при протекании через электролитическую ванну постоянного тока и осаждении их на погруженных в ванну электродах. Цель процесса - получение возможно более чистых незагрязнённых примесями металлов.

Рис. 6. Процессы, протекающие при электролизе.
Схема электролизной ванны: 1 - ванна, 2 - электролит, 3 - анод, 4 - катод, 5 - источник питания
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
Задания необходимо решать с использование ряда напряжения металлов:

Задание 1: Составьте уравнение реакций взаимодействия металлов с кислотами, расставьте коэффициенты и найдите их сумму.
Al + Н2SО4 →
Fe + Н2SО4 →
Алюминий и железо стоят левее водорода в ряду напряжения металлов, поэтому могут вытеснить водород из разбавленных кислот. При прохождении реакции наблюдаем выделение водорода в виде мелких пузырьков.
Коэффициенты расставляем, уравнивая количество атомов одного элемента до и после стрелки.
Сумма коэффициентов в уравнении с алюминием : 9 (2+3+1+3).
В уравнении с железом: 4 (1+1+1+1).
Задание 2: Составьте уравнение реакций взаимодействия металлов с солями, расставьте коэффициенты и найдите их сумму.
PbSO4 + Fe →
Zn+CuCl2 →
Свинец стоит в ряду напряжения металлов правее железа, поэтому будет вытеснен из соли более активным металлом (Fe):
PbSO4 + Fe = FeSO4 + Pb,
Аналогичные рассуждения можно применить в следующей реакции:
Zn+CuCl2 = ZnCl2 + Cu (цинк более активный, чем медь).
Так медь, которая в ряду активностей металлов стоит после водорода, не будет реагировать с хлоридом цинка, поэтому реакция замещения не будет проходить.
ZnCl2 + Cu →
Коэффициенты расставляем, уравнивая количество атомов одного элемента до и после стрелки.
Сумма коэффициентов в уравнении с цинком: 4 (1+1+1+1).
В уравнении с железом: 4 (1+1+1+1).