ПОНЕДЕЛЬНИК, 31.01.22 г. 403, 405, 308 ИНСТРУКЦИЯ ДЛЯ ТЕХ, КТО НЕ МОЖЕТ НАЙТИ СВОЮ ГРУППУ:
СПРАВА ЕСТЬ АРХИВ. В АРХИВЕ ПО-ПОРЯДКУ РАСПОЛОЖЕНЫ ДНИ НЕДЕЛИ. ТАМ ЖЕ ВИДНЫ ДАТЫ И НОМЕРА ГРУПП. ВЫБИРАЕТЕ ДЕНЬ СО СВОЕЙ ГРУППОЙ, И ОН ОТКРОЕТСЯ. УРОКИ ВЫЛОЖЕНЫ ПО РАСПИСАНИЮ. НА ОДНОЙ СТРАНИЦЕ ВЫЛОЖЕН ОДИН ДЕНЬ .
ВНИМАНИЕ!!! На выполнение задания отводится 1 неделя.
Моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
Критерии оценивания: Для получения отличной оценки обучающийся должен:- соблюдать отведенное время;- разборчиво и правильно выполнить работу. Если работа будет прислана после указанного срока , оценка будет снижаться.
ГРУППА 403 ХИМИЯ 44, 45
ТЕМА: Гидролиз солей. Гидролиз солей различного типа. Классификация химических реакций.
Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита. Если рассматривать соль как продукт нейтрализации основания кислотой, то можно разделить соли на четыре группы, для каждой из которых гидролиз будет протекать по-своему. 1). Гидролиз не возможен Соль, образованная сильным основанием и сильной кислотой (KBr, NaCl, NaNO3), гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется. рН таких растворов = 7. Реакция среды остается нейтральной. 2). Гидролиз по катиону (в реакцию с водой вступает только катион) В соли, образованной слабым основанием и сильной кислотой (FeCl2, NH4Cl, Al2(SO4)3, MgSO4) гидролизу подвергается катион: FeCl2 + HOH <=>Fe(OH)Cl + HCl В результате гидролиза образуется слабый электролит, ион H+ и другие ионы. рН раствора < 7 (раствор приобретает кислую реакцию). 3). Гидролиз по аниону (в реакцию с водой вступает только анион) Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3, CH3COONa) подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид-ион ОН- и другие ионы. K2SiO3 + НОH <=>KHSiO3 + KОН рН таких растворов > 7 (раствор приобретает щелочную реакцию). 4). Совместный гидролиз (в реакцию с водой вступает и катион и анион) Соль, образованная слабым основанием и слабой кислотой (СН3СООNН4, (NН4)2СО3, Al2S3), гидролизуется и по катиону, и по аниону. В результате образуются малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания. Мерой силы кислоты и основания является константа диссоциации соответствующего реактива. Реакция среды этих растворов может быть нейтральной, слабокислой или слабощелочной: Al2S3 + 6H2O =>2Al(OH)3↓+ 3H2S↑ Гидролиз - процесс обратимый. Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота Алгоритм составления уравнений гидролиза солей
Практическое применение. На практике с гидролизом учителю приходится сталкиваться, например при приготовлении растворов гидролизующихся солей (ацетат свинца, например). Обычная “методика”: в колбу наливается вода, засыпается соль, взбалтывается. Остается белый осадок. Добавляем еще воды, взбалтываем, осадок не исчезает. Добавляем из чайника горячей воды – осадка кажется еще больше… А причина в том, что одновременно с растворением идет гидролиз соли, и белый осадок, который мы видим это уже продукты гидролиза – малорастворимые основные соли. Все наши дальнейшие действия, разбавление, нагревание, только усиливают степень гидролиза. Как же подавить гидролиз? Не нагревать, не готовить слишком разбавленных растворов, и поскольку главным образом мешает гидролиз по катиону – добавить кислоты. Лучше соответствующей, то есть уксусной. В других случаях степень гидролиза желательно увеличить, и чтобы сделать щелочной моющий раствор бельевой соды более активным, мы его нагреваем – степень гидролиза карбоната натрия при этом возрастает. Важную роль играет гидролиз в процессе обезжелезивания воды методом аэрации. При насыщении воды кислородом, содержащийся в ней гидрокарбонат железа(II) окисляется до соли железа(III), значительно сильнее подвергающегося гидролизу. В результате происходит полный гидролиз и железо отделяется в виде осадка гидроксида железа(III). На этом же основано применение солей алюминия в качестве коагулянтов в процессах очистки воды. Добавляемые в воду соли алюминия в присутствии гидрокарбонат-ионов полностью гидролизуются и объемистый гидроксид алюминия коагулирует, увлекая с собой в осадок различные примеси. Видео - Эксперимент "Гидролиз солей" Видео - Эксперимент "Гидролиз солей, образованных сильным основанием и слабой кислотой" Видео - Эксперимент "Гидролиз солей, образованных слабым основанием и сильной кислотой" Видео - Эксперимент "Гидролиз солей, образованных слабым основанием и слабой кислотой" Видео - Эксперимент "Усиление гидролиза солей при нагревании" ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ №1. Запишите уравнения гидролиза солей и определите среду водных растворов (рН) и тип гидролиза: №2. Составьте уравнения гидролиза солей, определите тип гидролиза и среду раствора: №3. Составьте уравнения гидролиза, определите тип гидролиза и среду водного раствора соли для следующих веществ: Известны следующие типы химических реакций: реакции соединения, реакции разложения, реакции замещения и реакции обмена. А) 4Al + 3O2 = 2Al2O3 -р.соединения Б) 2H2O= 2H2+ O2 -р. разложения В) ZnO + 2 HCl = ZnCl2 + H2O -р.обмена Г) СаСO3 = CaO + CO2 р.соединения Д)) Zn + 2HCl = ZnCl2 + H2 р.замещени Е) Na2O+ CO2=Nа2СO3 р. соединения ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ Пример 1. Введите формулу недостающего продукта реакции. CH3COOH + Ca(OH)2 → … + H2O. Решение Мы видим, что первое вещество в этой реакции – это уксусная кислота, а второе – гидроксид кальция. Вспоминаем, что реакция между кислотой и основанием – это реакция нейтрализации. Продуктами подобных реакций являются соль и вода. Вода уже записана в правой части уравнения, остается вписать туда формулу соль. Это должна быть кальциевая соль уксусной кислоты – ацетат кальция. Ацетат-ион одновалентен, а ион кальция – двухвалентен, следовательно, на каждый ион кальция приходится два ацетат-иона. Его формула (CH3COO)2Ca. Записываем формулу на место пропуска. |
ТЕМА: Реакции соединения, разложения, замещения, обмена. Реакция замещения меди железом в растворе медного купороса.
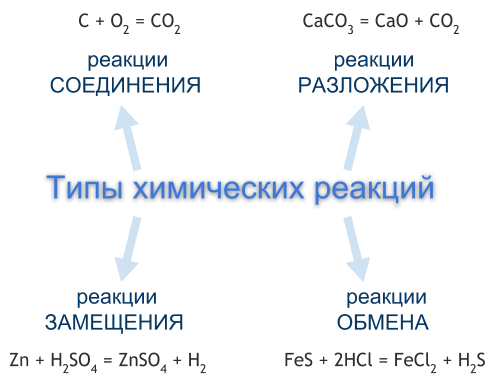
Типы химических реакций
В природе существует огромное множество различных химических реакций. Для их упорядочивания и систематизации придумано несколько способов их классификации, то есть разделения на различные типы.
Чаще всего химические реакции классифицируют по числу и составу реагентов и продуктов реакции. По этой классификации выделяют четыре типа химических реакций — это реакции соединения, разложения, замещения, обмена. Однако существуют химические реакции, которые нельзя отнести ни к одному из перечисленных типов.
Реакции соединения
Реакция соединения — это реакция, реагентами которой являются два или несколько простых или сложных веществ, а продуктом — одно сложное вещество.
Примеры реакций соединения
Образование оксидов из простых веществ:
C + O2 = CO2, 2Mg + O2 = 2MgO
Взаимодействие металла с неметаллом и получение соли:
2Fe + 3Cl2 = 2FeCl3
Взаимодействие оксида с водой:
CaO + H2O = Ca(OH)2
Реакции разложения
Реакция разложения — это реакция, реагентом которой является одно сложное вещество, а продуктом — два или несколько простых или сложных веществ. Чаще всего реакции разложения протекают при нагревании.
Примеры реакций разложения
Разложение мела при нагревании:
CaCO3 = CaO + CO2
Разложение воды под действием электрического тока:
2H2O = 2H2 + O2
Разложение оксида ртути при нагревании:
2HgO = 2Hg + O2
Реакции замещения
Реакция замещения — это реакция, реагентами которой являются простое и сложное вещества, а продуктами — также простое и сложное вещества, но атомы одного из элементов в сложном веществе заменены на атомы простого реагента.
Примеры реакций замещения
Замещение водорода в кислотах:
Zn + H2SO4 = ZnSO4 + H2
Вытеснение металла из соли:
Fe + CuSO4 = FeSO4 + Cu
Образование щелочи:
2Na + 2H2O = 2NaOH + H2
Реакции обмена
Реакция обмена — это реакция, реагентами и продуктами которой являются по два сложных вещества, в процессе реакции реагенты обмениваются между собой своими составными частями, в результате чего образуются другие сложные вещества.
Примеры реакций обмена
Взаимодействие соли с кислотой:
FeS + 2HCl = FeCl2 + H2S
Взаимодействие двух солей:
2K3PO4 + 3MgSO4 = Mg3(PO4)2 + 3K2SO4
ГРУППА 405 ХИМИЯ 13,14
ТЕМА: Электронные конфигурации атомов химических элементов.Моделирование построения Периодической таблицы химических элементов.
Строение электронных оболочек атомов элементов
Связь, которая возникает между атомами, сильно различающимися по значениям электроотрицательности.
Ионная связь возникает, например, между атомами типичных металлов и типичных неметаллов (
Примерами веществ с ионной связью являются
Ионную связь можно рассматривать как крайний случай ковалентной полярной связи, когда электрон практически полностью переходит от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью. Однако в действительности полного перехода электрона не происходит никогда. Даже в таких типичных ионных соединениях, как, например, в галогенидах щелочных металлов, нет полного разделения положительных и отрицательных зарядов. Так, в кристалле хлорида натрия
В результате отдачи или присоединения электронов из нейтральных атомов или молекул образуются ионы.
заряженные частицы, образующиеся из нейтральных атомов или молекул путём отдачи или присоединении электронов.
При отдаче электронов образуется положительно заряженный ион — катион, при присоединении — отрицательный ион — анион. Атомы электроположительного элемента (металла) отдают электроны внешнего уровня и образуют катионы, а атомы электроотрицательного элемента (неметалла) присоединяют электроны и образуют анионы. При этом атомы неметалла приобретают внешнюю электронную оболочку последующего благородного газа, а атомы металла — устойчивую конфигурацию предыдущего благородного газа.
Так, между атомами типичного металла натрия
У атома натрия на внешнем электронном уровне содержится один электрон, а атому хлора до завершения внешнего уровня не хватает одного электрона. При взаимодействии атомов натрия и хлора атом натрия отдает один электрон атому хлора, в результате чего образуются ионы — катионы
При этом атомы неметалла приобретают внешнюю электронную оболочку последующего благородного газа, а атомы металла — устойчивую конфигурацию предыдущего благородного газа. Между разноименно заряженными ионами
Ионная связь никогда не возникает между атомами неметаллов.
Ионы могут состоять как из одного атома, так и из группы атомов. Например, кристаллы сульфата натрия образованы положительными ионами натрия
При этом в сульфате натрия существует два вида связи: между ионами
Записывая заряд иона, сначала следует написать число, а затем знак, например,
Ионная связь существует в типичных основных оксидах (
Разноименные ионы притягиваются друг к другу, образуя ионные кристаллы. В основе такого притяжения лежит кулоновское взаимодействие, которое равнонаправлено во все стороны. Поэтому ионная связь, в отличие от ковалентной, характеризуется ненаправленностью и ненасыщаемостью. Вследствие этого понятие валентности как число связей в ионных соединениях теряет смысл.
В кристаллах ионного соединения противоположно заряженные ионы чередуются. Число ближайших соседей данного иона в решетке называют координационным числом. Так, координационное число натрия и хлора в хлориде натрия равно шести.
В ионных соединениях нет отдельных молекул, поэтому формула ионного соединения выражает не состав молекулы, а соотношение катионов и анионов, например, в сульфате натрия
Ионы связаны между собой прочными силами электростатического притяжения, поэтому ионные соединения твёрдые, обладают высокими температурами плавления и кипения.
ГРУППА 308 ХИМИЯ 43,44
ТЕМА: Синтетические каучуки. Строение, свойства, получение и применение.
Каучуки бывают природные (натуральные) и синтетические. Учитель демонстрирует коллекции каучука, учащиеся отмечают в тетрадь свойства. Природный каучук является липким, эластичным, резиноподобным материалом. Синтетические каучуки обладают такими свойствами как: высокая износостойкость, устойчивость к многократным деформациям, высокая устойчивость к органическим растворителям (слайд 13).
Заслушаем сообщение о «Знакомстве европейцев с каучуком» (приложение 1) (слайд 14)
Каучуки – исходное сырье для получения резины. Процесс получения резины из каучука называют вулканизацией. Получающаяся резина содержит около 5% S, и по своим свойствам значительно превосходит исходный продукт. «Историю изобретения резины» мы узнаем из сообщения (приложение 2)
Способы получения
Бутадиен-1,3, изопрен и другие алкадиены имеют огромное промышленное значение, они служат сырьем для получения синтетических полимеров, производство которых составляет миллионы тонн в год. Рассмотрим промышленные способы получения алкадиенов (слайд 17-18):
Дегидрирование:
С 4Н10 600˚С, Al2O3, Cr2O3СН2= СН–СН =СН2 + 2H2
4Н10 600˚С, Al2O3, Cr2O3СН2= СН–СН =СН2 + 2H2
бутадиен-1,3
С Н3 – СH – СН2 – СН3 t, Al2O3, Cr2O3 СН2= С–СН =СН2 + 2H2
Н3 – СH – СН2 – СН3 t, Al2O3, Cr2O3 СН2= С–СН =СН2 + 2H2
СН3 СН3
изопрен (2-метилбутадиен-1,3)
Дегидратация и дегидрирование спиртов (метод Лебедева):
С2Н5ОН 400-500 °С, Al2O3, ZnOСН2= СН–СН =СН2 + 2H2O + H2

Дегидрогалогенирование:
C l– СН2 – СH – СН2 – СН2 –Cl + 2KOH 600˚С,ZnO, MgO
l– СН2 – СH – СН2 – СН2 –Cl + 2KOH 600˚С,ZnO, MgO
СН2= СН–СН =СН2 + 2KCl + 2 H2O
6. Направления применения
Алкадиены применяются для производства каучука и резины, о них мы уже говорили. Для закрепления этого вопроса выполним упражнение 4 стр. 34 в рабочей тетради (Габриелян, О.С. Химия 10 класс: рабочая тетрадь к учебнику «Химия 10 класс. Базовый уровень») (слайд 19). При работе с интерактивной доской ученик может воспользоваться стрелками для соединения блоков схемы.
Приложение 1
« Знакомство европейцев с каучуком»
Каучук существует столько лет, сколько и сама природа. Окаменелые остатки каучуконосных деревьев, которые были найдены, имеют возраст около трёх миллионов лет. Каучук на языке индейцев тупи-гуарани означает «слёзы дерева» («кау» – дерево, «учу» – плакать, течь). Каучуковые шары из сырой резины найдены среди руин цивилизаций инков и майя в Центральной и Южной Америке, возраст этих шаров не менее 900 лет.
Первое знакомство европейцев с натуральным каучуком произошло почти пять веков назад. Собственно, история каучука началась, как ни странно, с детского мячика и школьной резинки.
В 1493 году корабль Христофора Колумба во время второго путешествия в Америку пристал к острову, названному именем Эспаньола (Гаити). Высадившись на берег, испанцы были удивлены весёлой игрой индейцев, похожей на наш баскетбол. Они в такт песне подбрасывали чёрные шары, которые, упав на землю, делали, словно живые, высокие и забавные прыжки. Взяв эти шары в руки, испанцы нашли, что они довольно тяжелы, липки и пахнут дымом.
Индейцы скатывали их из загустевшего млечного сока, вытекавшего из порезов на коре дерева гевеи. Колумб привёз несколько кусков этого удивительного вещества на родину, но в те времена он никого не заинтересовал. Индейцы делали из него непромокаемые калоши, которые в жару прилипали к ногам, а, растянувшись, больше уже не сжимались.
Много лет испанцы пытались повторить водонепроницаемые вещи (обувь, одежду, головные уборы) индейцев, но все попытки были неудачными.
Первые попытки сделать каучуковую обувь вызывали только смех. Галоши или сапоги хорошо служили в дождь, но стоило выглянуть и припечь солнцу, как они растягивались, начинали прилипать. В мороз же такая обувь становилась хрупкой, как стекло.
Следующие два века каучук для Европы был просто любопытной заморской диковинкой.
В 1731 году правительство Франции отправило математика и географа Шарля Кондамина в географическую экспедицию по Южной Америке. В 1736 он отправил обратно во Францию несколько образцов каучука вместе с описанием продукции, производимой из него людьми, населяющими Амазонскую низменность. После этого резко возрос научный интерес к изучению этого вещества и его свойств.
В 1770 году британский химик Джозеф Пристли впервые нашёл ему применение: он обнаружил, что каучук может стирать то, что написано графитовым карандашом. Тогда такие куски каучука называли гуммиластиком («смолой эластичной»).
В 1791 году английский фабрикант Самуэль Пил запатентовал способ сделать одежду водонепроницаемой с помощью обработки её раствором каучука в скипидаре.
Во Франции к 1820 г. научились изготовлять подтяжки и подвязки из каучуковых нитей, сплетённых с тканью.
В Англии британский химик и изобретатель Чарльз Макинтош пропитал каучуком плотную материю, и она стала непромокаемой. Так появились первые плащи-макинтоши, а потом и первые галоши, и сумки для перевозки почты. Правда, потом стал очевиден большой недостаток всей этой продукции, делавший ее совершенно непригодной: в сильную жару материал становился слишком мягким, а в холодную погоду затвердевал, как камень.
В США вещи из каучука стали популярными в 1830-х годах, резиновые бутылки и обувь, сделанные южноамериканскими индейцами, импортировались в больших количествах. Другие резиновые изделия завозились из Англии, а в 1832 году в городе Роксбери штата Массачусетс Джон Хаскинс и Эдвард Шафе организовали первую «каучуковую» фабрику в США.
Открытие в 1839 году резины, полученной от нагревания каучука и серы, привело к широкому её применению.
Внимание капиталистов всех стран обратилось на добычу каучука. Бразилия оказалась владетельницей громадных богатств. Чтобы сохранить их, правительство Бразилии издало закон, запрещающий под страхом смерти вывоз семян и молодых деревьев гевеи. Но было поздно. По совету ботаника Дж. Гукера, англичанин Викгем поехал в 1876 году на берега Амазонки, где собрал 70000 семян Гевеи и тайком доставил их в ботанический сад в Кью. Семена были высеяны, но взошло только 4%. Однако через несколько дней сеянцы достигли полуметровой высоты. Затем они были отправлены на остров Цейлон, а оттуда разосланы на Яву, в Бирму, Австралию и др.
В нашей стране не было известно природных источников для получения натурального каучука, а из других стран каучук к нам не завозился. Впервые в промышленных масштабах синтетический каучук был получен выдающимся русским ученым С.В Лебедевым.
Приложение2
«История открытия вулканизации резины».
История открытия Чарльзом Гудийром вулканизации резины – одна из самых запутанных и непостижимых историй. Этот человек не имел права на успех. Он не обладал нужными знаниями и подготовкой. Он сталкивался с трудностями, перед которыми спасовал бы любой другой. Часто он даже не знал, чего добивался.
Гудийр начал опыты с бразильской эластичной смолой, изготовляя дома тонкие пленки при помощи скалки для теста. Он смешивал сырую смолу с любым попадавшимся под руку веществом: солью, перцем, сахаром, песком, касторовым маслом, даже с супом – следуя великолепному логическому заключению, что рано или поздно он перепробует все, что есть на земле, и наконец наткнется на удачное сочетание. Житель Нью-Хэвена Ральф Стил одолжил Гудийру денег, и тот открыл на них лавку. На полках красовались сотни пар галош. Но в первый же жаркий день они растаяли и превратились в дурно пахнущее месиво.
Гудийр закрыл свою лавку и занялся опытами, смешивая с резиновой смолой множество веществ: орешник, сыр, чернила и все это никуда не годилось, за исключением магнезии. Когда он смещал фунт магнезии с фунтом резиновой смолы, получился материал белее резиновой смолы и гибкий и прочный, как кожа. Он изготовил из него обложки для книг, чехлы для роялей, показал публике, получил горячее одобрение, смеялся от радости – и через месяц убедился, что его вновь постигла полная неудача.
В то время Гудийр думал, что его рецепт с магнезией можно еще как-то усовершенствовать. Он кипятил смесь смолы и магнезии в водном растворе негашеной извести и получал пласты резины, которая была гораздо глаже и прочнее прежней.
Газеты восхваляли его как человека, спасшего резиновую промышленность. Но через три недели Гудийр обнаружил, что одной капли самой слабой кислоты – даже яблочного сока – было достаточно, чтобы нейтрализовать негашеную известь и разрушить материал.
Многократные опыты требовали денег, и в итоге исследователь оказался в долговой тюрьме; именно там, продолжая опыты, он обнаружил, что липкость исчезает, если посыпать каучук серой и высушить его. Уже выйдя из тюрьмы, Гудийр, опять же по рассеянности, положил кусочек каучука с серой не на стол, а на горячую плиту. Ошибка оказалась открытием, потому что на плите Гудийр обнаружил не липкую смесь, а сухой мягкий упругий кусок… уже резины. Под действием серы при умеренном нагревании каучук приобретал большую прочность, твердость, становился менее чувствительным к переменам температуры. Процесс назвали вулканизацией, а вулканизированный каучук – резиной.
Вот как описывала первые испытания нового материала дочь Гудийра: «Я случайно увидела, что отец держит у огня маленький кусочек резины, и заметила, что в тот день он был необычайно взволнован каким-то открытием. Он вышел из дома и прибил кусок гвоздем к стене. Стояли сильные холода. На следующее утро отец принес этот кусочек в дом и торжествующе поднял его над головой. Резина была такой же гибкой, как и раньше. Это доказывало ценность открытия».
Вулканизация резины послужила толчком для развития электропромышленности, так как резина является прекрасным материалом для изоляции. Еще при жизни Гудийра в Соединенных Штатах, Англии, Франции и Германии выросли корпуса огромных фабрик, на которых работало более шестидесяти тысяч человек и изготовлялось пятьсот видов различных резиновых изделий, в общей сложности на 8 миллионов долларов в год. Окрыленный успехом, Гудийр стал тратить больше, чем зарабатывал. Он умер в 1860 году, оставив после себя двести тысяч долларов долгу, но друзья уже не считали его сумасшедшим.
«Гудйер Тайр энд Раббер» (Goodyear Tyre and Rubber), резинотехническая фирма США. Основана в 1898. Главный производитель синтетического каучука в США, выпускает также военную продукцию; 1-е место в мире по производству шин.
Синтетические каучуки
В России нет природных источников получения натурального каучука, поэтому необходимо было получить его синтетическим путем [2].
Под руководством академика С. В. Лебедева впервые в мире был разработан метод промышленного производства синтетического каучука из 1,3-бутадиена (1932 г.). Его получали из этилового спирта. В настоящее время для получения синтетических каучуков в основном используются углеводороды, содержащиеся в нефтяных газах и продуктах переработки нефти.
Производство бутадиенового каучука основывается на полимеризации 1,3-бутадиена в присутствии катализатора:


где n может достигать нескольких тысяч.
Однако оказалось, что группы ? CH2 ? в звеньях макромолекул в отличие от природного каучука расположены по разные стороны двойной связи, т. е. находятся в транс- положении:
Впоследствии на основе изучения пространственного строения природного каучука ученым удалось решать проблему синтеза не только дивинилового каучука, но и изопренового каучука стереорегулярного строения [1, 2, 3] .
Некоторые синтетические каучуки получают из различных мономеров в результате их совместимой полимеризации, называемой сополимеризацией. Так, например, при сополимеризации 1,3-бутадиена со стиролом синтезируют бутадиенстирольный каучук [1]:


Для улучшения качества натуральных и синтетических каучуков их превращают в резину. Резина - это вулканизированный каучук. Сущность вулканизации состоит в том, что атомы серы присоединяются к линейным молекулам каучука по месту двойных связей и как бы сшивают эти молекулы друг с другом. Резина прочнее каучука и более устойчива к изменению температуры [2, 3].
ТЕМА:Синтетические волокна. Капрон. Лавсан.
Синтетические волокна
Этот раздел в [1 ,2] изложен очень хорошо, но в [3] - очень мало по объему.
Волокнами называют материалы, получаемые из натуральных и синтетических, органических и неорганических веществ, имеющие очень малые поперечные размеры, их длина должна не меньше чем в 100 раз превышать диаметр. Например: хлопковое волокно, шелк, шерсть, капрон и др. [5]. Капрон относится к полиамидным волокнам. Для его производства используются некоторые производные аминокислот, например, капролактам. Его можно рассматривать как продукт внутримолекулярного взаимодействия карбоксильной группы и аминогруппы молекулы 6-аминогексановой
кислоты:


Упрощенно превращение капролактами в полимер, из которого производят капроновое волокно, можно представить следующим образом. Капролактам в присутствии воды превращается в 6-аминогексановую кислоту, молекулы которой реагируют друг с другом:


В результате этой реакции образуется высокомолекулярное вещество, макромолекулы которого имеют линейную структуру. Отделенные звенья полимера являются остатками 6-аминогексановой кислоты [1, 2]:


Полимер представляет собой твердое вещество, размягчающееся при температуре 210 °С и плавящееся при 225 °С. Для получения волокон капрон плавят, пропускают через фильеры. Струи полимера охлаждаются потоком холодного воздуха и превращаются в волоконца, при скручивании которых образуются нити [2].
Капроновая смола используются для получения пластмасс. Из них изготовляют различные детали машин, шестерни, вкладыши для подшипников и т. д. Предметы из капроновых пластмасс обладают исключительно большой прочностью и износоустойчивостью [1].
Лавсан- полиэфирное волокно. По своему составу лавсан - сложный эфир терефталевой кислоты и этиленгликоля. Этиленгликоль - это двухатомный спирт. Терефталевая кислота- процесс окисления n-кислол. При
взаимодействии последней с этиленгликолем получается сложный эфир:
При поликонденсации этого эфира образуется высокомолекулярное вещество - лавсан:


Промышленный процесс получения лавсана более сложный. Волокно лавсан добавляют к шерсти для изготовления немнущихся высококачественных тканей и трикотажа. Его применяют также для производства транспортерных лент, ремней, занавесей, парусов и т. д. [1].
В этой главе мы узнали о полимерах и их структуре и о ступенчатой полимеризации и поликонденсации. И в следующей главе мы будем рассматривать связанные с ними экологические вопросы.