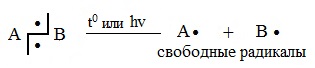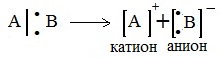16.09.22 г. Пятница. Гр.308, 405, 508,401
Здравствуйте, уважаемые студенты, заведите, пожалуйста тетрадь для конспектов по химии, другую- по биологии, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 308 химия 7,8
Тема 7: Скорость химических реакций, ее зависимость от различных факторов. Закон действующих масс.
корость химической реакции.
«Это
Почти неподвижности мука -
Мчаться куда-то со скоростью звука,
Зная прекрасно, что есть уже где-то
Некто,
Летящий
Со скоростью
Света! »
Леонид Мартынов
Ребята, сегодня на уроке у нас очень интересная и очень важная в изучении химических реакций тема. Но начать урок я хочу с интересных фактов:
- При кипячении воды, ее молекулы движутся со скоростью 650 метров в секунду.
- Ураган может двигаться со скоростью 125 миль в час.
- Ночью волосы растут медленно. Днём рост волос ускоряется. Между 10 и 11 часами скорость роста самая большая. Пик роста наступает между 14 и 16 часами.
- Кровь движется быстро в артериях (500 мм/с), медленнее в венах(150 мм/с), и еще медленнее в капиллярах(1мм/с).
-Самое медлительное млекопитающее в мире — ленивец. Он перемещается со скоростью около двух метров в минуту.
-Самые сильные ветра на Земле дуют в Антарктиде, в долине Виктории. Скорость ветра там достигает 215 метров в секунду.
Ребята, скажите, что объединяет эти научные факты? (в них говорится о скорости).
Следовательно, о чем мы будем говорить сегодня на уроке? (скорости)
Сегодня мы будем говорить о скорости. Но не о той, с которой вы знакомились на уроках физики и математики, а о скорости химических реакций. Итак, тема сегодняшнего урока «Скорость химических реакций»(запишите тему в тетрадь).
Как вы думаете, какие вопросы помогут нам раскрыть тему урока?
(1. Что такое скорость химических реакций? 2. От чего зависит скорость химических реакций?).
ПОСМОТРИТЕ ВНИМАТЕЛЬНО ВИДЕО и ответьте на вопросы.
1. Что такое скорость химических реакций? 2. От чего зависит скорость химических реакций?
На уроке проводятся эксперименты, демонстрирующие зависимость скорости химической реакции от различных факторов. Из материалов данного урока вы узнаете, как влияют на скорость химической реакции степень измельчения, концентрация и природа веществ, а также температура и наличие катализатора.
- Изучение влияния природы кислоты
В одну пробирку наливаем раствор соляной кислоты, а в другую – столько же уксусной (примерно одинаковой концентрации). Одновременно помещаем в них по грануле цинка. В обеих пробирках протекает реакция замещения с выделением водорода:
Zn + 2HCl = ZnCl2 + H2↑
Zn + 2CH3COOH = Zn(CH3CОО)2 + H2↑
В пробирке с уксусной кислотой водород выделяется с меньшей скоростью. Это можно объяснить тем, что уксусная кислота обладает меньшими кислотными свойствами по сравнению с соляной кислотой.
- Изучение влияния природы металла
В две пробирки нальем одинаковое количество соляной кислоты и одновременно поместим в них по кусочку металлов разной природы: цинка и магния. Уравнения данных реакций:
Zn + 2HCl = ZnCl2 + H2↑
Mg + 2HCl = MgCl2 + H2↑
Реакция соляной кислоты с магнием протекает с большей скоростью, так как интенсивнее выделяется водород. Магний – более активный металл, чем цинк (магний стоит в ряду напряжений левее цинка). Рис. 1.

Рис. 1. Результаты опыта по взаимодействия цинка (слева) и магния (справа) с соляной кислотой
ОПЫТ № 2. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ПЛОЩАДИ ПОВЕРХНОСТИ СОПРИКОСНОВЕНИЯ РЕАГИРУЮЩИХ ВЕЩЕСТВ
- Изучение влияния степени измельчения вещества (поверхности соприкосновения реагирующих веществ).
В две пробирки нальем примерно по 2 мл раствора медного купороса. Одновременно поместим в одну пробирку кусок железной проволоки, а в другую – железный порошок. В обеих пробирках протекает реакция замещения в соответствии с уравнением:
Fe + CuSO4 = FeSO4 + Cu↓
О протекании реакции замещения между сульфатом меди (II) и железом можно судить по выделению из раствора вещества красно-бурого цвета – меди. Признаки реакции быстрее появились в пробирке с порошком железа, т. к. порошок железа имеет большую площадь поверхности соприкосновения с раствором медного купороса. Мы видим, что измельчение вещества приводит к повышению скорости реакции.

Рис. 2. Результаты опыта по взаимодействия железного гвоздя и железного порошка с раствором CuSO4
ОПЫТ № 3. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ ИСХОДНЫХ ВЕЩЕСТВ
В две пробирки поместим по 2 гранулы цинка и осторожно прильем растворы уксусной кислоты: в первую пробирку – 9%-ный уксус, а во вторую – 70%-ную кислоту. Реакция протекает быстрее в той пробирке, в которой больше концентрация уксусной кислоты.
ОПЫТ № 4. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
В две пробирки с соляной кислотой одинаковой концентрации добавим по 1 грануле цинка. Одну из пробирок поместим в стакан с горячей водой. Наблюдаем, что при нагревании скорость выделения водорода увеличивается. Скорость реакции зависит от температуры, при которой она проводится.
ОПЫТ № 5. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ УЧАСТИЯ КАТАЛИЗАТОРА
На дно стакана нальем 3%-ный раствор перекиси водорода. Пероксид водорода – очень непрочное вещество и легко разлагается на воду и кислород:
2H2O2 = 2H2O + O2↑.
При обычных условиях реакция разложения пероксида водорода протекает медленно, признаков реакции (т. е. выделения пузырьков газа) мы не наблюдаем. Добавим в стакан с перекисью водорода немного черного порошка оксида марганца (IV). Наблюдаем интенсивное выделение пузырьков газа. Внесем в стакан тлеющую лучинку – она разгорается, следовательно, выделяющийся газ – кислород. Почему при внесении в стакан оксида марганца скорость реакции увеличилась? Дело в том, что оксид марганца является катализатором реакции разложения пероксида водорода. Катализатор, участвуя в реакции, ускоряет ее, но сам в ней не расходуется.

Рис. 3. Разложение пероксида водорода под действием катализатора MnO2
Задача №1
Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 с — 0,215 моль/л. Вычислите среднюю скорость реакции.
Решение:
Используем формулу для расчёта
υ = ± ΔС/Δτ = ± (0,215-0,22)/(10-0) = 0,0005 моль/л ∙ с
Задача №2
Вычислите, во сколько раз увеличится скорость реакции при повышении температуры от 30 до 70 ∘ С, если температурный коэффициент скорости равен 2.
Решение:
По правилу Вант-Гоффа
υ=υ0·γ (t2-t1)/10
По условию задачи требуется определить υ/υ0:
υ/υ0=2 (70-30)/10 = 24 = 16
Задача №3
Запишите кинетическое уравнение для следующих уравнений реакций:
А) S(тв) + O2 (г) = SO2 (г)
Б) 2SO2 (г) + O2 (г) = 2SO3 (ж)
Решение:
Согласно закону действующих масс, который действует для газов и жидкостей:
υ = к1 C (O2)
υ = к2 C2(SO2)·C (O2)
Задача №4
Как изменится скорость реакции:
S (тв) + O2 (г) = SO2 (г)
при увеличении давления в системе в 4 раза?
Решение:
- Запишем кинетическое уравнение для реакции до повышения давления в системе. Обозначим концентрацию кислорода
С(О2) = а, концентрация серы - твёрдого вещества не учитывается.
υ = к1 а
- При повышении давления в 4 раза, объём уменьшается в 4 раза, следовательно концентрация газа кислорода увеличится в 4 раза и кинетическое уравнение примет вид:
υ' = к1 4а
- Определяем, во сколько раз возрастёт скорость реакции:
Задача №5
Как изменится скорость реакции:
2SО2 (г) + O2 (г) = 2SO3 (г)
при увеличении давления в системе в 2 раза?
Решение:
- Запишем кинетическое уравнение для реакции до повышения давления в системе. Обозначим концентрацию SO2
С(SО2) = а, концентрация кислорода C(O2) = b.
υ = к1 а2·b
- При повышении давления в 2 раза, объём уменьшается в 2 раза, следовательно концентрация газа кислорода и SO2 увеличится в 2 раза и кинетическое уравнение примет вид:
υ' = к1 (2а)2·2b = к14а2·2b= к18а2·b
- Определяем, во сколько раз возрастёт скорость реакции:
При температуре 10 ºС реакция протекает за 5 мин, при 20ºС – за 1 мин. Рассчитайте температурный коэффициент скорости реакции.
Дано: t0= 10 ºС t= 20ºС τ0= 300c τ= 60c |
γ=? |
Решение:
1) При условии, что концентрация вещества (С), вступившего в реакцию, постоянна:
При температуре 10 ºС скорость реакции равна υ0=∆C/∆τ0,
υ0=∆C/300, ∆C= 300υ0
При температуре 30 ºС скорость реакции равна υ=∆C/∆τ,
υ=∆C/60, ∆C= 60υ. Следовательно, 300υ0=60υ, а υ/υ0=300/60=5.
2) По правилу Вант Гоффа: υ= υ0γ∆t/10, υ/υ0= γ∆t/10
3) Согласно рассуждениям (1) и (2), получим γ(20-10)/10= γ=5
Тема 8: Катализ и катализаторы.
Катализ - химическое явление, суть которого заключается в изменении скоростей химических реакций при действии некоторых веществ (их называют катализаторами).
Каталитические реакции весьма распространены в химии и некоторые из них можно провести даже в домашних условиях. Например, 3%-ный раствор перекиси водорода (именно такой продают в аптеках) вполне устойчив в отсутствие примесей. Но при добавлении очень небольшого количества (нескольких крупинок) твердого диоксида марганца MnO2 начинается реакция разложения Н2О2 с выделением газообразного кислорода:
Здесь MnO2 - катализатор реакции. Можно заметить, что в химическом уравнении катализатор не присутствует среди реагентов или продуктов, его не нужно учитывать и при уравнивании реакции. Поэтому обычно катализатор в уравнении указывают над стрелкой. Если у вас под рукой нет диоксида марганца, его вполне можно заменить двумя-тремя крупинками марганцовки из домашней аптечки: KMnO4 при действии Н2О2 быстро превратится в MnO2 (полезно написать уравнение этой реакции). Дальше полученный катализатор, вне зависимости от его количества, будет работать до тех пор, пока не закончится весь реагент - перекись водорода. Этот опыт можно проводить дома только с разбавленным (аптечным) раствором перекиси водорода. С концентрированным раствором реакция идет очень бурно. Диоксид марганца - не единственный катализатор реакции разложения перекиси водорода. Биологические катализаторы (ферменты), содержащиеся в крови, действуют так же. Именно поэтому слабый раствор перекиси водорода, нанесенный на царапину, начинает пузыриться (выделяющийся при этом кислород дезинфицирует ранку).
ГРУППА 405 химия 11,12
Тема 11,12:Классификация органических веществ.
Классификация веществ по строению углеродного скелета и наличию функциональных групп. Гомологи и гомология.
1. КРИТЕРИИ КЛАССИФИКАЦИИ ОРГАНИЧЕСКИХ ВЕЩЕСТВ
Классификация по составу
Органические соединения подразделяют по составу на:
— углеводороды – вещества, состоящие только из углерода и водорода;
— кислородсодержащие органические соединения, в состав которых входят атомы углерода, водорода и кислорода;
— азотсодержащие органические соединения – содержат, кроме атомов углерода, водорода (и иногда кислорода) еще и атом азота.
Однако при этом в одну группу кислородсодержащих соединений попадают вещества с очень разными свойствами, такие, например, как уксусная кислота, сахар и целлюлоза.
Классификация по строению

Рис. 1. Классификация по строению
Наиболее полезна для химиков классификация органических веществ по их строению. Рис. 1. Внутри этой классификации существуют признаки, позволяющие наиболее полно охарактеризовать вещества.
2. КЛАССИФИКАЦИЯ ПО ТИПУ СКЕЛЕТА
Первый признак классификации органического соединения по строению – тип скелета молекулы.
Скелет – это последовательность связанных атомов углерода в молекуле, основа структуры органического соединения.

Рис. 2. Разновидности углеродного скелета
Кроме атомов углерода, в состав скелета могут входить и другие атомы, например, O, S, N, если они связаны, по меньшей мере, с двумя атомами углерода.
Например, в диметиловом эфире СН3-О-СН3 атом кислорода включен в скелет молекулы, а в этаноле CH3-CH2-OH – нет. Молекулы, в скелет которых, кроме атомов углерода, входят атомы других элементов, называются гетероатомными(«гетеро-» – лат. «разный»).
Скелет молекулы может быть неразветвленным – все атомы углерода соединены последовательно – и разветвленным. Цепь из атомов углерода может быть замкнутой. Такую замкнутую группу атомов называют циклом. Поэтому скелет молекулы бывает или ациклическим, (т.е. не циклическим) или циклическим. В скелете различают первичный, вторичный, третичный, четвертичный атомы углерода.
Первичным называют атом углерода, связанный только с одним другим атомом углерода, вторичным – с двумя, третичным – с тремя, а четвертичным – с четырьмя другими атомами углерода.

Рис. 3. Наличие кратных связей и бензольных колец
3. КЛАССИФИКАЦИЯ ПО НАЛИЧИЮ КРАТНЫХ СВЯЗЕЙ И БЕНЗОЛЬНЫХ КОЛЕЦ
Второй признак классификации – наличие (или отсутствие) в молекуле кратных связей и бензольных колец. Органические вещества, содержащие только простые (одинарные) связи, называют предельными или насыщенными. Вещества, которые содержат не только простые, но и кратные (двойные или тройные) связи между атомами углерода, называют непредельными или ненасыщенными. На один атом углерода в их молекулах приходится меньшее число атомов водорода, чем у предельных соединений. Если вещество содержит бензольное кольцо, то его принято называть ароматическим соединением. Вещества, в состав которых не входят ароматические группировки, называют алифатическими. Иногда можно встретить устаревшее название алифатических соединений – соединения жирного ряда.

Рис. 4. Классификация по наличию функциональных групп
4. КЛАССИФИКАЦИЯ ПО НАЛИЧИЮ ФУНКЦИОНАЛЬНЫХ ГРУПП
Третий признак классификации – наличие (или отсутствие) функциональных групп. Производные углеводородов образуются при замещении атома водорода на какой-либо другой атом (Cl, Br) или группировку атомов (OH – гидроксогруппа, NH2 – аминогруппа и т.п.). Такие атом или группировка атомов во многом определяют свойства вещества, и поэтому многие из них называют функциональными группами. По числу функциональных групп в молекуле вещества делят на монофункциональные, полифункциональные (несколько одинаковых групп) и гетерофункциональные (разные функциональные группы).
Вещества, обладающие одинаковыми функциональными группами и (или) одинаковым набором кратных связей, имеют сходные свойства, поэтому их относят к одному классу органических соединений. Например, вещества, содержащие ОН-группу, относятся к классу спиртов. СН3ОН – метиловый спирт, С2Н5ОН – этиловый спирт и т.д.
Вещества, содержащие кратные связи, тоже образуют классы близких по свойствам соединений. Соединения с двойной связью, называются алкенами, с тройной связью – алкинами. Предельные углеводороды, или алканы – это соединения, не содержащие ни кратных связей, ни функциональных групп. Они также составляют отдельный класс органических веществ. Ароматические углеводороды называют аренами.
5. ГОМОЛОГИЧЕСКИЕ РЯДЫ
Ряды веществ с похожими свойствами, состав которых отличается на одну или несколько групп CH2-, называют гомологическими рядами. Члены гомологических рядов по отношению друг к другу – гомологи. По сути, гомологические ряды составляют классы органических соединений. Рис. 5.
|
|
Рис. 5. Примеры гомологических рядов
Гомологи обладают одинаковыми химическими свойствами.
6. ПРИМЕРЫ КЛАССИФИКАЦИИ РАЗНЫХ ОРГАНИЧЕСКИХ ВЕЩЕСТВ
Данный урок познакомил вас с темой «Классификация органических соединений». Были систематизированы знания учащихся об органических веществах, определены критерии классификации органических соединений. Вы узнали о составлении схемы классификации органических веществ, что такое скелет молекул, как классифицируют вещества по классам и функциональным группам.
ГРУППА 508 химия 6
Тема 6 :. Способы разрыва связей в молекулах органических веществ. Электрофилы. Нуклеофилы.
Разрыв ковалентной связи может происходить двумя способами.
1. Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим:
Например,
CH4 свет→ CH3∙ + ∙H
Cl2 свет→ Cl∙ + ∙Cl
В результате гомолитического разрыва образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами.
Радикал – свободный атом или частица с неспаренными электронами, неустойчив и способный быстро вступать в химическую реакцию.
Гомолитический разрыв сопровождает процессы, осуществляемые при высоких температурах; на свету; при радиоактивном облучении в отсутствие растворителя (в газовой фазе) или неполярных растворителях. Гомолитическому разрыву подвергаются малополярные или неполярные связи C-C, C-H, Cl-Cl и др.
2. Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим:
А+ - электрофильная частица, :В- - нуклеофильная частица
Например,
CH3Сl → CH3+ + :Cl-
В результате образуются разноименно заряженные ионы - катион и анион. Если заряд иона сосредоточен на атоме углерода, то катион называют карбокатионом, а анион - карбанионом.
Устойчивы более разветвлённые катионы!
Ионный тип разрыва связи характерен для П- связей и полярных σ – связей; при наличии полярного растворителя или катализатора.
Классификация реакций по механизму разрыва ковалентных связей
По способу разрыва ковалентных связей органические реакции подразделяются на радикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего на молекулу, на электрофильные и нуклеофильные.
1. Свободнорадикальный (гомолитический) разрыв связей
Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим:
Такому разрыву подвергаются неполярные и малополярные ковалентные связи под действием света или высокой температуры. Образующиеся частицы содержат неспаренные электроны и называются свободными радикалами. Эти частицы обладают большой энергией и очень активны.
2. Ионный (гетеролитический) разрыв связей
Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим:
В результате образуются разноименно заряженные ионы – катион и анион. Если заряд иона сосредоточен на атоме углерода, то катион называют карбокатионом, а анион — карбанионом.
Карбокатион
Карбоанион
Устойчивы более разветвлённые катионы.
Такому разрыву подвергаются полярные ковалентные связи.
Образующиеся органические ионные частицы отличаются от неорганических тем, что они возникают в момент реакции.

ГРУППА 401 химия 5,6
Тема: 5 Общие способы получения металлов. Понятие о металлургии. Пирометаллургия, гидрометаллургия и электрометаллургия. Сплавы черные и цветные
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, медь восстанавливают из куприта Cu2O прокаливанием с углем (коксом):
SnО2+ 2С = Sn + 2СО↑; Cu2O + С = 2Cu+ СО ↑.
Алюминотермия и магниетермия способы получения металлов, основанные на восстановлении металлов из их соединений (оксидов, галогенидов и др.) более активными металлами (Al и Mg). Например:
tо
2Al + 3BaO → 3Ba + Al2O3
TiCl4 + 2Mg → Ti + 2MgCl2
Металлотермические опыты получения металлов впервые осуществил русский ученый Н. Н. Бекетов в XIX в.
Восстановительные свойства металлов проявляются при взаимодействии с неметаллами. Например:
H2O
2Al + 3I2 → 2AlI3 (инициатором реакции является вода)
to
2Fe + 3Cl2 → 2FeCl3 (реакция горения)
2Na + S → Na2S (реакция идет самопроизвольно при смешивании серы и натрия)
Основными восстановителями для получения металлов являются С, СО, Н2.
Например:

Кроме восстановителей для получения металлов ещё используют электрохимический способ – электролиз.
Электролиз получил широкое распространение в металлургии цветных металлов и в ряде химических производств. Такие металлы, как алюминий, цинк, магний, получают главным образом путём электролиза.
Сущность электролиза заключается в выделении из электролита частиц вещества при протекании через электролитическую ванну постоянного тока и осаждении их на погруженных в ванну электродах. Цель процесса - получение возможно более чистых незагрязнённых примесями металлов.

Рис. 6. Процессы, протекающие при электролизе.
Схема электролизной ванны: 1 - ванна, 2 - электролит, 3 - анод, 4 - катод, 5 - источник питания
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
Задания необходимо решать с использование ряда напряжения металлов:

Задание 1: Составьте уравнение реакций взаимодействия металлов с кислотами, расставьте коэффициенты и найдите их сумму.
Al + Н2SО4 →
Fe + Н2SО4 →
Алюминий и железо стоят левее водорода в ряду напряжения металлов, поэтому могут вытеснить водород из разбавленных кислот. При прохождении реакции наблюдаем выделение водорода в виде мелких пузырьков.

Коэффициенты расставляем, уравнивая количество атомов одного элемента до и после стрелки.
Сумма коэффициентов в уравнении с алюминием : 9 (2+3+1+3).
В уравнении с железом: 4 (1+1+1+1).
Сплавы металлов и их классификация
Одним из первых металлов, который человек стал применять для своих нужд, была медь. Но ещё в III тысячелетии люди обнаружили, что медь, сплавленная с оловом, позволяет делать более прочное оружие, долговечную посуду. Материал, полученный при сплавлении меди с оловом, получил название «бронза». Это был первый сплав, изготовленный человеком.
Сплавом называют искусственный материал с металлическими свойствами, состоящий из двух или более компонентов, из которых, по крайней мере, один является металлом.
В зависимости от количества компонентов различают двойные (бинарные), тройные и многокомпонентные сплавы. Сплавы могут иметь однородную структуру (гомогенные сплавы), а также состоять из нескольких фаз (гетерогенные сплавы). В зависимости от своих свойств сплавы подразделяются на легкоплавкие, тугоплавкие, жаропрочные, высокопрочные, твердые, коррозионно-устойчивые. По предполагаемой технологии обработки различают литейные (изделия производят путём литья) и деформируемые (обрабатывают путём ковки, проката, штамповки, прессования) сплавы.
Чёрные металлы и сплавы на их основе
В зависимости от природы металла, составляющего основу сплава, различают чёрные и цветные сплавы. В чёрных сплавах основным металлом является железо. Самыми распространенными из чёрных сплавов являются сталь и чугун. К чёрным металлам относятся железо, а также марганец и хром, которые входят в состав чёрных сплавов.
Чугун
Чугун – сплав на основе железа, содержание углерода в котором превышает точку предельной растворимости углерода в расплаве железа (2,14%). При остывании сплава, углерод кристаллизуется в виде отдельных включений цементита и графита. Углерод придает чугуну твердость, но снижает пластичность сплава, поэтому чугун хрупкий. Чугун применяют для изготовления литых деталей (коленчатых валов, колёс, труб, радиаторов отопления, ванн, решеток ограждения), кухонной посуды (сковородок, чугунков, казанов).
Сталь
В стали содержание углерода значительно меньше. В низкоуглеродистых сталях количество углерода не превышает 0,25%, в высокоуглеродистой стали содержание углерода может достигать 2%. Самые первые стальные изделия появились 4000 лет назад. В настоящее время выплавляют стальные сплавы с различными свойствами. Это конструкционные, нержавеющие, инструментальные, жаропрочные стали.
Легирующие добавки
Для придания стали особых свойств в процессе её изготовления, вводят легирующие добавки. Легирующими добавками называют вещества, которые добавляют в сплав в определенном количестве для изменения механических и физических свойств материала.
Легированные стали
В зависимости от количества легирующих добавок различают низколегированную, среднелегированную и высоколегированную сталь. Марка стали обозначается с помощью букв и цифр. Буква указывает на химическую природу легирующей добавки, а цифра, стоящая после буквы – на примерное содержание этой добавки в сплаве. Если содержание добавки меньше 1%, то цифру не ставят. Цифры впереди букв показывают содержание углерода в сотых долях процента. Например, в стали марки 18ХГТ содержится 0,18 % С, 1 % Сr, 1 % Мn, около 0,1 % Тi.
Стали применяют для изготовления армирующих железнодорожных рельсов, дробильных установок, конструкций, турбин электростанций и двигателей самолётов, инструментов (пилы, сверла, резцы, зубила, фрезы), химической аппаратуры, деталей автомобилей, тракторов, дорожных машин, труб и много другого.
Цветные металлы и сплавы на их основе
К цветным металлам относят алюминий, цинк, медь, никель, олово, свинец и др. Сплавы на основе цветных металлов называют цветными. Это бронза, латунь, силумин, дюралюминий, баббиты и многие другие. В авиации широкое применение нашли легкие и прочные сплавы на основе алюминия и титана. Изделия из медных сплавов: бронзы и латуни, применяются в химической промышленности, для изготовления запорной аппаратуры: кранов, вентилей. Сплавы на основе олова и свинца используют для изготовления подшипников. Из мельхиора и нейзильбера – сплавов меди и никеля, изготовляют столовые наборы, монеты.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Расчет массовой доли металла в сплаве
Условие задачи: Кусочек нейзильбера массой 2,00 г поместили в раствор гидроксида натрия. В ходе реакции выделилось 0,14 л водорода (н.у.). Вычислите массовую долю цинка в сплаве. Ответ запишите в процентах с точностью до десятых долей.
Шаг первый: запишем уравнение реакции цинка с раствором гидроксида натрия:
Zn + 2NaOH → Na2ZnO2 + H2↑.
Один моль цинка вытесняет из щёлочи один моль водорода.
Шаг второй: найдём количество цинка, которое вытеснило 0,14 л водорода.
Для этого найдём в периодической таблице элементов Д.И. Менделеева молярную массу цинка: М(Zn) = 65 г/моль. При нормальных условиях 1 моль любого газа занимает объём, равный 22,4 л. Составим пропорцию:
65 г цинка вытесняет 22,4 л водорода;
х г цинка вытесняет 0,14 л водорода.
65 : х = 22,4 : 0,14, откуда х = (65·0,14) : 22,4 = 0,41 (г) – масса цинка в сплаве.
Шаг третий: найдём массовую долю цинка в сплаве:
ω = (0,41 : 2,00)*100 = 20,5 (%).
Ответ: 20,5
Тема 6. Неметаллы. Особенности строения атомов.
Неметаллы – простые вещества. |
ПОЛОЖЕНИЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ-НЕМЕТАЛЛОВ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА
Из более сотни известных химических элементов простые вещества неметаллы образуют 22 элемента, причем все они находятся в главных (А) подгруппах.
Элементы-неметаллы находятся в правом верхнем углу Периодической таблицы, в главных подгруппах выше диагонали бериллий – астат. Причем с увеличением номера главной подгруппы число неметаллов в ней закономерно увеличивается на один (рис. 1).

Рис. 1. Расположение неметаллов среди элементов подгрупп А (выделены красным)
ОСОБЕННОСТИ СТРОЕНИЯ АТОМОВ НЕМЕТАЛЛОВ
Неметаллические свойства связаны со способностью атомов элементов присоединять к себе электроны. Притяжение внешних электронов к ядру тем сильнее, чем меньше размеры атома и больше заряд ядра. В периоде с ростом заряда ядра от элемента к элементу радиус атома уменьшается, сильнее становится притяжение внешних электронов к ядру и неметаллические свойства усиливаются. Вместе с тем от периода к периоду радиус атома увеличивается из-за увеличения числа электронных слоев, и ядра этих атомов все слабее притягивают к себе внешние электроны. Поэтому с ростом номера периода в нем уменьшается количество элементов-неметаллов.
На внешнем электронном слое в атомах неметаллов большее число электронов, чем в атомах металлов. Электроотрицательность атомов неметаллов существенно выше, чем атомов металлов.
ОСОБЕННОСТИ СТРОЕНИЯ ЭЛЕМЕНТОВ VIII-A ПОДГРУППЫ
Элементы VIII-А подгруппы завершают каждый период.
Особенностью строения атомов неона, аргона, криптона, ксенона и радона является устойчивый восьмиэлектронный внешний слой (октет), а гелия – двухэлектронный (дуплет). При обычных условиях их простые вещества, как правило, не вступают в химические реакции и представляют собой одноатомные газы. Поэтому их часто называют инертными, или благородными, газами. Последнее название более целесообразно, так как известны некоторые соединения этих элементов (например, оксид ксенона, фторид радона и др.).
ИЗМЕНЕНИЕ СВОЙСТВ НЕМЕТАЛЛОВ В ГРУППАХ
В группах с увеличением заряда ядра увеличивается радиус атома, т. к. растет число электронных слоев в атоме. Следовательно, способность притягивать электроны, электроотрицательность и окислительные свойства уменьшаются.
В периодах же, наоборот, с увеличением заряда ядра электроотрицательность и окислительные свойства увеличиваются, т. к. уменьшается радиус атома.
Самый электроотрицательный элемент – это фтор. Поэтому он и самый активный неметалл.
Изменение некоторых свойств элементов неметаллов рассмотрено в таблице на рис. 2 на примере элементов третьего периода.
Свойства | Si | P | S | Cl |
Порядковый номер | 14 | 15 | 16 | 17 |
Число внешних электронов | 4 | 5 | 6 | 7 |
Радиус атома в нм | 0,117 | 0,111 | 0,104 | 0,099 |
Высшая степень окисления | +4 (SiO2) | +5 (Р2О5) | +6(SO3) | +7 (Cl2O7) |
Низшая степень окисления | -4 (SiH4) силан | -3 (PH3) фосфин | -2 (H2S) сероводород | -1 (HCl) хлороводород |
Неметаллический характер |
усиливается | |||
Рис. 2. Сравнение свойств неметаллов третьего периода
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Распространенность неметаллов в космосе и на земле различна.
Самый распространенный элемент земной коры – кислород, он составляет примерно половину общей массы элементов, образующих земную кору (49,13 %). Кислород также является составной частью атмосферы, он занимает 21 % ее объема.
Вторым по распространенности на земле элементом является кремний. Его в земной коре 27,6 % по массе. Кремний с кислородом образует самые разнообразные природные соединения вследствие своего особенного родства с кислородом.
К распространенным элементам неметаллам следует отнести и азот. В земной коре его 0,01 % по массе, а в атмосфере – 78 % по объему.
Водород распространен в земной коре незначительно – всего 1 % по массе. Но во Вселенной он является господствующим элементом. Его особая роль в жизни Вселенной заключается в том, что водород является источником энергии, питающей Солнце и другие звезды.
В значительно меньших количествах, чем перечисленные элементы, в природе встречаются углерод, фосфор, сера. Но эти элементы наряду с кислородом, углеродом и водородом входят в состав живых организмов и выполняют важные биологические функции. Поэтому их называют биогенными элементами.
Подведение итогов урока
Из материалов урока вы узнали, почему химических элементов-неметаллов намного меньше, чем металлов, как различаются по строению атомы металлов и неметаллов, а также какими свойствами обладают неметаллические элементы.