ПОНЕДЕЛЬНИК, 20.09.21г. 306, 308, 408, 301
ГРУППА 306 ХИМИЯ
ТЕМА:Зависимость свойств галогенов от их положения в Периодической системе.Окислительные и восстановительные свойства неметаллов в зависимости от их положения в ряду электроотрицательности.
Галогены расположены в 17 группе Периодической системы химических элементов Д.И. Менделеева.
На внешнем энергетическом уровне атомы галогенов имеют 7 электронов, их электронная конфигурация ns2np5. Они легко присоединяют по одному электрону, проявляя степень окисления -1. Такую степень окисления галогены имеют в соединениях с металлами и водородом. Атомы галогенов, кроме фтора, могут проявлять положительные степени окисления: +1; +3; +5; +7. Фтор, как самый электроотрицательный элемент, в своих соединениях проявляет степень окисления -1. В пределах каждого периода галогены являются наиболее электроотрицательными элементами, обладающими наибольшим сродством к кислороду. Внутри подгруппы при переходе от фтора к йоду увеличивается радиус атома, уменьшается относительная электроотрицательность, ослабевают неметаллические свойства и окислительная способность.
Окислительные и восстановительные свойства неметаллов в зависимости от их положения в ряду электроотрицательности.
Если для металлов характерны только нулевая степень окисления (в состоянии простого вещества) и положительные степени окисления в соединениях, то неметаллы в своем большинстве проявляют как как нулевые (в простом состоянии), так и положительные и отрицательные степени окисления в соединениях. Только фтор в соединениях всегда проявляет степень окисления -1, и кислород - 2.
Лишь в немногочисленных соединениях со фтором кислород проявляет степень окисления +1
Таким образом, простое вещество фтор в реакция - всегда окислитель, простое вещество кислород в реакциях - почти всегда окислитель. Остальные неметаллы в соединениях могут иметь
как положительные, так и отрицательные степени окисления в соединениях , то есть проявлять как окислительные, так и свойства. восстановительные свойства.
Задание: записать по 3 уравнения реакции характеризующей эти свойства, указать окислители и восстановители.
а) взаимодействие неметаллов с металлами. В этих реакциях металлы всегда восстановители, а неметаллы - всегда окислители.
Чем выше окислительная способность неметалла, тем более глубоким будет окислительное действие на металл. Если металл проявляет переменную степень окисления в соединениях, то более активный неметалл окисляет металл до более высокой степени окисления.
+8
Оs + 4F₂ = OsF₈
2Os + 3Cl₂ = 2OsCl₃
2Os + 2I₂ = 2OsI₂
Малоактивные неметаллы проявляют окислительные свойства только по отношению к активным металлам, например:
2Na⁰ + H₂⁰ = Na⁺H⁻ Ca⁰ + H₂⁰ = Ca⁺²H₂
А вот активный фтор взаимодействует не только с большинством металлов средней активности, но также и со многими металлами, стоящими в ряду напряжений после водорода, например с платиной:
Pt + 2F₂ = PtF4
Как было сказано неметаллы могут вступать в реакцию с другими неметаллами, но при этом надо учитывать, что более активные неметаллы в этих реакциях будут окислителями, а менее активные - восстановителями
Например, в реакции углерода с кислородом
С⁰ + О₂⁰ = С⁺⁴ О₂⁻² углерод - восстановитель, кислород - окислитель.
А в реакции углерода с водородом С + 2Н₂ = С⁻⁴Н₄⁺¹ углерод -окислитель, а водород - восстановитель
Но реакции между неметаллами зависят не только от положения
неметаллов в ряду напряжений, но также от состояния неметаллов и прочности связей между атомами неметаллов в молекуле.
Например, кислород легко реагирует с водородом при поджигании, с фосфором при нагревании, с азотом - при температуре выше 2000⁰ + катализатор, а реакция между хлором и кислородом - практически не осуществима.
В реакции с водой активность неметаллов проявляется по разному.
Сl₂⁰ + H2O + HCl⁻¹ + HCl⁺¹O
По такой же схеме реагирут иод, но реакция протекает очень медленно
ГРУППА 308 ХИМИЯ
ТЕМА:
Понятие об альдегидах
 Современный рынок конструкционных и отделочных материалов необыкновенно богат. Древесно-стружечные плиты, из которых изготовлена мебель, искусно маскируются под натуральное дерево. Искусственный камень, из которого сделаны столешницы кухонной мебели, внешне трудно отличить от натурального камня. Стеновые панели и пластиковая вагонка окрашены во все цвета радуги и легко монтируются. Ламинат или линолеум создают иллюзию настоящей древесины. Ручки кухонной посуды, корпуса розеток и выключателей должны выдерживать высокую температуру или электрическое напряжение, при этом не гореть, не плавиться, отвечать гигиеническим нормам, а потому должны быть изготовлены из веществ, соответствующих установленным требованиям.
Современный рынок конструкционных и отделочных материалов необыкновенно богат. Древесно-стружечные плиты, из которых изготовлена мебель, искусно маскируются под натуральное дерево. Искусственный камень, из которого сделаны столешницы кухонной мебели, внешне трудно отличить от натурального камня. Стеновые панели и пластиковая вагонка окрашены во все цвета радуги и легко монтируются. Ламинат или линолеум создают иллюзию настоящей древесины. Ручки кухонной посуды, корпуса розеток и выключателей должны выдерживать высокую температуру или электрическое напряжение, при этом не гореть, не плавиться, отвечать гигиеническим нормам, а потому должны быть изготовлены из веществ, соответствующих установленным требованиям.
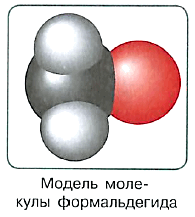
Что же общего между такими непохожими предметами быта? При изготовлении многих из них используют полимерные вещества, получаемые на основе органического вещества формальдегида. Формальдегид имеет формулу СН2О, однако чаще всего её записывают в виде НСНО, поскольку она точнее отражает строение молекулы: 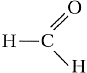
Между атомами углерода и кислорода имеется двойная связь. Группу 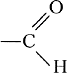
(или —СНО) называют альдегидной группой. Именно она определяет принадлежность соединения к классу альдегидов.
| Вещества, в молекулах которых альдегидная группа связана с углеводородным радикалом (или атомом водорода), называют альдегидами. |

(с) Цитата из справочного издания «ХИМИЯ. Справочник в таблицах / М.: Издательство АЙРИС-пресс»
Гомологический ряд альдегидов
Формальдегид (метаналь) — родоначальник гомологического ряда альдегидов. Это бесцветный ядовитый газ с характерным запахом, хорошо растворимый в воде. Водный раствор формальдегида называют формалином.
Общая формула представителей гомологического ряда альдегидов СnН2nО. Обозначив углеводородный радикал буквой R, общую формулу альдегидов можно записать так: 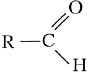
Формулы и названия первых представителей этого класса органических веществ приведены в таблице 6. Международные названия альдегидов образуются от названий соответствующих алканов с добавлением суффикса -аль.
ГРУППА 408 ХИМИЯ
ТЕМА: Способы разрыва связей в молекулах органических веществ. Электрофилы. Нуклеофилы.
Разрыв ковалентной связи может происходить двумя способами.
1. Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим:
Например,
CH4 свет→ CH3∙ + ∙H
Cl2 свет→ Cl∙ + ∙Cl
В результате гомолитического разрыва образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами.
Радикал – свободный атом или частица с неспаренными электронами, неустойчив и способный быстро вступать в химическую реакцию.
Гомолитический разрыв сопровождает процессы, осуществляемые при высоких температурах; на свету; при радиоактивном облучении в отсутствие растворителя (в газовой фазе) или неполярных растворителях. Гомолитическому разрыву подвергаются малополярные или неполярные связи C-C, C-H, Cl-Cl и др.
2. Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим:
А+ - электрофильная частица, :В- - нуклеофильная частица
Например,
CH3Сl → CH3+ + :Cl-
В результате образуются разноименно заряженные ионы - катион и анион. Если заряд иона сосредоточен на атоме углерода, то катион называют карбокатионом, а анион - карбанионом.
Устойчивы более разветвлённые катионы!
Ионный тип разрыва связи характерен для П- связей и полярных σ – связей; при наличии полярного растворителя или катализатора.
ГРУППА 301 ХИМИЯ
ТЕМА: Общие способы получения металлов. Понятие о металлургии. Пирометаллургия, гидрометаллургия и электрометаллургия. Сплавы черные и цветные.
Все способы получения металлов можно разделить на пирометаллургические и электрометаллургические.

В процессе электролиза за счёт электрической энергии осуществляется химическая реакция, которая самопроизвольно идти не может.

ТЕМА:Неметаллы. Особенности строения атомов. Неметаллы – простые вещества. |
Строение атомов неметаллов и их особенности
Общие сведения о строении неметаллов
Неметаллы –химические элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы.
Фтор, хлор, кислород, азот, водород и инертные газы представляют собой газообразные вещества, йод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор –твёрдые вещества; бром -жидкость.
Электронное строение неметаллов и их особенности
В отличие от металлов, неметаллы имеют гораздо большее количество валентных электронов (электроны внешнего энергетического уровня), что дает им возможность в большинстве случаев проявлять себя в качестве окислителей (присоединять электроны) в ОВР. Чем меньше электронов необходимо присоединить атому неметалла до завершения внешнего уровня, тем большую окислительную способность он проявляет.
Электронная конфигурация валентных электронов неметаллов в общем виде — ns2np1−5 Исключение составляют водород (1s1) и гелий (1s2), которые тоже рассматривают как неметаллы.
Неметаллы обычно обладают большим спектром степеней окисления в своих соединениях, чем металлы, поэтому иногда могут выступать в роли восстановителей в ОВР.
Неметаллы образуют как одноатомные (инертные газы), так и двухатомные молекулы (азот, кислород, водород и галогены). Для многих неметаллов характерно явление аллотропии, т.е. существование элементов в виде нескольких простых веществ – аллотропных модификаций (углерод – алмаз, графит, фуллерены и т.д.; кислород и озон).
Примеры решения задач
| Задание | Какой объем оксида углерода (IV) (н. у.) получится при разложении известняка массой 500 г, содержащего 20% примесей? |
| Решение | Запишем уравнение реакции разложения известняка: CaCO3 = CaO + CO2 ↑. Найдем массу чистого (без примесей) карбоната кальция: m(CaCO3) = m(limestone) × (1-ωadmixture) m(CaCO3) = 500 × (1-0,2) = 400 г. Найдем количество вещества карбоната кальция (молярная масса равна 100 г/моль): n= m / M; n(CaCO3) = m(CaCO3) / M(CaCO3); n(CaCO3) = 400/ 100 = 4 моль. Согласно уравнению реакции n(CO2) : n(CaCO3) = 1:1, т.е. n(CaCO3) = n(CO2) = 4 моль. Тогда объем выделившегося углекислого газа составит: V = n × Vm; V(CO2) = n(CO2) × Vm; V(CO2) = 4 × 22,4 = 89,6 л. |
| Ответ | Объем оксида углерода (IV) равен 89,6 л. |
| Задание | Осуществите ряд химических превращений: S→H2S→SO2→SO3→H2SO4. |
| Решение | Получение сероводорода из серы осуществляют путем её восстановления водородом: S + H2 = H2S. Оксид серы (IV) из сероводорода получают путем его окисления кислородом: 2H2S + 3O2 = 2SO2 + 2H2O. Чтобы получить оксид серы (VI) из оксида серы (IV) необходимо окислить оксид серы (IV) кислородом: 2SO2 + O2 = 2SO3. Оксид серы (VI) типичный кислотный оксид, который при взаимодействии с водой образует кислоту, поэтому, для того, чтобы получить серную кислоту из оксида серы (VI) необходимо пропустить его через воду: SO3 + H2O = H2SO4. |
При нормальных условиях в газообразном состоянии находятся водород, азот, фтор, хлор и инертные газы. Бром — единственный жидкий неметалл, остальные неметаллы — твёрдые вещества. Атомы инертных газов не соединены в молекулы, двухатомные молекулы простых веществ образуют водород
Среди неметаллов распространено явление аллотропии.
явление существования химического элемента в виде двух или нескольких простых веществ.
Аллотропные видоизменения, сильно отличающиеся по своим физическим свойствам, образуют кислород, углерод, кремний, сера, фосфор, бор и другие неметаллы.
 Коротко о главном
Коротко о главном
Элементы-неметаллы находятся в
У большинства неметаллов на внешнем электронном уровне находится от трёх до семи электронов.
Для неметаллов характерны высокие значения электроотрицательности. Самым электроотрицательным элементом является фтор.
Для неметаллов не характерна общность физических свойств.
Среди неметаллов распространено явление аллотропии.
В зависимости от условий неметаллы могут проявлять в химических реакциях как окислительные, так и восстановительные свойства.
Простые вещества — неметаллы образуют элементы главных подгрупп, расположенные в правой верхней части периодической системы (правее диагонали, соединяющей бор и астат).
Для их атомов характерно наличие на внешнем уровне 4-8 электронов. Так, у азота на внешнем уровне 5 электронов (соответствует номеру группы), у кислорода — 6, у хлора — 7 электронов.
Электроны в атомах этих элементов прочнее связаны с ядром, поэтому для неметаллов характерны такие физические свойства, как
- отсутствие электрической проводимости (исключение — графит),
- низкая, по сравнению с металлами, теплопроводность,
- хрупкость.
Химические свойства НЕМЕТАЛЛОВ
В реакциях с металлами и водородом неметаллы являются окислителями.
- Например, порошок серы при нагревании реагирует с железными опилками с образованием сульфида железа:
Fe0 + S0 = Fe+2S−2 - При высокой температуре сера реагирует с водородом (например, если пропускать водород через расплавленную серу). Образуется газ с запахом тухлых яиц — сероводород:
H20 + S0 = H2+1S−2
В реакциях с кислородом неметаллы являются восстановителями:
- S0 + O20 = S+4O2−2 (при горении серы образуется оксид серы (IV), или серни́стый газ)
C0 + O20 = C+4O2−2 (графит сгорает с образованием оксида углерода (IV), или углекислого газа)
Галогены не соединяются с кислородом напрямую, но можно получить их оксиды, в которых они проявляют положительную степень окисления, например, оксид хлора (VII) Cl2O7.
Фторид кислорода O+2F2−1 — соединение, в котором кислород проявляет положительную степень окисления
Задача. Вычисление объема полученного газа, если известна масса исходного вещества.
Объем газов рассчитывается по формуле:
v = 22,4 л/моль • n,
где 22,4 — молярный объем, т. е. объем одного моля любого газа,
n — количество вещества (моль)
Пример:
Сколько литров водорода выделится при разложении электрическим током воды массой 72 г?
Решение:
- M (H2O) = 1 • 2 + 16 = 18 г/моль
- Находим количество вещества воды по условию задачи:
n = m / M = 72 г : 18 г/моль = 4 моль - Записываем над уравнением реакции имеющиеся данные, а под уравнением — число моль согласно уравнению (равно коэффициенту перед веществом):
4 моль x моль
2H2O = 2H2↑ + O2↑
2 моль 2 моль - Составляем пропорцию:
4 моль — x моль
2 моль — 2 моль
(или с пояснением:
из 4 моль воды получится x моль водорода,
а из 2 моль — 2 моль) - Находим x:
x = 4 моль • 2 моль / 2 моль = 4 моль - Находим объем водорода:
v = 22,4 л/моль • 4 моль = 89,6 л
Ответ: 89,6 л.


