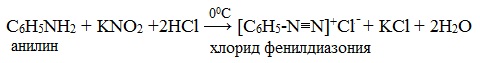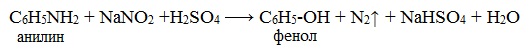19.12.22г. ПОНЕДЕЛЬНИК 501,406,405
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 501 ХИМИЯ 21,22
ТЕМА 21: Состав смесей: объемная и массовая доли компонентов смеси, массовая доля примесей.
Смесь – структура, образующаяся из двух и более веществ.
Вещества, входящие в состав смеси, называют компонентами.
Например, воздух – смесь азота, кислорода, углекислого газа и других.
Если масса одного компонента в десятки раз меньше массы другого компонента смеси, то его называют примесью.
Например, воздух может быть загрязнен угарным газом.
Массовая доля в жидких и твердых смесях рассчитывается по формуле:
Массовая доля в смеси газов (φ) рассчитывается по формуле:
Задача. В 10 мл дистиллированной воды растворили 1 г поваренной соли. Найдите массовую долю растворенного вещества.
Найти массу раствора. m (р-ра) = m (H2O) + m (NaCl) = 10 г + 1 г = 11 г
Найти массовую долю соли. ω (NaCl) = (1 г/11 г) * 100 % = 9,09 %
Ответ: ω (NaCl) = 9,09 %
Задача. В 4 л растворе содержится 100 г соляной кислоты HCl.
Рассчитайте массовую долю растворенного вещества, учитывая, что плотность соляной кислоты – 1,098 г/мл.
Найти массу вещества. m(р-ра) = V * p = 4000 мл * 1,098 г/мл = 4392 г
Найти массовую долю кислоты. ω (НCl) = (100 г/4392 г) * 100 % = 2,277 %
Ответ: ω (НCl) = 2,277 %
Задача. К 700 г 48%-ного раствора добавили 30 г это же соли, которая находится в растворе. Определите массовую долю в полученной смеси?
Найти массу раствора.
m(р-ра) = 700 г + 30 г = 730 г
Найти массу растворенного вещества в исходном растворе.
m1(соли) = 700 г * 48 %/ 100 % = 336 г
Найти массу вещества в полученном растворе. m2 (соли) = 336 г + 30 г = 366 г
Найти массовую долю соли в растворе.
ω (соли) = 366 г * 100 %/ 730 г = 50,137 %
Ответ: ω (соли) = 50,137 %
В жизни редко встречаются чистые вещества, чаще - смеси веществ. Воздух – это смесь азота, кислорода и других газов, морская вода – смесь воды и растворенных солей.
Смеси - это физические сочетания чистых веществ, не имеющие определенного или чистого состава.
Примером смеси может служить обыкновенный чай (напиток), который многие самостоятельно готовят и пьют по утрам.
Кто-то любит крепкий чай (большое кол-во заварки), кто-то любит сладкий чай (большое кол-во сахара)… Как видим, смесь под названием "чай" всегда получается немного разной, хотя и состоит из одних и тех же компонентов. Однако, следует отметить, что каждый компонент смеси сохраняет набор своих характеристик, поэтому, разные вещества можно выделить из смеси.
Гомогенные и гетерогенные смеси.
Гетерогенные смесиполностью не смешаны, так как чистые вещества существуют в ясно отграниченных фазах, то есть это многофазные материалы.
Гомогенные смеси — это на молекулярном уровне смешанные чистые вещества, то есть однофазные материалы.
Гомогенные смеси делятся по агрегатному состоянию на три группы:
- газовые смеси;
- растворы;
- твёрдые растворы.
Гетерогенные смеси двух веществ можно разделить по агрегатным состояниям на следующие группы:
| Твёрдые частички | Капли жидкости | Пузырьки газа | |
| В твердом теле | Сплав | Капиллярная система | Твёрдая пена, порошок |
| В жидкости | Суспензия | Эмульсия | Пена |
| В газе | Аэрозоль | Туман | Неустойчиво |
Основные способы разделения смеси
Существуют различные методы разделения смесей. Для газов эти методы основаны на разнице в скоростях либо массах молекул веществ, входящих в смесь.
ТЕМА 22: Дисперсные системы. Понятие о дисперсной системе. Дисперсная фаза и дисперсионная среда. Классификация дисперсных систем. Понятие о коллоидных системах.
ГРУППА 406 ХИМИЯ 33,34,35
ТЕМА 33 :Спирты. Получение этанола брожением глюкозы и гидратацией этилена. Гидроксильная группа как функциональная. Понятие о предельных одноатомных спиртах. Химические свойства этанола: взаимодействие с натрием, образование простых и сложных эфиров, окисление в альдегид. Применение этанола на основе свойств. Алкоголизм, его последствия и предупреждение.
Спиртами называют соединения, содержащие одну или несколько гидроксильных групп, непосредственно связанных с углеводородным радикалом.
Классификация спиртов
Спирты классифицируют по различным структурным признакам.
1. По числу гидроксильных групп спирты подразделяются на
o одноатомные (одна группа -ОН)
Например, СH3 – OH метанол, CH3 – CH2 – OH этанол
o многоатомные (две и более групп -ОН).
Современное название многоатомных спиртов - полиолы (диолы, триолы и т.д). Примеры:
двухатомный спирт – этиленгликоль (этандиол)
HO–СH2–CH2–OH
трехатомный спирт – глицерин (пропантриол-1,2,3)
HO–СH2–СН(ОН)–CH2–OH
Двухатомные спирты с двумя ОН-группами при одном и том же атоме углерода R–CH(OH)2 неустойчивы и, отщепляя воду, сразу же превращаются в альдегиды R–CH=O. Спирты R–C(OH)3 не существуют.
2. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты
o первичные R–CH2–OH,
o вторичные R2CH–OH,
o третичные R3C–OH.
Например:
3. По строению радикалов, связанных с атомом кислорода, спирты подразделяются на
o предельные (например, СH3 – CH2–OH)
o непредельные (CH2=CH–CH2–OH)
o ароматические (C6H5CH2–OH)
Непредельные спирты с ОН-группой при атоме углерода, соединенном с другим атомом двойной связью, очень неустойчивы и сразу же изомеризуются в альдегиды или кетоны.
Например, виниловый спирт CH2=CH–OH превращается в уксусный альдегид CH3–CH=O
Предельные одноатомные спирты
1. Определение
ПРЕДЕЛЬНЫЕ ОДНОАТОМНЫЕ СПИРТЫ – кислородсодержащие органические вещества, производные предельных углеводородов, в которых один атом водорода замещён на функциональную группу (-OH)
Общая формула: CnH2n+1OH или ROH или CnH2n+2O |
2. Гомологический ряд
3. Номенклатура спиртов
Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если это необходимо). Например:
Нумерация ведется от ближайшего к ОН-группе конца цепи.
Цифра, отражающая местоположение ОН-группы, в русском языке обычно ставится после суффикса "ол".
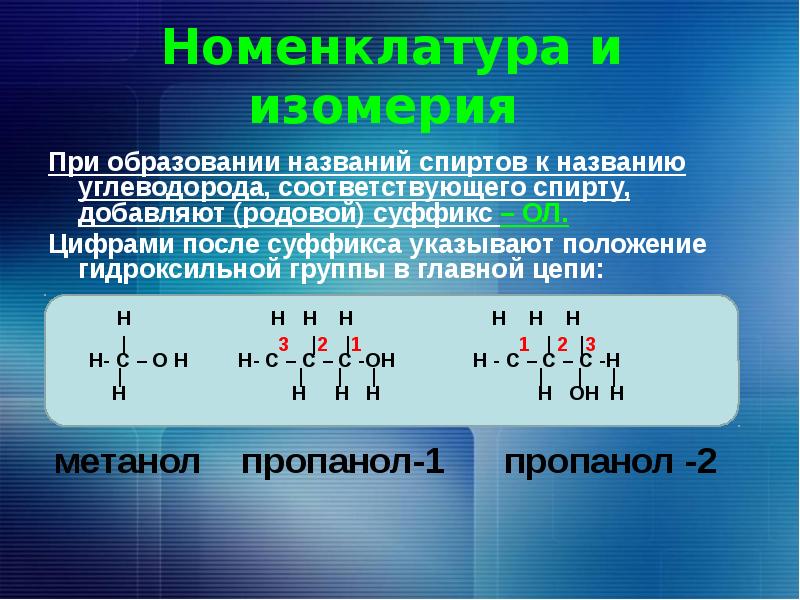 По другому способу (радикально-функциональная номенклатура) названия спиртов производят от названий радикалов с добавлением слова "спирт". В соответствии с этим способом приведенные выше соединения называют: метиловый спирт, этиловый спирт, н-пропиловый спирт СН3-СН2-СН2-ОН, изопропиловый спирт СН3-СН(ОН)-СН3.
По другому способу (радикально-функциональная номенклатура) названия спиртов производят от названий радикалов с добавлением слова "спирт". В соответствии с этим способом приведенные выше соединения называют: метиловый спирт, этиловый спирт, н-пропиловый спирт СН3-СН2-СН2-ОН, изопропиловый спирт СН3-СН(ОН)-СН3.
4. Изомерия спиртов
Для спиртов характерна структурная изомерия:
· изомерия положения ОН-группы (начиная с С3);
Например:
· углеродного скелета (начиная с С4);
Например, изомеры углеродного скелета для C4H9OH:
· межклассовая изомерия с простыми эфирами
Например,
этиловый спирт СН3CH2–OH и диметиловый эфир CH3–O–CH3
Возможна также пространственная изомерия – оптическая.
Например, бутанол-2 СH3CH(OH)СH2CH3, в молекуле которого второй атом углерода (выделен цветом) связан с четырьмя различными заместителями, существует в форме двух оптических изомеров.
5. Строение спиртов
Строение самого простого спирта — метилового (метанола) — можно представить формулами:
Из электронной формулы видно, что кислород в молекуле спирта имеет две неподеленные электронные пары.
Свойства спиртов и фенолов определяются строением гидроксильной группы, характером ее химических связей, строением углеводородных радикалов и их взаимным влиянием.
Связи О–Н и С–О – полярные ковалентные. Это следует из различий в электроотрицательности кислорода (3,5), водорода (2,1) и углерода (2,4). Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Атому кислорода в спиртах свойственна sp3-гибридизация. В образовании его связей с атомами C и H участвуют две 2sp3-атомные орбитали, валентный угол C–О–H близок к тетраэдрическому (около 108°). Каждая из двух других 2 sp3-орбиталей кислорода занята неподеленной парой электронов.
Подвижность атома водорода в гидроксильной группе спирта несколько меньше, чем в воде. Более "кислым" в ряду одноатомных предельных спиртов будет метиловый (метанол).
Радикалы в молекуле спирта также играют определенную роль в проявлении кислотных свойств. Обычно углеводородные радикалы понижают кислотное свойства. Но если в них содержатся, электроноакцепторные группы, то кислотность спиртов заметно увеличивается. Например, спирт (СF3)3С—ОН за счет атомов фтора становится настолько кислым, что способен вытеснять угольную кислоту из ее солей.
6. Физические свойства
МЕТАНОЛ (древесный спирт) – жидкость (tкип=64,5; tпл=-98; ρ = 0,793г/см3), с запахом алкоголя, хорошо растворяется в воде. Ядовит – вызывает слепоту, смерть наступает от паралича верхних дыхательных путей.
ЭТАНОЛ (винный спирт) – б/цв жидкость, с запахом спирта, хорошо смешивается с водой.
Первые представители гомологического ряда спиртов — жидкости, высшие — твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде падает. Высшие спирты практически нерастворимы в воде.
Видео-опыт: Физические свойства спиртов
Тема 34: Глицерин как представитель многоатомных спиртов. Качественная реакция на многоатомные спирты. Применение глицеринаРастворение глицерина в воде и взаимодействие с гидроксидом меди(II).
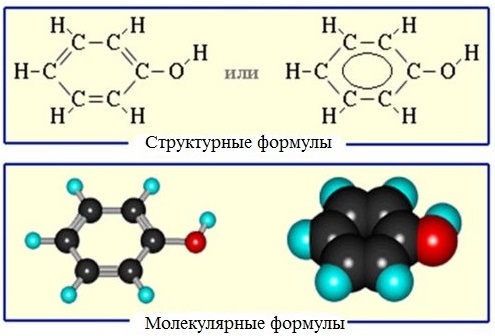
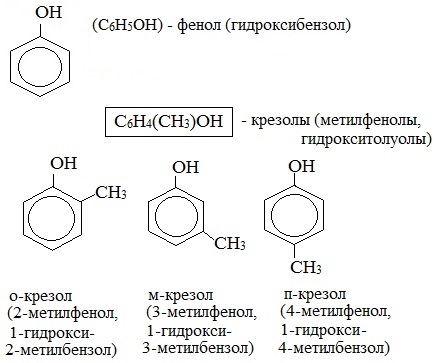
Тема 35:Фенол. Физические и химические свойства фенола. Взаимное влияние атомов в молекуле фенола: взаимодействие с гидроксидом натрия и азотной кислотой. Применение фенола на основе свойств.
Радикал фенола С6Н5 называется фенил.
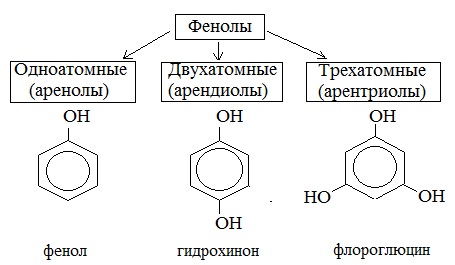
Классификация фенолов
В зависимости от числа ОН-групп в молекуле различают одно- , двух- , трехатомные фенолы.
Существуют фенолы и большей атомности.
В соответствии с количеством конденсированных ароматических циклов в молекуле различают сами фенолы (одно ароматическое ядро – производные бензола), нафтолы (2 конденсированных ядра – производные нафталина), антранолы (3 конденсированных ядра – производные антрацена) и фенантролы.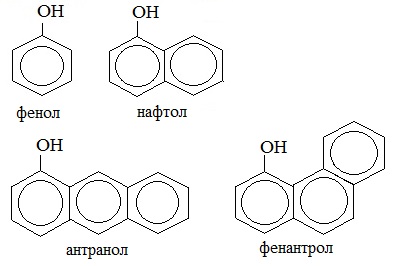
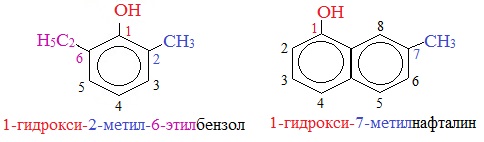
Номенклатура фенолов
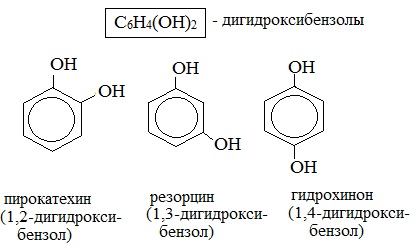
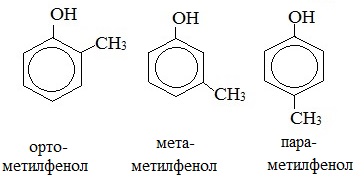
Для фенолов широко используют тривиальные названия, сложившиеся исторически: фенол, гидрохинон, резорцин и др. В названиях замещенных моноядерных фенолов используются также приставки орто- , мета- и пара- , употребляемые в номенклатуре ароматических соединений.
Простейшие двухатомные фенолы
Для более сложных соединений нумеруют атомы, входящие в состав ароматических циклов и с помощью цифровых индексов указывают положение заместителей.
При построении номенклатуры фенолов атомы углерода в бензольном кольце обозначают цифрами от 1 до 6, начиная с атома углерода, связанного с гидроксильной группой.
Изомерия фенолов
Для фенолов характерно несколько видов изомерии.
1. Изомерия положения заместителей в бензольном кольце
2. Изомерия положения групп –ОН в многоатомных спиртах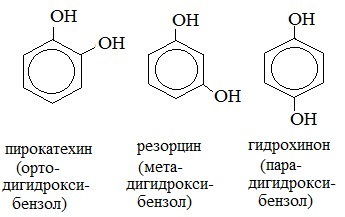
3. Межклассовая изомерия с ароматическими спиртами, простыми эфирами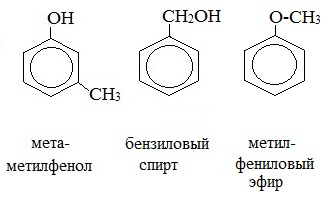
Амины – класс органических соединений, производные аммиака (NH3
СТРОЕНИЕ И КЛАССИФИКАЦИЯ АМИНОВ
Поскольку амины являются продуктами замещения водорода в аммиаке, то все они являются донорами электронной пары, принадлежащей атому азота, то есть проявляют свойства оснований (по Льюису).

Амины классифицируют:
1. По степени замещенности атомов водорода в молекуле аммиака на
- первичные амины ;
- вторичные
- третичные
- четвертичные соли аминов

Радикалы, входящие в молекулу амина могут быть одинаковыми или разными.
2. По типу радикала выделяют амины алифатического и ароматического ряда. Типичным представителем ряда ароматических аминов является анилин

Изомерия алифатических аминов
Для алифатических аминов характерна следующая изомерия:
- углеродного скелета (степени разветвленности углеводородного радикала) начиная с

- положение аминогруппы, начиная с

- изомерия аминогруппы (межклассовая изомерия), связанная с изменением степени замещенности атомов водорода при азоте. Поэтому первичные, вторичные и третичные амины изомерны друг другу:

- пространственная изомерия (оптическая, начиная с бутиламина)

НОМЕНКЛАТУРА АМИНОВ
1. По систематической номенклатуре амины называют путем добавления суффикса "амин" к названию углеводорода.
2. По рациональной номенклатуре их рассматривают как алкил- или ариламины.

У ароматических аминов в основе названия также лежит слово амин, кроме того такие соединения имеют тривиальные названия:

3. Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -
ФИЗИЧЕСКИЕ СВОЙСТВА
Первые представители ряда аминов - метиламин, диметиламин и триметиламин – газы. Остальные низшие амины – жидкости. Обладают резким характерным удушливым запахом. Канцерогены. Высшие амины – твердые вещества, без запаха. Первые представители аминов хорошо растворимы в воде. Высшие амины в воде не растворяются. Это связано с тем, что связь N–H более полярна, чем связь С–H, но менее полярна, чем связь C–O, поэтому водородные связи между молекулами аминов выражены слабее, чем, например, в молекулах спиртов.
Основные представителя ряда аминов
Алкиламины
Метиламин
По своим химическим свойствам метиламин является типичным первичным амином, то есть подобно аммиаку, образует четвертичные соли с кислотами и реагирует с водой, образуя донорно-акцепторную связь, при взаимодействии со сложными эфирами или ацилхлоридами дает амиды (подробнее см. тему: "Производные карбоновых кислот. Амиды. Ангидриды. Хлорангидриды")
Триметиламин
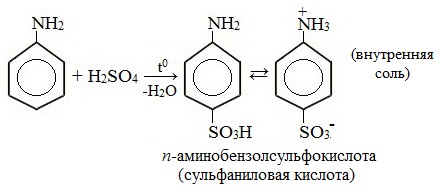
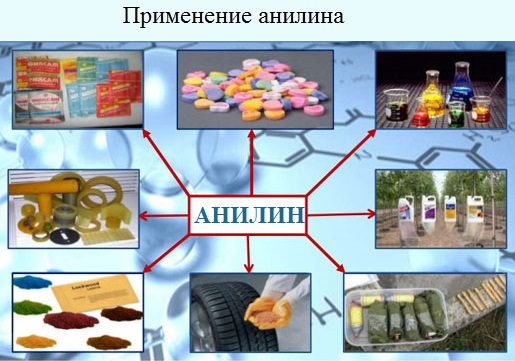
ТЕМА 43: Анилин, как органическое основание. Получение анилина из нитробензола. Применение анилина на основе свойств. Ароматические аминыАнилин
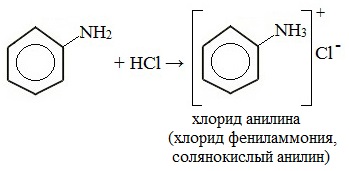
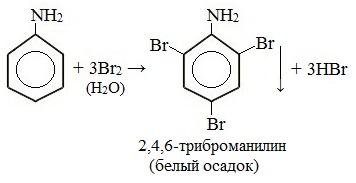
Токсическое действие анилинаАнилин ядовит, действует на центральную нервную систему, вызывает в крови образование метгемоглобина и дегенеративные изменения эритроцитов, гемолиз, следствием чего является кислородное голодание организма. Анилин проникает в организм через органы дыхания в виде паров, а также при всасывании через кожу и слизистые оболочки, которое особенно усиливается при повышении температуры воздуха и приёме алкоголя. Возможны острые и хронические (анилизм) отравления анилином. При лёгком отравлении анилином наблюдаются слабость, головокружение, головная боль, синюшность губ, ушных раковин, ногтей. При отравлениях средней тяжести присоединяется тошнота, иногда рвота, появляется шатающаяся походка; пульс учащён. Тяжёлые случаи отравления встречаются крайне редко. При хронических отравлениях — токсический гепатит, нервно-психические нарушения, расстройство сна, снижение памяти и т. д. Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов. С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком. С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол. I. Основные свойстваУменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот. Анилин более слабое основание, чем предельные амины и аммиак. Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида, а его водный раствор не окрашивает лакмус в синий цвет. Анилин с водой не реагирует и не изменяет окраску индикатора!!! Видеоопыт «Изучение среды раствора анилина» Соли анилина, в отличие от анилина, хорошо растворимы в воде. II. Особые свойства анилинаРеакции с участием аминогруппы 1. Взаимодействие с кислотами (образование солей) Анилин реагирует с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но не растворимы в неполярных органических растворителях: Видеоопыт «Взаимодействие анилина с соляной кислотой» Анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси. Солянокислый анилин хорошо растворим в воде. Если к такому раствору добавить достаточное количество щелочи, то анилин снова выделится в свободном виде: Реакции с участием бензольного ядра Аминогруппа как заместитель I рода облегчает реакции замещения в бензольном ядре, при этом заместители становятся в орто- и пара-положения к аминогруппе. При бромировании анилин легко образует 2, 4, 6 — тризамещенные продукты реакции. По той же причине анилин легко окисляется. 1. Галогенирование Анилин энергично реагирует с бромной водой с образованием белого осадка 2,4,6-триброманилина. Эта реакция может использоваться для качественного и количественного определения анилина: Качественная реакция на анилин! Видеоопыт «Бромирование анилина» Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов). III. Окисление анилинаАнилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении. При действии хлорной извести Ca (Cl) OCl на водный раствор анилина появляется интенсивное фиолетовое окрашивание. Качественная реакция на анилин! Видеоопыт «Окисление анилина раствором хлорной извести – качественная реакция» При взаимодействии анилина с хромовой известью (смесь концентрированной серной кислоты и дихромата калия К2Cr2O7) образуется черный осадок, называемый черным анилином (краситель «анилиновый черный»). Черный анилин применяется как прочный краситель (для окраски тканей и меха в черный цвет). Обычно ткань сначала пропитывают раствором окислителя. Образующийся черный анилин откладывается в порах волокна. Он не растворим в воде и устойчив к мылу и свету. Видеоопыт «Окисление анилина раствором дихроматом калия – получение красителей» IV. Диазотирование анилинаПрактическое значение имеет реакция взаимодействия анилина с азотистой кислотой при пониженной температуре (около 0°С). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений. При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол: Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины. Анилин широко применяется в производстве синтетических красителей. Он также входит в состав типографских красок и красителей для тканей. Используется в производстве лекарственных средств (сульфаниламидные препараты), смол, лаков, духов, кремов для обуви, фотографических химикалий, взрывчатых веществ, гербицидов и фунгицидов. Анилин находит применение в качестве вулканизатора каучука, антиоксиданта и антиозонового средства. |