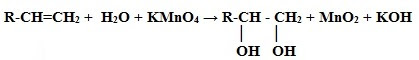09.03.21 г. 305,308,106
ГРУППА 305
Гидролиз солей. Обобщение по темам «Классификация химических реакций» и «Электролитическая диссоциация»
Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита. Если рассматривать соль как продукт нейтрализации основания кислотой, то можно разделить соли на четыре группы, для каждой из которых гидролиз будет протекать по-своему. 1). Гидролиз не возможен Соль, образованная сильным основанием и сильной кислотой (KBr, NaCl, NaNO3), гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется. рН таких растворов = 7. Реакция среды остается нейтральной. 2). Гидролиз по катиону (в реакцию с водой вступает только катион) В соли, образованной слабым основанием и сильной кислотой (FeCl2, NH4Cl, Al2(SO4)3, MgSO4) гидролизу подвергается катион: FeCl2 + HOH <=>Fe(OH)Cl + HCl В результате гидролиза образуется слабый электролит, ион H+ и другие ионы. рН раствора < 7 (раствор приобретает кислую реакцию). 3). Гидролиз по аниону (в реакцию с водой вступает только анион) Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3, CH3COONa) подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид-ион ОН- и другие ионы. K2SiO3 + НОH <=>KHSiO3 + KОН рН таких растворов > 7 (раствор приобретает щелочную реакцию). 4). Совместный гидролиз (в реакцию с водой вступает и катион и анион) Соль, образованная слабым основанием и слабой кислотой (СН3СООNН4, (NН4)2СО3, Al2S3), гидролизуется и по катиону, и по аниону. В результате образуются малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания. Мерой силы кислоты и основания является константа диссоциации соответствующего реактива. Реакция среды этих растворов может быть нейтральной, слабокислой или слабощелочной: Al2S3 + 6H2O =>2Al(OH)3↓+ 3H2S↑ Гидролиз - процесс обратимый. Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота Алгоритм составления уравнений гидролиза солей
Практическое применение. На практике с гидролизом учителю приходится сталкиваться, например при приготовлении растворов гидролизующихся солей (ацетат свинца, например). Обычная “методика”: в колбу наливается вода, засыпается соль, взбалтывается. Остается белый осадок. Добавляем еще воды, взбалтываем, осадок не исчезает. Добавляем из чайника горячей воды – осадка кажется еще больше… А причина в том, что одновременно с растворением идет гидролиз соли, и белый осадок, который мы видим это уже продукты гидролиза – малорастворимые основные соли. Все наши дальнейшие действия, разбавление, нагревание, только усиливают степень гидролиза. Как же подавить гидролиз? Не нагревать, не готовить слишком разбавленных растворов, и поскольку главным образом мешает гидролиз по катиону – добавить кислоты. Лучше соответствующей, то есть уксусной. В других случаях степень гидролиза желательно увеличить, и чтобы сделать щелочной моющий раствор бельевой соды более активным, мы его нагреваем – степень гидролиза карбоната натрия при этом возрастает. Важную роль играет гидролиз в процессе обезжелезивания воды методом аэрации. При насыщении воды кислородом, содержащийся в ней гидрокарбонат железа(II) окисляется до соли железа(III), значительно сильнее подвергающегося гидролизу. В результате происходит полный гидролиз и железо отделяется в виде осадка гидроксида железа(III). На этом же основано применение солей алюминия в качестве коагулянтов в процессах очистки воды. Добавляемые в воду соли алюминия в присутствии гидрокарбонат-ионов полностью гидролизуются и объемистый гидроксид алюминия коагулирует, увлекая с собой в осадок различные примеси. Видео - Эксперимент "Гидролиз солей" Видео - Эксперимент "Гидролиз солей, образованных сильным основанием и слабой кислотой" Видео - Эксперимент "Гидролиз солей, образованных слабым основанием и сильной кислотой" Видео - Эксперимент "Гидролиз солей, образованных слабым основанием и слабой кислотой" Видео - Эксперимент "Усиление гидролиза солей при нагревании" ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ №1. Запишите уравнения гидролиза солей и определите среду водных растворов (рН) и тип гидролиза: №2. Составьте уравнения гидролиза солей, определите тип гидролиза и среду раствора: №3. Составьте уравнения гидролиза, определите тип гидролиза и среду водного раствора соли для следующих веществ: ГРУППА 106 ТЕМА:Первые представители рода Номо |
Первый несомненный представитель рода Homo был найден в 60-х гг. ХХ в. в ущелье Олдувай (Танзания) экспедицией под руководством Луиса Лики и получил название Homo habilis - человек умелый. Известно о нем немного, поскольку вид был малочисленный (предполагается, что в период расцвета насчитывалось около 125 тыс. особей) и ископаемых находок его мало. Жил человек умелый в период 1,6-2,4 млн лет назад. Объем его мозга достигал 500-650 см3, т. е. примерно на треть больше, чем у современных ему австралопитеков. Строение зубной системы говорит о всеядности человека умелого и использовании им мясной пищи. Именно человек умелый первым стал изготавливать каменные орудия труда. Вместе с его останками обнаружили грубые орудия из гальки, отколотой с одного края, и кости животных, расколотые этими орудиями для добывания мозга. Следующий представитель рода Homo - Homo erectus (человек прямоходящий, архантроп) появился около 1,8 млн лет назад. Объем головного мозга человека прямоходящего составлял 900-1000 см3, что в два раза превосходит объем мозга человека умелого и достигает нижней границы, известной для нормально развитого мозга современного человека. По сравнению с человеком умелым у человека прямоходящего произошли существенные изменения жевательного аппарата, в том числе уменьшились размеры зубов. Это указывает на питание более мягкой пищей, возможно, термически обработанной. Неизвестно, мог ли человек прямоходящий разводить огонь, но поддерживать его мог определенно. Свидетельство тому - толстый слой золы в пещерах, где обнаружены останки некоторых представителей этого вида. Рост человека прямоходящего достигал 1,6 м, вес - 65 кг. Для него уже характерны значительно более совершенные орудия труда - различные каменные рубила. Ими пользовались при разделке добычи, которой могли быть трупы или добытые мелкие животные, для выкапывания съедобных кореньев и т. п. По-видимому, человек прямоходящий уже владел речью, хотя и достаточно примитивной. Поздние находки этого вида датируются 400 тыс. лет, хотя на Яве он вымер около 50 тыс. лет назад.
ИНТЕРЕСНОЕ! (ПЕРЕЙТИ НА ДРУГОЙ САЙТ) ГРУППА 308 ТЕМА: Многоатомные спирты. Этиленгликоль, глицерин. Свойства, применение.
Гликоли (диолы)
Триолы
Номенклатура В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол (три ОН-группы) и т.д. Например: Получение многоатомных спиртов I. Получение двухатомных спиртов В промышленности 1. Каталитическая гидратация оксида этилена (получение этиленгликоля): 2. Взаимодействие дигалогенпроизводных алканов с водными растворами щелочей: 3. Из синтез-газа: 2CO + 3H2 250°,200МПа,kat → CH2(OH)-CH2(OH) В лаборатории 1. Окисление алкенов: II. Получение трёхатомных спиртов (глицерина) В промышленности Омыление жиров (триглицеридов): Химические свойства многоатомных спиртов Кислотные свойства 1. С активными металлами: HO-CH2-CH2-OH + 2Na → H2↑+ NaO-CH2-CH2-ONa (гликолят натрия) 2. С гидроксидом меди(II) – качественная реакция! Основные свойства 1. С галогенводородными кислотами - нуклеофильное замещение HO-CH2-CH2-OH + 2HCl H+↔ Cl-CH2-CH2-Cl + 2H2O Обратите внимание! Однако, реакция замещения одного гидроксила протекает гораздо легче, образуется 2-хлорэтанол (этиленхлоргидрин): 2 - хлорэтанол используется в органическом синтезе:
 2. С азотной кислотой Тринитроглицерин - основа динамита 3. С карбоновыми кислотами Сложный эфир - триацетилглицерина Применение
Видео-опыты: Изучение физических свойст глицерина Взаимодействие глицерина с металлическим натрием Взаимодействие многоатомных спиртов с гидроксидом меди (II) Взаимодействие глицерина с перманганатом калия |