Решение задач, ТЕСТЫ
1. Определите количество вещества атомарного бора, содержащегося в тетраборате натрия Na2B4O7 массой 40,4 г.
Дано: m(Na2B4O7)=40,4 г.
Найти: ν(B)=?
Решение. Молярная масса тетрабората натрия составляет 202 г/моль. Определяем количество вещества Na2B4O7:
ν(Na2B4O7)= m(Na2B4O7)/ М( Na2B4O7) = 40,4/202=0,2 моль.
Вспомним, что 1 моль молекулы тетрабората натрия содержит 2 моль атомов натрия, 4 моль атомов бора и 7 моль атомов кислорода (см. формулу тетрабората натрия). Тогда количество вещества атомного бора равно: ν(B)= 4 • ν (Na2B4O7)=4 • 0,2 = 0,8 моль.
……………………………………………. ………………………………… ……
2.Определите массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2 • 2H2O.
Решение: Молярная масса BaCl2 • 2H2O составляет:
М(BaCl2 • 2H2O) = 137+ 2 • 35,5 + 2 • 18 =244 г/моль
Из формулы BaCl2 • 2H2O следует, что 1 моль дигидрата хлорида бария содержит 2 моль Н2О. Отсюда можно определить массу воды, содержащейся в BaCl2 • 2H2O:
m(H2O) = 2 • 18 = 36 г.
Находим массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2 • 2H2O.
ω(H2O) = m(H2O)/ m(BaCl2 • 2H2O) = 36/244 = 0,1475 = 14,75%.
3.Из образца горной породы массой 25 г, содержащей минерал аргентит Ag2S, выделено серебро массой 5,4 г. Определите массовую долю аргентита в образце.
Дано: m(Ag )=5,4 г; m = 25 г.
Найти: ω(Ag2S) =?
Решение: определяем количество вещества серебра, находящегося в аргентите: ν(Ag ) =m(Ag )/M(Ag ) = 5,4/108 = 0,05 моль.
Из формулы Ag2S следует, что количество вещества аргентита в два раза меньше количества вещества серебра. Определяем количество вещества аргентита:
ν( Ag2S)= 0,5 • ν (Ag) = 0,5 • 0,05 = 0,025 моль
Рассчитываем массу аргентита:
m(Ag2S) = ν( Ag2S) • М(Ag2S) = 0,025• 248 = 6,2 г.
Теперь определяем массовую долю аргентита в образце горной породы, массой 25 г.
ω(Ag2S) = m(Ag2S)/ m = 6,2/25 = 0,248 = 24,8%.
…………………………………………………………………………………………………………
4.Определите простейшую формулу соединения калия с марганцем и кислородом, если массовые доли элементов в этом веществе составляют соответственно 24,7, 34,8 и 40,5%.
Дано: ω(K) =24,7%; ω(Mn) =34,8%; ω(O) =40,5%.
Найти: формулу соединения.
Решение: для расчетов выбираем массу соединения, равную 100 г, т.е. m=100 г. Массы калия, марганца и кислорода составят:
m (К) = m ω(К); m (К) = 100 • 0,247= 24,7 г;
m (Mn) = m ω(Mn); m (Mn) =100 • 0,348=34,8 г;
m (O) = m ω(O); m (O) = 100 • 0,405 = 40,5 г.
Определяем количества веществ атомных калия, марганца и кислорода:
ν(К)= m(К)/ М( К) = 24,7/39= 0,63 моль
ν(Mn)= m(Mn)/ М( Mn) = 34,8/ 55 = 0,63 моль
ν(O)= m(O)/ М(O) = 40,5/16 = 2,5 моль
Находим отношение количеств веществ:
ν(К) : ν(Mn) : ν(O) = 0,63 : 0,63 : 2,5.
Разделив правую часть равенства на меньшее число (0,63) получим:
ν(К) : ν(Mn) : ν(O) = 1 : 1 : 4.
Следовательно, простейшая формула соединения KMnO4.
Задача.5 Определите объем, который займет при нормальных условиях газовая смесь, содержащая водород, массой 1,4 г и азот, массой 5,6 г.
Дано: m(N2)=5,6 г; m(H2)=1,4 ; н.у.
Найти: V(смеси)=?
Решение: находим количества вещества водорода и азота:
ν(N2) = m(N2)/ М(N2) = 5,6/28 = 0,2 моль
ν(H2) = m(H2)/ М(H2) = 1,4/ 2 = 0,7 моль
Так как при нормальных условиях эти газы не взаимодействуют между собой, то объем газовой смеси будет равен сумме объемов газов, т.е.
V(смеси)=V(N2) + V(H2)=Vm•ν(N2) + Vm•ν(H2) = 22,4•0,2 + 22,4•0,7 = 20,16 л.
………………………………………………………………………………………………………………………..
6.Какую массу фосфора надо сжечь для получения оксида фосфора (V) массой 7,1 г?
Дано: m(P2O5)=7,1 г.
Найти: m(Р) =?
Решение: записываем уравнение реакции горения фосфора и расставляем стехиометрические коэффициенты.
4P+ 5O2 = 2P2O5
Определяем количество вещества P2O5, получившегося в реакции.
ν(P2O5) = m(P2O5)/ М(P2O5) = 7,1/142 = 0,05 моль.
Из уравнения реакции следует, что ν(P2O5)= 2•ν(P), следовательно, количество вещества фосфора, необходимого в реакции равно:
ν(P2O5)= 2•ν(P) = 2• 0,05= 0,1 моль.
Отсюда находим массу фосфора:
m(Р) = ν(Р) • М(Р) = 0,1• 31 = 3,1 г.
……………………………………………………………………………………………
7.В избытке соляной кислоты растворили магний массой 6 г и цинк массой 6,5 г. Какой объем водорода, измеренный при нормальных условиях, выделится при этом?
Дано: m(Mg)=6 г; m(Zn)=6,5 г; н.у.
Найти: V(H2) =?
Решение: записываем уравнения реакции взаимодействия магния и цинка с соляной кислотой и расставляем стехиометрические коэффициенты.
Zn + 2 HCl = ZnCl2 + H2↑
Mg + 2 HCl = MgCl2 + H2↑
Определяем количества веществ магния и цинка, вступивших в реакцию с соляной кислотой.
ν(Mg) = m(Mg)/ М(Mg ) = 6/24 = 0,25 моль
ν(Zn) = m(Zn)/ М(Zn) = 6,5/65 = 0,1 моль.
Из уравнений реакции следует, что количество вещества металла и водорода равны, т.е. ν(Mg) = ν(Н2); ν(Zn) = ν(Н2), определяем количество водорода, получившегося в результате двух реакций:
ν(Н2) = ν(Mg) + ν(Zn) = 0,25 + 0,1= 0,35 моль.
Рассчитываем объем водорода, выделившегося в результате реакции:
V(H2) = Vm • ν(H2) = 22,4 • 0,35 = 7,84 л.
……………………………………………………………………………………………
8.При пропускании сероводорода объемом 2,8 л (нормальные условия) через избыток раствора сульфата меди (II) образовался осадок массой 11,4г.
Определите выход продукта реакции.
Дано: V(H2S)=2,8 л; m(осадка)= 11,4 г; н.у.
Найти: η =?
Решение: записываем уравнение реакции взаимодействия сероводорода и сульфата меди (II).
H2S + CuSO4 = CuS ↓+ H2SO4
Определяем количество вещества сероводорода, участвующего в реакции.
ν(H2S) = V(H2S) / Vm = 2,8/22,4 = 0,125 моль.
Из уравнения реакции следует, что ν(H2S) = ν(СuS) = 0,125 моль. Значит можно найти теоретическую массу СuS.
m(СuS) = ν(СuS) • М(СuS) = 0,125 • 96 = 12 г.
Теперь определяем выход продукта, пользуясь формулой (4):
η = [mp(X) •100]/m(X)= 11,4 • 100/ 12 = 95%.
……………………………………………………………………………………………
9. Какая масса хлорида аммония образуется при взаимодействии хлороводорода массой 7,3 г с аммиаком массой 5,1 г? Какой газ останется в избытке? Определите массу избытка.
Дано: m(HCl)=7,3 г; m(NH3)=5,1 г.
Найти: m(NH4Cl) =? m(избытка) =?
Решение: записываем уравнение реакции.
HCl + NH3 = NH4Cl
Эта задача на «избыток» и «недостаток». Рассчитываем количества вещества хлороводорода и аммиака и определяем, какой газ находится в избытке.
ν(HCl) = m(HCl)/ М(HCl) = 7,3/36,5 = 0,2 моль;
ν(NH3) = m(NH3)/ М(NH3) = 5,1/ 17 = 0,3 моль.
Аммиак находится в избытке, поэтому расчет ведем по недостатку, т.е. по хлороводороду. Из уравнения реакции следует, что ν(HCl) = ν(NH4Cl) = 0,2 моль. Определяем массу хлорида аммония.
m(NH4Cl) = ν(NH4Cl) • М(NH4Cl) = 0,2• 53,5 = 10,7 г.
Мы определили, что аммиак находится в избытке (по количеству вещества избыток составляет 0,1 моль). Рассчитаем массу избытка аммиака.
m(NH3) = ν(NH3) • М(NH3) = 0,1• 17 = 1,7 г.
……………………………………………………………………………………………
10. Технический карбид кальция массой 20 г обработали избытком воды, получив ацетилен, при пропускании которого через избыток бромной воды образовался 1,1,2,2 –тетрабромэтан массой 86,5 г. Определите массовую долю СаС2 в техническом карбиде.
Дано: m = 20 г; m(C2H2Br4)=86,5 г.
Найти: ω(СаC2) =?
Решение: записываем уравнения взаимодействия карбида кальция с водой и ацетилена с бромной водой и расставляем стехиометрические коэффициенты.
CaC2 +2 H2O = Ca(OH)2 + C2H2
C2H2 +2 Br2 = C2H2Br4
Находим количество вещества тетрабромэтана.
ν(C2H2Br4) = m(C2H2Br4)/ М(C2H2Br4) = 86,5/ 346 = 0,25 моль.
Из уравнений реакций следует, что ν(C2H2Br4) =ν(C2H2) = ν(СаC2) =0,25 моль. Отсюда мы можем найти массу чистого карбида кальция (без примесей).
m(СаC2) = ν(СаC2) • М(СаC2) = 0,25• 64 = 16 г.
Определяем массовую долю СаC2 в техническом карбиде.
ω(СаC2) =m(СаC2)/m = 16/20 = 0,8 = 80%.
Растворы. Массовая доля компонента раствора
…………………………………………………………………………………………………………
11.В бензоле объемом 170 мл растворили серу массой 1,8 г. Плотность бензола равна 0,88 г/мл. Определите массовую долю серы в растворе.
Дано: V(C6H6) =170 мл; m(S) = 1,8 г; ρ(С6C6)=0,88 г/мл.
Найти: ω(S) =?
Решение: для нахождения массовой доли серы в растворе необходимо рассчитать массу раствора. Определяем массу бензола.
m(С6C6) = ρ(С6C6) •V(C6H6) = 0,88•170 = 149,6 г.
Находим общую массу раствора.
m(р-ра) = m(С6C6) + m(S) =149,6 + 1,8 = 151,4 г.
Рассчитаем массовую долю серы.
ω(S) =m(S)/m=1,8 /151,4 = 0,0119 = 1,19 %.
……………………………………………………………………………………………
12.В воде массой 40 г растворили железный купорос FeSO4•7H2O массой 3,5 г. Определите массовую долю сульфата железа (II) в полученном растворе.
Дано: m(H2O)=40 г; m(FeSO4•7H2O)=3,5 г.
Найти: ω(FeSO4) =?
Решение: найдем массу FeSO4 содержащегося в FeSO4•7H2O. Для этого рассчитаем количество вещества FeSO4•7H2O.
ν(FeSO4•7H2O)=m(FeSO4•7H2O)/М(FeSO4•7H2O)=3,5/278=0,0125моль
Из формулы железного купороса следует, что ν(FeSO4)= ν(FeSO4•7H2O)=0,0125 моль. Рассчитаем массу FeSO4:
m(FeSO4) = ν(FeSO4) • М(FeSO4) = 0,0125•152 = 1,91 г.
Учитывая, что масса раствора складывается из массы железного купороса (3,5 г) и массы воды (40 г), рассчитаем массовую долю сульфата железа в растворе.
ω(FeSO4) =m(FeSO4)/m=1,91 /43,5 = 0,044 =4,4 %.
…………………………………………………………………………………………………………………………………
13.Определите массу йодида натрия NaI количеством вещества 0,6 моль.
Дано: ν(NaI)= 0,6 моль.
Найти: m(NaI) =?
Решение. Молярная масса иодида натрия составляет:
M(NaI) = M(Na) + M(I) = 23 + 127 = 150 г/моль
Определяем массу NaI:
m(NaI) = ν(NaI)•M(NaI) = 0,6 • 150 = 90 г.
…………………………………………………
Зайдите СЮДА!!!!!!!
ДОПОЛНИТЕЛЬНЫЕ ЗАДАЧИ
Химические свойства НЕМЕТАЛЛОВ
В реакциях с металлами и водородом неметаллы являются окислителями.
- Например, порошок серы при нагревании реагирует с железными опилками с образованием сульфида железа:
Fe0 + S0 = Fe+2S−2 - При высокой температуре сера реагирует с водородом (например, если пропускать водород через расплавленную серу). Образуется газ с запахом тухлых яиц — сероводород:
H20 + S0 = H2+1S−2
В реакциях с кислородом неметаллы являются восстановителями:
- S0 + O20 = S+4O2−2 (при горении серы образуется оксид серы (IV), или серни́стый газ)
C0 + O20 = C+4O2−2 (графит сгорает с образованием оксида углерода (IV), или углекислого газа)
Галогены не соединяются с кислородом напрямую, но можно получить их оксиды, в которых они проявляют положительную степень окисления, например, оксид хлора (VII) Cl2O7.
Фторид кислорода O+2F2−1 — соединение, в котором кислород проявляет положительную степень окисления
Задача. Вычисление объема полученного газа, если известна масса исходного вещества.
Объем газов рассчитывается по формуле:
v = 22,4 л/моль • n,
где 22,4 — молярный объем, т. е. объем одного моля любого газа,
n — количество вещества (моль)
Пример:
Сколько литров водорода выделится при разложении электрическим током воды массой 72 г?
Решение:
- M (H2O) = 1 • 2 + 16 = 18 г/моль
- Находим количество вещества воды по условию задачи:
n = m / M = 72 г : 18 г/моль = 4 моль - Записываем над уравнением реакции имеющиеся данные, а под уравнением — число моль согласно уравнению (равно коэффициенту перед веществом):
4 моль x моль
2H2O = 2H2↑ + O2↑
2 моль 2 моль - Составляем пропорцию:
4 моль — x моль
2 моль — 2 моль
(или с пояснением:
из 4 моль воды получится x моль водорода,
а из 2 моль — 2 моль) - Находим x:
x = 4 моль • 2 моль / 2 моль = 4 моль - Находим объем водорода:
v = 22,4 л/моль • 4 моль = 89,6 л
Ответ: 89,6 л.
Вариант 1.
При выполнении заданий А1-А9 выберите один правильный ответ.
А1. Каков физический смысл порядкового номера химического элемента?
А. это число нейтронов в атоме
Б. это относительная атомная масса
В. это число энергетических уровней в атоме
Г. это число протонов в ядре
А2. В малом периоде находится:
А. кальций Б. золото В. Хлор Г. железо
А3. В ряду Na →K → Rb металлические свойства: А. уменьшаются
Б. увеличиваются В. не изменяются Г. сначала увеличиваются, а затем уменьшаются
А4. Заряд ядра и нуклонное число атома Mg равны соответственно:
А. +12 и 24 Б. +3 и 24 В. +24 и 12 Г. +12 и 20
А5. Атом фосфора имеет следующее распределение электронов по энергетическим
уровням: А. 1е,8е,5е Б. 2е,6е,5е В. 2е,8е,3е Г. 2е,8е,5е
А6. Сферическую форму имеют орбитали:
А. s- элекронов Б. d- элекронов В. p- элекронов Г. f- элекронов
А7. Химический элемент, который имеет 14 электронов это:
А. Азот Б. Кремний В. Алюминий В. Кислород
А8. В подгруппе АII находится химический элемент: А. Li Б. Be В. Zn
А9. Заряд ядра атома рассчитал: А. Н. Бор Б. Э. Резерфорд В. Г. Мозли
При выполнении заданий А10-А12 выберите несколько правильных ответов.
А10. Установите соответствие
электронная формула частицы химический элемент
А. 1s2 1. Углерод
Б. 1s2 2s22p6 2. Азот
В. 1s2 2s22p3 3. Гелий
Г. 1s2 2s2 4. Неон
А11. Установите соответствие
Неорганическое вещество Химическое соединение
А. Соль 1. N2O5
Б. Кислотный оксид 2. CaCl2
В. Основный оксид 3. ZnО
Г. Амфотерный оксид 4. ВаO
А12. Установите соответствие
Химический элемент Количество энергетических уравней
А. Фтор 1. Один
Б. Сера 2. Два
В. Водород 3. Три
Г. Калий 4. Четыре
При выполнении заданий В1 и В2 подробно запишите ход его решений и полученный
результат
Часть 2
В1. Дать характеристику химическому элементу №6 по плану.
В2. Дать определение терминам: химический элемент, период, изотопы, дать формулировку периодического закона (Менделеевская).
Контрольная работа №4
По теме «Периодический закон и периодическая система химических элементов Д.И. Менделеева. Строение атома»
Вариант №2
При выполнении заданий А1-А9 выберите один правильный ответ.
А1. Каков физический смысл порядкового номера химического элемента?
А. это число энергетических уровней Б. это заряд атома
В. это относительная атомная масса Г. это число нейтронов в ядре
А2. В большом периоде находится: А. кальций Б. натрий В. Хлор Г. азот
А3. В ряду С → N→ O металлические свойства: А. уменьшаются Б. увеличиваются В. не изменяются Г. сначала увеличиваются, а затем уменьшаются
А4. Заряд ядра и массовое число атома Br равны соответственно:
А. +12 и 80 Б. +35 и 80 В. +35 и 12 Г . +12 и 35
А5. Атом алюминия имеет следующее распределение электронов по энергетическим
уровням:
А. 1е,8е,5е Б. 2е,6е,5е В. 2е,8е,3е Г. 2е,8е,5е
А6. Гантелеобразную форму имеют орбитали:
А. s- элекронов Б. d- элекронов В. p- элекронов Г. f- элекронов
А7. Химический элемент, который имеет 12 электронов это:
А. Углерод Б. Магний В. Алюминий В. Кремний
А8. В подгруппе IIБ находится химический элемент: А. Li Б. Be В. Zn
А9. Ядерную модель атома предложил: А. Н. Бор Б. Э. Резерфорд В. Г. Мозли
При выполнении заданий А10-А12 выберите несколько правильных ответов.
А10. Установите соответствие
электронная формула частицы химический элемент
А. 1s22s22p1 1. Фтор
Б. 1s2 2s22p63s23p6 2. Бор
В. 1s2 2s22p5 3. Аргон
Г. 1s2 2s22p2 4. Углерод
А11. Установите соответствие
Неорганическое вещество Химическое соединение
А. Соль 1. SO3
Б. Кислотный оксид 2. ВаCl2
В. Основный оксид 3. AI2О3
Г. Амфотерный оксид 4. CаO
А12. Установите соответствие
Химический элемент Количество энергетических уровней
А. Азот 1. Один
Б. Фосфор 2. Два
В. Гелий 3. Три
Г. Кальций 4. Четыре
При выполнении заданий В1 и В2 подробно запишите ход его решений и полученный
результат
Часть 2
В1. Дать характеристику химическому элементу №11 по плану.
В2. Дать определение терминам: атом, группа, изотопы, дать формулировку периодического закона (современная).
Правильные ответы.
А1-9
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
В - 1 | Г | В | Б | А | Г | А | Б | Б | А |
В - 2 | Б | А | А | Б | В | В | Б | В | Б |
В№1
А10. А11. А12
А – 4 А – 2 А - 2
Б – 3 Б – 1 Б - 3
В – 2 В – 4 В - 1
Г – 1 Г- 3 Г - 4
В2
Химический элемент – это определенный вид атома с одинаковым зарядом ядра.
Период – это горизонтальный ряд, который начинается металлом и заканчивается неметаллом.
Изотопы – разновидности атомов одного и того же химического элемента, имеющие одинаковое число протонов, но разное число нейтронов в ядре.
П. з. Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины атомных масс.
(Менделеевская).
В№2
А10. А11. А12
А – 2 А – 2 А - 2
Б – 3 Б – 1 Б - 3
В – 1 В – 4 В - 1
Г – 4 Г- 3 Г – 4
В2
Атом - мельчайшие химически неделимые электронейтральная частичка, которая состоит из ядра и вращающихся вокруг него электронов.
Группа – вертикальный столбец подобных элементов
Изотопы - разновидности атомов одного и того же химического элемента, имеющие одинаковое число протонов, но разное число нейтронов в ядре.
П. з. (современная). Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра атома этих элементов.
В1. Характеристика элемента
по положению в Периодической системе
1. Положение в Периодической системе: период; группа; подгруппа; № элемента; атомная масса.
2. Состав атома: число протонов, электронов и нейтронов;
3. Строение атома:
электронная конфигурация; схема распределения электронов поуровням.
4. Свойства атома: оценить радиус (большой — маленький);
способность отдать (или принять электроны); высшая и низшая валентности.
5. Характер простого вещества (металл — неметалл).
6. Формулы высшего оксида и гидроксида, их характер.
Уравнения реакций, подтверждающие характер оксидов и гидроксидов.
Критерии оценивания.
Максимальное количество баллов– 25
Задание А1-9 оценивается в 9 баллов (1 балл за каждое правильно выполненное задание);
Задание А10-12 оценивается в 6 баллов – 2 балла за каждое выполненное задание. (за все правильно определенные соответствия - 2 балла, за три правильных соответствия – 1 балл);
Задание В1оцениваетмя в 6 баллов. (1 балл за каждый правильный признак)
Задание В2 оценивается в 4 балла (по 1 баллу за каждый верный термин).
Шкала оценок:
Итого 25
- отметка «5» выставляется обучающемуся, если 23-25 баллов;
- отметка «4» выставляется обучающемуся, если 18-22 баллов;
- отметка «3» выставляется обучающемуся, если 13-17 баллов;
- отметка «2» выставляется обучающемуся, если менее 13 баллов.
Опубликовано
ГРУППА 408 ХИМИЯ 14
тема: Решение задач на нахождение молекулярной формулы газообразного углеводорода по массе (объему) продуктов сгорания.
Задача. Вывести молекулярную формулу углеводорода по данным: массовая доля углерода — 83,33%, массовая доля водорода — 16,67%, относительная плотность по воздуху равна 1,45.
ЗАДАЧА. Сколько граммов нитробензола можно получить из 312 г бензола, если массовая доля выхода составляет 0,75, или 75%, по сравнению с теоретическим?
Решение:
Уравнение реакции:
Молекулярная формула бензола C6H6. Вычислим молярную массу бензола:
Вычислим количество вещества бензола:
По уравнению реакции из 1 моль бензола образуется 1 моль нитробензола, значит из 4 моль бензола при теоретическом 100%-ном выходе получилось бы 4 моль нитробензола. Но выход равен 75%, или 0,75, от теоретического, поэтому практически получится 0,75 · 4 моль = 3 моль нитробензола. Молекулярная формула нитробензола С6Н5NO2. Вычислим молярную массу нитробензола:
Вычислим массу нитробензола:
Ответ: можно получить 369 г нитробензола.
"Решение задач по химии"
Вычисления по химическим уравнениям.
Вычисление количества (массы) продуктов реакции по известному количеству (массе) одного из вступивших в реакцию веществ.
Алгоритм решения
1. Запишите условие задачи, выяснив единицы их измерения.
2. Запишите уравнение реакции.
3. Подчеркните формулы веществ, с которыми будете работать.
4. Над формулами веществ напишите данные условия задачи.
5. Под подчеркнутыми формулами подпишите:
А) количества этих веществ,
Б) М – массу или Vm (как того требует решение задачи),
В) m – массу вещества.
6. Приведите все значения величин надписанные и подписанные под формулами веществ к единой единице измерения:
Например: V=m /M, V(газа) = V(газа) / V(m)
7. Установите логическую связь:
А) между величинами веществ (по условию задачи),
Б) между величинами веществ (по уравнению реакции).
8. Составьте и решите пропорцию. Найдите значение неизвестной величины.
9. Выразите найденное значение величиной в той единице, которая требуется по условию задачи.
10. Запишите ответ.
Вычисление относительной плотности газов.
Алгоритм решения
1. Составьте краткую запись условия задачи.
2. Из понятия «относительная плотность газов» следует:
А) D(газ1)(газ2)=Mr (газа1)/ Mr (газа2);
Б) D(газ)(H2)=Mr (газа)/ Mr (H2)= Mr(газ)/ 2;
В) D(газ)(воздух)=Mr (газа)/ Mr (воздуха)= Mr(газ)/ 29
Задача 1:
Дано: СО2 | Решение: 1) D(СО2)(H2)=Mr (СО2)/ Mr (H2)= (12+16*2)/ 2=22 2) D(СО2)(воздух)=Mr (СО2)/ Mr (воздуха)= (12+16*2)/29 =1,52 |
Найти: D(СО2)(H2) -? D(СО2)(воздух) -? |
Ответ: D(СО2)(H2)=22; D(СО2)(воздух)= 1,52
Задача 2:
Дано: m(р-ра)=150г w(NaCl)=12% | Решение: 1) Найдем массу соли в растворе из формулы w(NaCl)= m (NaCl)/ m(р-ра)*100%, следовательно m (NaCl)= w(NaCl)* m(р-ра)/ 100%=12*150/100=18г 2) m (H2O)= m(р-ра)- m (NaCl)=150г-18г=132г |
Найти: m (NaCl) - ? m (H2O) - ? |
Ответ: m (NaCl) =18г, m (H2O)= 132г.
Решите самостоятельно:
1. Какова массовая доля NaOH в растворе, полученном при растворении 4г NaOH в 46г воды?
2. Путем выпаривания 20г раствора было получено 4г CuSO4.
Какова массовая доля соли раствора?
3. К 80г 15% раствора сульфата натрия прибавили 20г воды.
Какова массовая доля соли станет после разбавления водой раствора?
4. Какую массу поваренной соли и воды надо взять, чтобы получить:
А) 100г 10% раствора,
Б) 200г 15% раствора?
Вычисление по химическим формулам с использованием понятия
МОЛЬ-КОЛИЧЕСТВО вещества.
Расчетные формулы:
1) M =Vгаза/v; | Vгаза= v* M; | v = m / M; | * |
2) Vm = Vгаза/ v | Vгаза = v* Vm | ? = Vгаза/ Vm | * |
Vm = 22,4 л/моль | |||
Из формул * следует
Vгаза/22,4 л/моль = m(газа) / M (газа)
Задача 1. Вычислите, какое количество вещества соответствует 49г серной кислоты
Дано: m(H2SO4)=49г | Решение: v (H2SO4) = m (H2SO4) / M (H2SO4); M (H2SO4)=2+32+16*4=98г/моль; v (H2SO4)=49г /98г/моль = 0,5 моль |
Найти: ? (H2SO4) - ? |
Ответ: v (H2SO4)= 0,5 моль
Задача 2. Вычислите, какой объем (при н.у.) занимает углекислый газ (CO2) массой 2,2г
Дано: m(CO2)=2,2г | Решение: V (CO2)/ Vm = m(CO2) / M (CO2), следовательно V (CO2)= m(CO2)* Vm / M (CO2) = 2,2г*22,4л/моль /44г/моль = 1,12л |
Найти: V(CO2) - ? |
Ответ: V(CO2) = 1,12л
________________________________________________________________________________
Приготовление растворов с определенной массовой долей растворенного вещества
Алгоритм решения.
Вспомните о взаимодействии величин
А) m(р-ра) = m(растворителя) + m(вещества);
Б) w (вещества)%= m(вещества)/ m(раствора)*100%
Дано: m(спирта)=47,5г m(I2)=2,5г | Решение: 1) Найти m(раствора) m(р-ра) = m(спирта) + m(вещества)= 47,5+2,5=50г 2)Найти массовую долю I2 в растворе. w (I2)%= m(I2)/ m(раствора)*100% =2,5г/50г*100%=5% |
Найти: w(I2) %-? |
Ответ: w (I2)% =5%
Нахождение простейшей формулы вещества по массовым долям элементов.
Алгоритм решения.
Задача: выведите химическую формулу оксида азота, элементарный состав которого:
N-36,87%, O-63,16%.
1. Составляем краткую запись условия задачи.
2. Записываем отношения масс элементов, зная, что отношение масс элементов равно отношению их массовых долей:
m1(эл-та) : m2(эл-та) = w1(эл-та) : w2(эл-та) …
3. Вычислить количество элементов по формуле:
v(эл-та) = m(эл-та) / M(эл-та)
4. А) Запишите отношение количества элементов;
Б) Выразите это отношение целым числом.
5. составьте химическую формулу (индексами в ней будут найденные целые числа).
Пример:
Дано: w (N)= 36,87%, w (O)= 63,16%. | Решение: 1) m(N) : m(O) = w(N) : w(O) 2) V(N) = m / M =36,87/ 14 = 2,63 моль 3) V(O) = m / M =63,16/ 16 = 3,94 моль 4) V(N) : V(O) = 2,63 / 3,94=1:1,5=2:3 5) N2O3 - формула оксида x=2; y=3 |
Найти: NxOy -? |
Ответ: формула - N2O3
Вычисление отношения масс элементов и массовых долей элементов
в сложном веществе.
Алгоритм решения.
1. Дана химическая формула вещества
Найти: массовые доли химических элементов.
2. Записываем количество каждого элемента в веществе, исходя из его химической формулы (индексы в хим. формуле соответствуют количествам элементов)
3. Вычисляем массы элементов по формуле
m(эл-та) = M(эл-та) * v(эл-та)
4. Можно вычислить отношение масс элементов
5. Вычислить массу 1 моль вещества (1 моль вещества = сумме масс элементов)
6. Вычисляем массовые доли (%) элементов:
w%(эл-та) = m(эл-та) / m(вещества) *100%
Задача: найти массовые доли элементов в сульфате меди.
Дано: CuSO4 – сульфат меди | Решение: 1)M(CuSO4) = Ar(Cu) + Ar(S) + 4Ar(O) =64+32+64 = 160 г/моль 2)исходя из формулы w%(эл-та) = m(эл-та) / m(вещества) *100% находим w%(Cu) =64/160*100%=40% w%(S) = 32/160*100%=20% w%(O) = 64/160*100%=40% |
Найти: w%(Cu) -? w%(S) -? w%(O) -? |
Итого 100%
Определение количества (массы или объема) продукта реакции, если один из сореагентов взят для реакции в избытке.
Алгоритм решения.
1. Сделать краткую запись условия задачи;
2. Записать уравнение реакции;
3. Расставить данные условия задачи (вверху), подставить под формулами веществ данные уравнения;
4. Найти отношение молей исходных веществ, применив формулы:
v = m / M или v = V / V m
5. Найти, какое вещество в избытке, а какое – в недостатке (по нему вести расчет).
6. Вычислить число молей продукта реакции, его массу.
Задача: Рассчитайте массу гидроксида меди, образовавшегося при сливании двух растворов, содержащих соответственно 24 г. сульфата меди и 16 г. гидроксида натрия.
Дано: m(CuSO4)=24г m(NaOH)=16г | Решение:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
Найти: m(Cu(OH)2)-? | |||||||||||||||||||||||||||||||||||||||||||||||||||||
Вычисление объема газа, вступившего в реакцию (или получившегося), по объему другого газа.
Алгоритм решения.
1. По закону Авогадро: отношение количеств газов равно отношению их объемов:
v(газ1) / v(газ2) = V(газ1) / V (газ2) ;
2. Составляем краткую запись условия задачи
3. Записываем уравнение реакции
4. Расставляем: а) над формулами веществ данные условия задачи;
б) под формулами подписать количество веществ
5. Составить пропорцию и найти из нее значение неизвестной величины.
Задача: Вычислите, какой объем азота вступит в реакцию с 6 л водорода?
Дано: V(Н2)=6л | Решение:
| |||||||||||||||||||||||||||||||||||
Найти: V(N2)-? | ||||||||||||||||||||||||||||||||||||
Ответ: V(N2)=2л
Вычисление выхода продукта реакции (%) от теоретически возможного.
Алгоритм решения.
1. Составьте краткую запись условия задачи.
2. Вычислите массу продукта реакции (m теорет) по известной массе (количеству) одного из веществ, вступивших в реакцию.
3. Вычисляем массовую долю продукта реакции:
? (%)= m(практ.) : m(теорет.) *100%
Задача. При взаимодействии в растворе сульфата натрия с 20,8г хлорида бария был получен осадок сульфата бария, масса которого после фильтрования и высушивания составила 22г. определите массовую долю (в %) выхода соли от теоретически возможного.
Дано: m(BaCl2)=20,8г mпр(BaSO4)=22г | Решение:
| ||||||||||||||||||||||||||||||||
Найти: ? (BaSO4)-? | |||||||||||||||||||||||||||||||||
Ответ ? (BaSO4)=94,4%
Вычисление массы вещества (исходного или получаемого) по уравнению реакции, если известна масса другого вещества (получаемого или исходного), содержащего определенную долю примесей.
Задача. Какая масса оксида кальция может быть получена из 500т известняка, в котором массовая доля примесей составляет 0,2 (или 20%)?
Дано: m(изв)=500 т = 500 000кг wпр = 0,2 = 20 % wчист CaCO3 =80 % | Решение:
| ||||||||||||||||||||
Найти: m(CaO)-? | |||||||||||||||||||||
Ответ: m(CaO)=224 000кг = 224т
Вычисление массы продукта реакции, если известна массовая доля выхода продукта реакции по сравнению с теоретически возможным.
Задача. На гашенную известь, взятую в необходимом количестве, подействовали 3,15 кг чистой азотной кислотой. Какую массу нитрата кальция (Ca(NO3)2) получили, если практический выход его составляет в массовых долях 0,98 (или 98%) по сравнению с теоретическим?
Дано: m(HNO3)=3,15 кг ? (Ca(NO3)2)= 98% | Решение:
| ||||||||||||||||||||||||||||||||
Найти: m(Сa(NO3)2)-?
| |||||||||||||||||||||||||||||||||
Ответ: mпракт(Сa(NO3)2)= 4,02 кг
Задача1. На нейтрализацию раствора серной кислоты потребовался раствор, содержащий 8 г гидроксида натрия. Какова масса образовавшейся соли?
Дано: m(NaOH)=8г | Решение:
| ||||||||||||||||||||||||||||||||
Найти: m(Na2SO4)-?
| |||||||||||||||||||||||||||||||||
Ответ: m (Na2SO4) =14,2 г
Вычисление массы или объема продукта реакции, по известной массе исходного вещества, содержащего определенную массовую (или объемную) доли примесей.
Химическими формулами обозначают состав чистых веществ. Сырье, поступающее на производство содержащий примеси, т.е. вещества, которые не участвуют в проводимых реакциях
Задача 1. Вычислить массу негашеной извести CaO, которую получили при обжиге 300кг известняка с массовой долей примесей в нем 8%?
Дано: m(известняка)=300кг ? (примесей)= 8% | Решение:
| ||||||||||||||||||||||||
Найти: m(СaО)-?
| |||||||||||||||||||||||||
Ответ: m (СaО)= 154,6 кг
Задача 2. При обработке избытком соляной кислотой 30 кг природного известняка получено 5,6 м3 (н.у.) углекислого газа. Вычислить массовую долю CaСО3 в известняке.
Решение:
m=x кг | t |
|
| 5,6 м3 |
|
CaСО3 | = | СaO | + | CO2 |
|
v = 1 моль m=100кг |
|
|
| v = 1 моль V=22,4м3 |
|
x=100*5,6:22,4=25 кг | |||||
? (CaСО3)= m(CaСО3) : m(известняка)*100%= 25:30*100%=83,3% CaСО3
Задача 3. Какую массу известняка с массовой долей карбоната кальция 80% надо взять, чтобы получить углекислый газ объемом 112л?
Решение:
x г | t |
|
| 112л |
CaСО3 | = | СaO | + | CO2 |
v = 1 моль М=100г |
|
|
| v = 1 моль V=22,4м3 |
x=100*112:22,4=500г CaСО3
m(известняка) = m(CaСО3) *100% : ? (CaСО3) = 500 *100 : 80 = 625 г известняка
1. Азот объемом 56 л (н.у.) прореагировал с водородом. Массовая доля выхода аммиака 50%. Рассчитайте массу полученного аммиака.
2. Установить формулу газообразного углеводорода, если при полном сжигании 0,7 г получили 1,12л углекислого газа и 0,9г воды. Относительная плотность паров этого вещества по водороду – 42.
3. К 50 мл раствора с массовой долей H2SO4 - 12% (плотность 1,08 г/мл) прибавили избыток раствора хлорида бария. Определите массу образовавшегося осадка.
4. Марганец получают восстановлением оксида марганца (III) кремнием. Технический оксид массой 20 кг с массовой долей примесей 5,2% восстановили до металла. Рассчитайте массу полученного марганца.
5. Требуется приготовить 500г раствора с массовой долей хлорида калия 14%. Рассчитайте массу требуемых хлорида калия и воды.
6. Какой объем кислорода необходим для полного окисления 5 литров ацетилена?
7. Рассчитайте массу газообразного водорода, который выделится, если растворить 4,5г алюминия в соляной кислоте.
8. Сколько граммов бензола вступило в реакцию с азотной кислотой, если при этом получилось 0,65 моль нитробензола?
9. Вычислите массы гидроксида натрия и сульфата меди (II), необходимых для получения 4,9г гидроксида меди (II)?
10. Определите массу осадка, образовавшегося при добавлении к раствору хлорида калия, содержащего 7,45 хлорида калия 10г 85% раствора нитрата серебра.
11. Выведите молекулярную формулу органического вещества, если известно, что массовая доля углерода – 80%, водорода – 20%. Относительная плотность вещества по водороду – 15.
12. При восстановлении алюминием оксида железа (III) массой 100г выделяется 476,0 кДж. Определите тепловой эффект химической реакции.
13. Сколько литров оксида азота (II) получится при реакции 25,6г меди с разбавленной азотной кислотой?


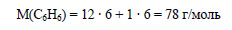

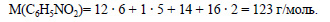

Комментариев нет:
Отправить комментарий