СПРАВА НАХОДИТСЯ АРХИВ- ТАМ СМОТРИМ ДАТУ И ГРУППЫ
РАСПИСАНИЕ ЗАНЯТИЙ НА НЕДЕЛЮ: 30.01.23г. - 03.02.23г.
Ср. 01.02: 406, 505, 401, ----
Пт. 03.02: 401, 505, ----, 501
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 401 ХИМИЯ 31,32
ТЕМА: 31,32Алкины. Ацетилен. Химические свойства ацетилена: горение, обесцвечивание бромной воды, присоединение хлороводорода и гидратация.
Применение ацетилена на основе свойств.
.
АЛКИНЫ. АЦЕТИЛЕН. ХИМИЧЕСКИЕ СВОЙСТВА АЦЕТИЛЕНА: ГОРЕНИЕ, ОБЕСЦВЕЧИВАНИЕ БРОМНОЙ ВОДЫ, ПРИСОЕДИНЕНИЕ ХЛОРОВОДОРОДА И ГИДРАТАЦИЯ. ПРИМЕНЕНИЕ АЦЕТИЛЕНА НА ОСНОВЕ СВОЙСТВ.
На этом уроке вы сможете самостоятельно изучить тему «Алкины. Строение, номенклатура, изомерия, физические свойства, получение». В ходе урока вы узнаете о том, что представляют собой алкины – ациклические углеводороды, содержащие в молекуле одну тройную связь. Познакомитесь с физическими свойствами алкинов, особенностями их строения.
НОМЕНКЛАТУРА АЛКИНОВ
Алкины (ацетиленовые углеводороды) – углеводороды, молекулы которых содержат тройную связь углерод-углерод. Общая формула алкинов – CnH2n-2.
Номенклатура алкинов
Тройную связь обозначают суффиксом -ин.
 | |
| ацетилен (этин) | бутин-1 |
Главная цепь должна включать в себя тройные связи, а нумерация проводится так, чтобы они получили наименьшие номера.

3,6-диметилгептадиин-1,4

Рис. 1. Шаростержневая модель ацетилена
СТРОЕНИЕ АЛКИНОВ
Атомы углерода тройной связи находятся в состоянии sp-гибридизации. Сигма-связи, образуемые sp-гибридными атомами углерода, расположены под углом 180о друг к другу.
Тройная связь короче и прочнее двойной связи. Она образована тремя парами электронов и включает одну σ- и две π-связи. Две π-связи лежат во взаимно перпендикулярных плоскостях. Рис. 2.

Рис. 2. Образование тройной связи в молекуле ацетилена
3. ИЗОМЕРИЯ АЛКИНОВ
1. Изомерия скелета
2. Изомерия положения тройной связи
| бутин-1 | бутин-2 |
3. Межклассовая изомерия. Алкинам изомерны, например, алкадиены и циклоалкены.
 |  | |
| бутин-1 | бутадиен-1,3 | циклобутен |
Алкины не обладают геометрической изомерией.
4. ФИЗИЧЕСКИЕ СВОЙСТВА И ПОЛУЧЕНИЕ АЛКИНОВ
Ацетилен, пропин и бутин-1 при комнатной температуре – бесцветные газы, остальные алкины – жидкости или твердые вещества.
Ацетилен немного растворим в воде, хорошо растворяется в ацетоне. Это используют для его хранения и транспортировки. Ацетилен нельзя хранить в баллонах в сжатом состоянии, т.к. под давлением он разлагается со взрывом. В баллон помещают пористый материал, пропитанный ацетоном, а в нем растворяют ацетилен.
Получение алкинов
1. В промышленности ацетилен получают термическим разложением (пиролизом) метана: 2СН4![]() С2Н2 + 3Н2.
С2Н2 + 3Н2.
2. Для получения ацетилена в лаборатории и в технических целях используют взаимодействие карбида кальция с водой:
СаC2 + Н2О ¾¾¾→ Сa(OH)2 + C2H2.
3. Другие алкины в лаборатории получают взаимодействием дигалогеналканов, содержащих атомы галогенов у одного или у соседних атомов углерода, со спиртовым раствором щелочи при нагревании:

1. Реакции гидрирования и галогенирования
Гидрирование алкинов протекает в тех же условиях, что гидрирование алкенов. В зависимости от количества водорода может образоваться алкен или алкан.
![]()
![]()
Электрофильное присоединение
Алкины менее активны в электрофильном присоединении, чем алкены. Почему? Потому что тройная связь короче и прочнее, чем двойная. Поэтому в некоторых случаях для осуществления реакции необходимы специальные условия (например, присутствие солей ртути в качестве катализатора).
Реакции присоединения к алкинам могут проходить в два этапа: на первом образуется вещество с двойной связью.
2. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА АЛКИНЫ
1. Галогенирование.
Обесцвечивание бромной воды – качественная реакция на алкины, так же как на алкены.


2. Гидрогалогенирование.
Присоединение хлороводорода к ацетилену приводит к образованию винилхлорида (хлорэтена) – мономера для синтеза распространенного материала поливинилхлорида (ПВХ):
![]()
3. РЕАКЦИЯ КУЧЕРОВА
3. Гидратация (реакция Кучерова)
Реакция проходит в кислой среде в присутствии солей ртути. Образующийся на первой стадии фенол перегруппировывается в карбонильное соединение.


4. ПОЛУЧЕНИЕ АЦЕТИЛЕНА В ЛАБОРАТОРИИ
Кислотные свойства алкинов
Алкины, у которых при тройной связи есть атом водорода, проявляют свойства очень слабых кислот. Они реагируют, например, с водно-аммиачными растворами солей Cu(I) и Ag(I). Атом водорода замещается на атом металла, выпадает осадок соли, которая называется ацетиленидом.
![]()
Ацетиленид меди – темно-красный, а ацетиленид серебра – желтый или белый. Это можно использовать при определении алкинов с концевой тройной связью.
Окисление алкинов
1. Обесцвечивание подкисленного раствора перманганата калия – качественная реакция на соединения с кратной связью. Рис. 1.
5HCºCR + 8KMnO4 + 24HCl ®5CO2 + 5RCOOH + 8MnCl2 + 8KCl + 12H2O.
2. На воздухе алкины горят коптящим пламенем:
2С2Н2 + 5О2 = 4СО2 + 2Н2О.

Рис. 1. Обесцвечивание КМnO4
Применение алкинов
Благодаря яркому пламени в XIX веке широко распространились ацетиленовые фонари.
При горении смеси ацетилена с кислородом температура пламени достигает 2800–3000оС – можно плавить многие металлы. На этом свойстве основана ацетиленовая сварка. Рис. 2, 3.

Рис. 2. Ацетиленовая горелка

Рис. 3. Сварка и резка металлов
Кроме того, ацетилен используют в промышленном органическом синтезе для получения винилхлорида, акрилонитрила, винилацетилена – исходных веществ при производстве распространенных полимеров.
Подведение итога урока
На этом уроке вы изучили тему «Алкины. Химические свойства и применение». Вы смогли узнать, что представляют собой алкины и какими химическими свойствами характеризуется этот класс соединений. Вы узнали о том, как свойства алкинов влияют на их практическое применение.
ГРУППА 505 ХИМИЯ 18,19
ТЕМА 18:Кратность ковалентной связи. Молекулярные и атомные кристаллические решетки. Свойства веществ с молекулярными и атомными кристаллическими решетками.
Химическая связь – это силы взаимодействия между атомами или группами атомов, приводящие к образованию молекул, ионов, свободных радикалов, а также ионных, атомных и металлических кристаллических решеток.
Кратность ковалентной связи. Молекулярные и атомные кристаллические решетки. Свойства веществ с молекулярными и атомными кристаллическими решетками.
ТИПЫ химической связи
Различают 4 основных типа химической связи:

Рассмотрим взаимодействие двух атомов с одинаковыми значениями электроотрицательности, например двух атомов хлора. Каждый из них имеет по семь валентных электронов. До электронной конфигурации ближайшего инертного газа им не хватает по одному электрону.

Сближение двух атомов до определенного расстояния приводит к образованию общей электронной пары, одновременно принадлежащей обоим атомам. Эта общая пара и представляет собой химическую связь. Аналогично происходит и в случае молекулы водорода. У водорода всего один неспаренный электрон, и до конфигурации ближайшего инертного газа (гелия) ему не хватает еще одного электрона. Таким образом, два атома водорода при сближении образуют одну общую электронную пару.
Связь между атомами неметаллов, возникающая при взаимодействии электронов с образованием общих электронных пар, называется ковалентной.
В случае если взаимодействующие атомы имеют равные значения электроотрицательности, общая электронная пара в равной степени принадлежит обоим атомам, то есть находится на равном расстоянии от обоих атомов. Такая ковалентная связь называется неполярной.
Ковалентная неполярная связь — химическая связь между атомами неметаллов с равными или близкими значениями электроотрицательности. При этом общая электронная пара одинаково принадлежит обоим атомам, смещения электронной плотности не наблюдается.
Ковалентная неполярная связь имеет место в простых веществах-неметаллах:
Связь, образованная элементами-неметаллами с разной электроотрицательностью, называется ковалентной полярной. При этом происходит смещение электронной плотности в сторону более электроотрицательного элемента.
Молекула, в которой разделены центры положительного и отрицательного зарядов, называется диполем. Полярная связь имеет место между атомами с различной, но не сильно различающейся электроотрицательностью, например между различными неметаллами. Примерами соединений с полярными ковалентными связями являются соединения неметаллов друг с другом, а также различные ионы, содержащие атомы неметаллов
Ковалентная связь – это связь, которая образуется между атомами с одинаковой электроотрицательностью или между атомами с небольшой разницей в значениях электроотрицательности.
Ковалентная неполярная связь образуется между атомами одинаковых элементов – неметаллов. Ковалентная неполярная связь образуется, если вещество простое, например, O2, H2, N2.
Ковалентная полярная связь образуется между атомами разных элементов – неметаллов. Ковалентная полярная связь образуется, если вещество сложное, например, SO3, H2O, НСl, NH3. Ковалентная связь классифицируется по механизмам образования: обменный механизм (за счёт общих электронных пар); донорно-акцепторный (атом - донор обладает свободной электронной парой и передаёт её в общее пользование с другим атомом - акцептором, у которого имеется свободная орбиталь). Примеры: ион аммония NH4 +, угарный газ СО.
Просмотрите и видео. Законспектируйте, ЧТО СЧИТАЕТЕ НУЖНЫМ
ТЕМА 19:Агрегатные состояния веществ и водородная связь. Твердое, жидкое и газообразное состояния веществ. Переход вещества из одного агрегатного состояния в другое. Водородная связь.
Агрегатные состояния веществ и водородная связь. Твердое, жидкое и газообразное состояния веществ. Переход вещества из одного агрегатного состояния в другое. Водородная связь.
Водородная связь. Образование водородной связи обусловлено спецификой водорода как элемента, атом которого состоит из протона и электрона. В соединениях водорода с атомами более электроотрицательных элементов на атоме водорода возникает частичный положительный заряд. Такой атом может взаимодействовать с неподеленными парами электронов атома электроотрицательного элемента соседней молекулы, в результате между молекулами возникает дополнительная межмолекулярная связь.
Водородная связь – это связь, которая образуется между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом сильно электроотрицательного элемента другой молекулы.
Чем больше электроотрицательность атома, с которым соединяется атом водорода, тем больше энергия водородной связи.
Водородная связь наиболее характерна для соединений фтора и кислорода, менее для соединений – азота. Образование водородной связи приводит к ассоциации (соединению) молекул.
Рассмотрим образование водородной связи между двумя молекулами воды. В молекуле воды связь О-Н сильно полярная. На атоме кислорода сосредоточен отрицательный заряд, а на атомах водорода – положительный. Это приводит к притяжению атома водорода одной молекулы воды к атому кислорода другой молекулы – возникает водородная связь.
В кристаллах льда, снега каждая молекула воды связана водородными связями с четырьмя соседними – за счет атомов водорода и двух неподеленных электронных пар атома кислорода. Следовательно, образование водородной связи обусловлено как электростатическим, так и донорно-акцепторным взаимодействием. В результате образуется ажурная (с большими пустотами) структура льда. Из-за этого плотность льда меньше, чем плотность воды.
Способностью к ассоциации обладают молекулы как неорганических, так и органических соединений (вода, аммиак, спирты и др.)
Водородная связь как и ковалентная, имеют направленность в пространстве и насыщаемость.
Длина водородной связи больше длины обычной ковалентной связи, энергия – в 10-20 раз меньше. В связи с этим водородные связи малоустойчивы и довольно легко разрываются (например, при таянии льда и кипении воды). Но на разрыв этих связей требуется дополнительная энергия, поэтому температуры плавления и кипения веществ, в которых молекулы ассоциированы, оказываются выше, чем у подобных веществ, но без водородных связей. Например, между молекулами фтороводорода и воды образуются водородные связи, а между молекулами хлороводорода и сероводорода – практически нет.
Водородная связь служит причиной некоторых важных особенностей воды – вещества, которое играет огромную роль в процессах, протекающих в живой и неживой природе. Она в значительной мере определяет свойства и таких биологически важных веществ, как белки и нуклеиновые кислоты, а поэтому имеет большое значение в химии жизненных процессов.
3. Газообразные, жидкие и твердые вещества.
Из курса физики и повседневной жизни вам известно, что в зависимости от условий окружающей среды, и в первую очередь от температуры и давления, вещества могут находиться в одном из трех основных агрегатных состояний: газообразном, жидком и твердом. Каждое агрегатное состояние отличается от другого расположением частиц друг относительно друга и характером их движения. При переходе вещества из одного состояния в другое состав его частиц не изменяется, изменяется лишь их взаимное расположение.
Газообразное состояние. В газообразном состоянии вещество не имеет собственной формы и объема. Оно занимает весь предоставленный ему объем и принимает форму сосуда. Газы обладают большой сжимаемостью и образуют однородные смеси. Эти свойства газов обусловлены тем, что расстояния между их молекулами в десятки раз превышают размер самих молекул. На таком расстоянии практически отсутствует межмолекулярное взаимодействие. Газообразное состояние характеризуется полной неупорядоченностью расположения молекул друг относительно друга. Молекулы в газах движутся хаотически. Если газы в смеси не реагируют между собой, то они сохраняют свою химическую индивидуальность, и поэтому многие физикохимические свойства таких систем могут быть выведены по правилу аддитивности: суммированием характеристик образующих их газов с учетом их мольных долей. Например, средняя молярная масса смеси газов X, Y, Z определяется так:
М(Х + Y + Z) = х(Х) • М(Х) + X(Y) • М(Y) + *(Z) • М(Z),
где х(Х), x(Y)> x(Z) — мольные доли газов X, Y, Z;
М(Х), М(Y), М(Z) — молярные массы газов X, Y, Z.
Четвертое агрегатное состояние — плазма, которая представляет собой ионизированный газ.
Жидкое состояние
В отличие от газов, в жидкостях молекулы расположены ближе друг к другу и удерживаются силами межмолекулярного взаимодействия (рис. 226). Это подтверждает, например, тот факт, что один объем воды образуется в результате конденсации 1300 объемов пара. Расстояние между частицами в жидкостях невелико, поэтому жидкости обладают незначительной сжимаемостью, при данной температуре им присущ определенный объем. Чтобы заметно уменьшить их объем, требуется очень большое давление. В то же время силы межмолекулярного притяжения в жидкостях недостаточно велики, чтобы придать им определенную форму. Молекулы в жидкости свободно перемещаются друг относительно друга, поэтому жидкости обладают текучестью и приобретают форму содержащего их сосуда.
Следовательно, жидкости по структуре и свойствам занимают промежуточное положение между газообразными и твердыми веществами. С повышением температуры жидкости усиливается беспорядок во взаимном расположении частиц, что приближает их к газам. При понижении температуры упорядоченность внутренней структуры возрастает, что сближает их с твердыми веществами.
Твердое состояние
В твердом агрегатном состоянии среднее расстояние между образующими вещество частицами сопоставимо с их размерами, а энергия взаимодействия значительно превышает их среднюю кинетическую энергию. Частицы, образующие твердое вещество, не могут свободно перемещаться друг относительно друга, они лишь совершают колебательные движения около положения равновесия. Этим объясняются наличие у твердых веществ определенного объема и формы, их механическая прочность и незначительная сжимаемость. В зависимости от строения и физических свойств твердые вещества подразделяют на аморфные и кристаллические.
Вещества в аморфном состоянии характеризуются некоторой упорядоченностью частиц, расположенных только в непосредственной близости друг от друга (так называемый ближний порядок), поэтому они изотропны, т. е. их физические свойства не зависят от направления. Проведем опыт. Нанесем на поверхность стекла тонкий ело расплавленного воска и дадим ему застыть. Коснемся застывшего вещества раскаленной иглой. Вокруг иглы воск расплавится. При этом пятно расплавленного воска примет форму круга. Следовательно, теплопроводность стекла не зависит от направления.
Аморфные вещества не имеют определенной температур плавления. При нагревании они постепенно размягчаются, начинают растекаться и, наконец, становятся жидкими. При охлаж- дении они так же постепенно затвердевают.
Аморфные вещества по структуре представляют собой переохлажденные жидкости. Подобно жидкостям они проявляют cвойства текучести, т. е. при длительном действии сравнительно не больших сил постепенно изменяют свою форму.
Примерами веществ в аморфном состоянии могут служить стекла, смолы, клеи, большинство полимеров и т. д.
Кристаллическое состояние
Большинство твердых веществ в окружающем нас мире являются кристаллическими. Для этого состояния характерно строго определенное расположение частиц во всем объеме кристалл (дальний порядок), поэтому в отличие от аморфных кристаллические вещества обладают анизотропией, т. е. их физические свойства (прочность, теплопроводность и т. д.) неодинако вы в различных направлениях. Так, если вышеописанный опыт проделать на гладкой поверхности гипса, то пятно расплавленного воска примет форму эллипса. Значит, теплопроводность гипса в одном направлении более высокая, чем в других.
Кристаллическое вещество в отличие от аморфного плавите; при строго определенной температуре, которую называют температурой плавления. Температура плавления — одно и важнейших физических свойств вещества, измеряя ее, можно определить чистоту данного вещества.
ГРУППА 501 БИОЛОГИЯ 21,22
ТЕМА 21:Мейоз. Образование половых клеток и оплодотворение.
Образование половых клеток. Мейоз
Вспомните!
Где в организме человека происходит образование половых клеток?
Какой набор хромосом содержат гаметы? Почему?
Для осуществления полового размножения необходимы специализированные клетки – гаметы, содержащие одинарный (гаплоидный) набор хромосом. При их слиянии (оплодотворении) происходит образование диплоидного набора, в котором каждая хромосома имеет пару – гомологичную хромосому. В каждой паре гомологичных хромосом одна хромосома получена от отца, а вторая – от матери.
У животных процесс образования половых клеток – гаметогенез – протекает в специальных органах – половых железах (гонадах). У большинства животных мужские половые клетки (сперматозоиды) образуются в семенниках, женские гаметы (яйцеклетки) – в яичниках. Развитие яйцеклеток называют овогенезом или оогенезом, а сперматозоидов – сперматогенезом.
Строение половых клеток.
Яйцеклетки – это относительно крупные неподвижные клетки округлой формы. У некоторых рыб, пресмыкающихся и птиц они содержат большой запас питательных веществ в виде желтка и имеют размеры от 10 мм до 15 см. Яйцеклетки млекопитающих, в том числе и человека, гораздо мельче (0,1–0,3 мм) и желтка практически не содержат.
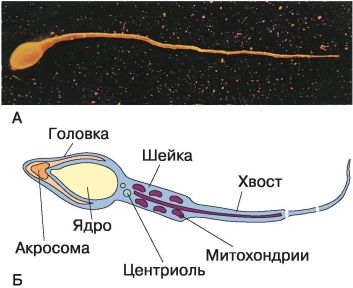
Рис. 63. Сперматозоид млекопитающего: А – электронная фотография; Б – схема строения
Сперматозоиды впервые были описаны голландским естествоиспытателем А. Левенгуком в 1677 г. Он же и ввёл этот термин – сперматозоид (от греч. sperma – семя и zoon – живое существо), т. е. живое семя. Яйцеклетка млекопитающих была открыта в 1827 г. российским учёным К. М. Бэром.
Образование половых клеток. Развитие половых клеток подразделяют на несколько стадий: размножение, рост, созревание, а в процессе сперматогенеза выделяют ещё и стадию формирования (рис. 64).
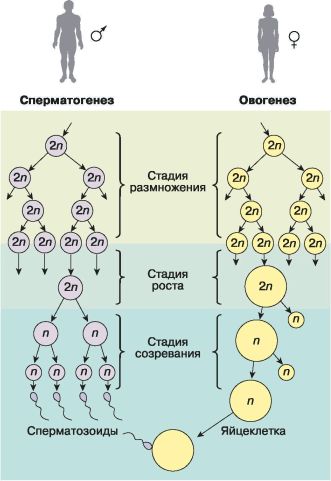
Рис. 64. Гаметогенез у человека
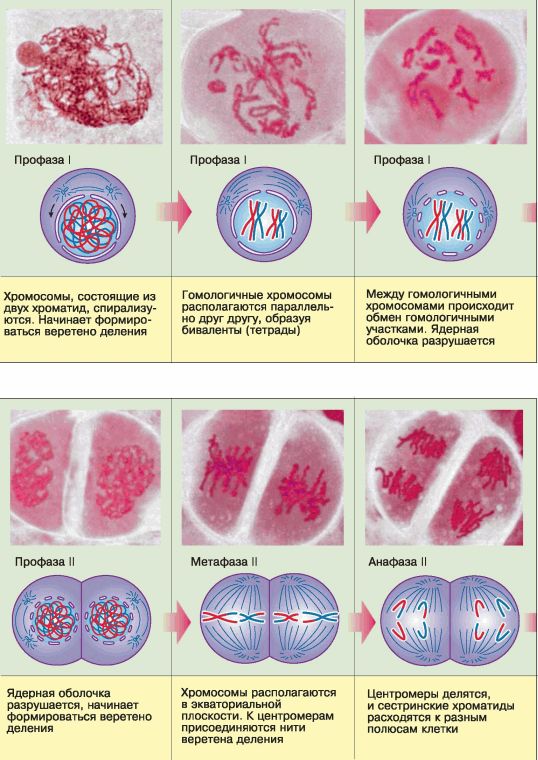
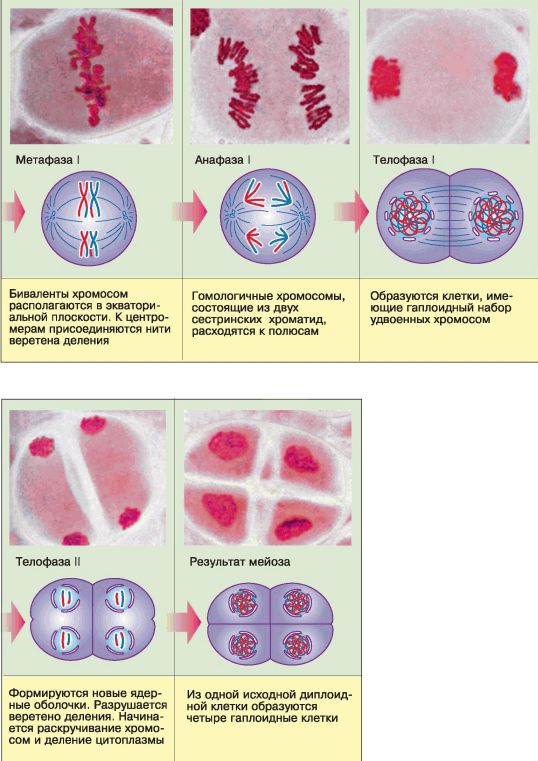
Рис. 65. Фазы мейоза
Стадия размножения. На этой стадии клетки, формирующие стенки половых желёз, активно делятся митозом, образуя незрелые половые клетки. Эта стадия у мужчин начинается с наступлением половой зрелости и продолжается почти всю жизнь. У женщин образование первичных половых клеток завершается ещё в эмбриональном периоде, т. е. общее количество яйцеклеток, которые у женщины будут созревать в течение её репродуктивного периода, определяется уже на ранней стадии развития женского организма. На стадии размножения первичные половые клетки, как и все остальные клетки тела, диплоидны.
Стадия роста. На стадии роста, которая гораздо лучше выражена в овогенезе, происходит увеличение цитоплазмы клеток, накопление необходимых веществ и редупликация ДНК (удвоение хромосом).
Стадия созревания. Третья стадия – это мейоз. Мейоз – это особый способ деления клеток, приводящий к уменьшению числа хромосом вдвое и к переходу клетки из диплоидного состояния в гаплоидное.
Будущие гаметы на стадии созревания делятся дважды. Клетки, приступающие к мейозу, содержат диплоидный набор уже удвоенных хромосом. В процессе двух мейотических делений из одной диплоидной клетки образуются четыре гаплоидные.
Мейоз состоит из двух последовательных делений, которым предшествует однократное удвоение ДНК, осуществлённое на стадии роста. В каждом делении мейоза выделяют четыре фазы, характерные и для митоза (профазу, метафазу, анафазу, телофазу), однако они отличаются некоторыми особенностями (рис. 65).
Профаза первого мейотического деления (профаза I) значительно длиннее, чем профаза митоза. В это время удвоенные хромосомы, каждая из которых состоит уже из двух сестринских хроматид, спирализуются и приобретают компактные размеры. Затем гомологичные хромосомы располагаются параллельно друг другу, образуя так называемые биваленты или тетрады, состоящие из двух хромосом (четырёх хроматид). Между гомологичными хромосомами может произойти обмен соответствующими гомологичными участками (кроссинговер), что приведёт к перекомбинации наследственной информации и образованию новых сочетаний отцовских и материнских генов в хромосомах будущих гамет (рис. 66).
К концу профазы I ядерная оболочка разрушается.
В метафазе I гомологичные хромосомы попарно в виде бивалентов, или тетрад, располагаются в экваториальной плоскости клетки, и к их центромерам присоединяются нити веретена деления.
В анафазе I гомологичные хромосомы из бивалента (тетрады) расходятся к полюсам. Следовательно, в каждую из двух образующихся клеток попадает только одна из каждой пары гомологичных хромосом – число хромосом уменьшается в два раза, хромосомный набор становится гаплоидным. Однако каждая хромосома при этом всё ещё состоит из двух сестринских хроматид.
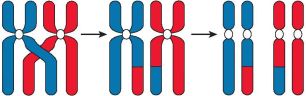
Рис. 66. Перекрёст хромосом и обмен гомологичными участками
В телофазе I образуются клетки, имеющие гаплоидный набор хромосом и удвоенное количество ДНК.
Спустя короткий промежуток времени клетки приступают ко второму мейотическому делению, которое протекает как типичный митоз, но отличается тем, что участвующие в нём клетки гаплоидны.
В профазе II разрушается ядерная оболочка. В метафазе II хромосомы выстраиваются в экваториальной плоскости клетки, нити веретена деления соединяются с центромерами хромосом. В анафазе II центромеры, соединяющие сестринские хроматиды, делятся, хроматиды становятся самостоятельными дочерними хромосомами и расходятся к разным полюсам клетки. Телофаза II завершает второе деление мейоза.
В результате мейоза из одной исходной диплоидной клетки, содержащей удвоенные молекулы ДНК, образуется четыре гаплоидные клетки, каждая хромосома которых состоит из одиночной молекулы ДНК.
При сперматогенезе на стадии созревания в результате мейоза образуется четыре одинаковые клетки – предшественники сперматозоидов, которые на стадии формирования приобретают характерный вид зрелого сперматозоида и становятся подвижными.
Мейотические деления в овогенезе характеризуются рядом особенностей. Профаза I завершается ещё в эмбриональном периоде, т. е. к моменту рождения девочки в её организме уже имеется полный набор будущих яйцеклеток. Остальные события мейоза продолжаются только после полового созревания женщины. Каждый месяц в одном из яичников у женщины продолжает развитие одна из остановившихся в своем делении клеток. В результате первого деления мейоза образуется крупная клетка – предшественник яйцеклетки и маленькое, так называемое полярное, тельце, которые вступают во второе деление мейоза. На стадии метафазы II предшественница яйцеклетки овулирует, т. е. выходит из яичника в брюшную полость, откуда попадает в яйцевод. Если происходит оплодотворение, второе мейотическое деление завершается – образуется зрелая яйцеклетка и второе полярное тельце. Если слияния со сперматозоидом не происходит, не закончившая деление клетка погибает и выводится из организма.
Полярные тельца служат для удаления избытка генетического материала и перераспределения питательных веществ в пользу яйцеклетки. Спустя некоторое время после деления они погибают.
Значение гаметогенеза. В результате гаметогенеза образуются половые клетки, содержащие гаплоидный набор хромосом, что позволяет при оплодотворении восстанавливать число хромосом, характерное для вида. В отсутствие мейоза слияние гамет приводило бы к удвоению числа хромосом у каждого последующего поколения, возникающего в результате полового размножения. Этого не происходит благодаря существованию особого процесса – мейоза, во время которого диплоидное число хромосом (2n) сокращается до гаплоидного (1n). Таким образом, биологическая роль мейоза заключается в поддержании постоянства числа хромосом в ряду поколений вида.
Вопросы для повторения и задания
1. Сравните строение мужских и женских половых клеток. В чём их сходство и отличия?
2. От чего зависит размер яйцеклеток? Объясните, почему яйцеклетки млекопитающих – одни из самых мелких.
3. Какие периоды выделяют в процессе развития половых клеток?
4. Расскажите, как протекает период созревания (мейоз) в процессе сперматогенеза; овогенеза.
5. Перечислите отличия мейоза от митоза.
6. В чём заключается биологический смысл и значение мейоза?
Подумайте! Выполните!
1. Организм развился из неоплодотворённой яйцеклетки. Являются ли его наследственные признаки точной копией признаков материнского организма?
2. Объясните, почему для обозначения мужских половых клеток существует два термина: спермии (например, у покрытосеменных растений) и сперматозоиды.
ТЕМА 22:Эмбриональное и постэмбриональное развитие организмов. Дифференцировка клеток. Развитие взрослого организма.
Онтогенез – индивидуальное развитие организма.
Онтогенез подразделяется на два периода:
- эмбриональный
- постэмбриональный
Эмбриональный период, именуемый эмбриогенезом, берёт начало с соединения ядер женской и мужской половых клеток (момента образования зиготы) и представляет собой процесс оплодотворения. Так, у тех организмов, которым свойственно внутриутробное развитие, эмбриогенез заканчивается рождением, у организмов с личиночного типа развитием – выходом из зародышевых оболочек. Эмбриональное развитие, также называющееся эмбриогенезом, состоит из нескольких последовательных стадий: дробление (бластула), гаструляция, гистогенез, органогенез, нейрула и период дифференцированного зародыша.
- Дробление (бластула). На этой стадии происходит процесс деления образовавшейся зиготы путём митоза на бластомеры (более мелкие клетки, их образуется 64). Ядра бластомерных клеток диплоидны и содержат идентичную наследственную информацию. При дроблении сначала образуются две клетки, после четыре, восемь и так далее. Клетки уменьшаются в размере вследствие того, что в интерфазе клеточного цикла отсутствует пресинтетический период, в котором обычно происходит увеличение размеров дочерних клеток. Данный процесс упорядочен. Образуется покрытый бластодермой однослойный зародыш. Формируется первичная полость тела, заполненная жидкостью, называемая бластоцелем.
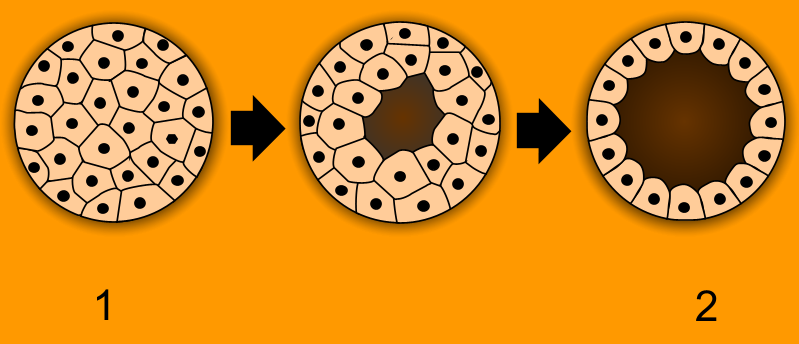
1 - морула, 2 - бластула
- Стадия гаструляция. На этой стадии начинается процесс формирования двух- или трехслойного зародыша. Следует непосредственно после стадии дробления. Образуются такие зародышевые листки: эктодерма (наружный слой), энтодерма (внутренний слой; у двуслойных кишечнополостных) и мезодерма (средний слой; у трёхслойных многоклеточных животных). У кишечнополостных уже на этой стадии образуются специализированные клетки. Процесс гаструляции осуществляется в результате движения групп клеток относительно друг друга. Кроме двух либо трёх зародышевых листков, у гаструлы имеется первичный рот – бластопор. В процессе гаструляции клетки дифференцируются, несмотря на то, все они происходят от зиготы и содержат идентичный ей набор генов, так как образуются путём митотического деления. Дифференцировка происходит вследствие переключения в разных частях зародыша групп генов и синтезом новых белковых молекул, которые и определяют конкретные функции клетки и, в какой – то мере, строение самой клетки.
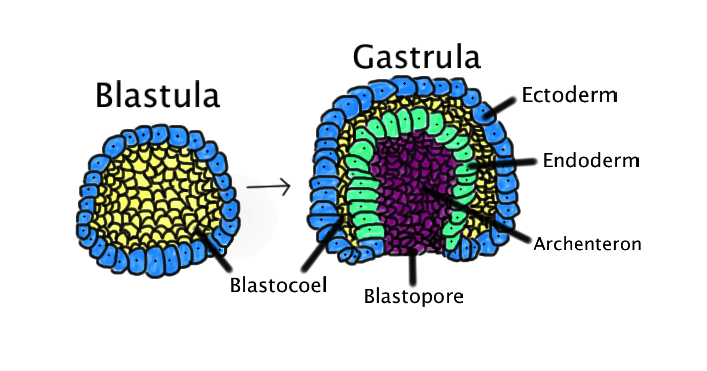
- Гистогенез и органогенез. Гистогенез обуславливается процессом формирования тканей, соответствующих взрослому организму. Органогенез обусловлен процессом образования органов. На этой стадии из наружного зародышевого листка (эктодермы) формируется эпидермис кожи и его производные (волосы, когти, ногти, перья), а также эпителий ротовой полости, эмаль зубов, органы чувств, нервная система и др. Из внутреннего зародышевого листка (энтодермы) формируется кишечник, печень и поджелудочная железа и лёгкие. Производными среднего зародышевого листка (мезодермы) являются все виды соединительной ткани, костная и хрящевая ткань скелета, мышечная ткань, кровеносная система, эндокринные железы и др.
- Нейрула. Промежуточная стадия, сопровождающаяся закладыванием на спинной стороне зародыша хордовых животных нервной трубки. Здесь же происходит закладка комплекса осевых органов, например хорды.
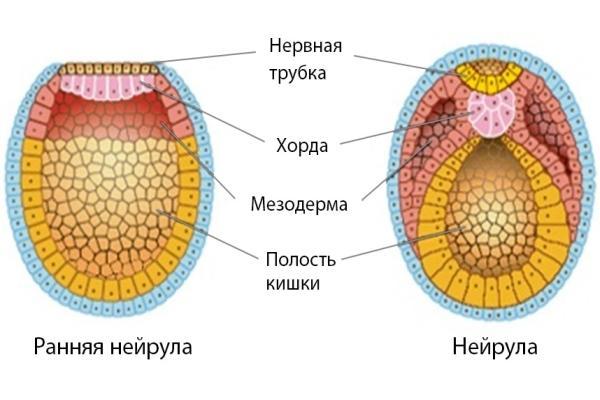
- Период дифференцированного зародыша. Характерной особенностью этой стадии эмбрионального развития является продолжение специализации клеток и быстрым ростом организма.
Постэмбриональное (постнатальное) развитие организма.
Данный этап развития организмов делят на:
- дорепродуктивный (ювенильный) период,
- репродуктивный период,
- пострепродуктивный период.
Связано это со способностью организма к размножению.
Дорепродуктивный (ювенильный) период продолжается с рождения до полового созревания. Для него характерен интенсивный рост и развитие организма. Существует:
- прямое развитие
- непрямое развитие
Прямое развитие подразумевает под собой появление на свет организма уже похожего на взрослую особь. Развитие здесь характеризуется увеличением линейных размеров организма и в формировании половых органов.
яйцо→ личинка → куколка → взрослая особь
Непрямое развитие. При данном способе развития организм не похож на взрослую особь. Процесс развития связан с существенной перестройкой организма. Такой способ развития дает возможность снизить внутривидовую конкуренцию, так как способствует расселению неподвижных либо малоподвижных организмов, проникновению паразитов в организм хозяина. Это осуществляется благодаря наличию в жизненном цикле стадии личинки. Рост организма в данном случае происходит вследствие увеличения количества клеток путём деления и увеличения их размеров.
яйцо → личинка → взрослая особь
Рост бывает двух типов:
- ограниченный (закрытый)
- неограниченный (открытый).
Ограниченный рост характерен для большинства животных и происходит в определённые периоды жизни, до полового созревания. Неограниченный рост продолжается в течение всей жизни организма.
ПРИЧИНЫ НАРУШЕНИЯ РАЗВИТИЯ ОРГАНИЗМОВ
Способность организма к регуляции жизненных функций и ответной реакции на отрицательное воздействие окружающей среды не приходит сразу с рождения. Наоборот, при появлении на свет, еще толком несформированный зародыш больше всего подвержен влияниям негативных факторов. У животных и растений были выработаны специальные приспособления для защиты эмбриона. Сюда относится питательная ткань, обволакивающая зародыш или непосредственное получение питательных веществ из организма матери. Но, несмотря на это, факторы окружающей среды всё равно влияют на развитие зародыша, останавливая рост или же, наоборот, ускоряя процесс.
Факторы, которые вызывают нарушения в развитии зародыша, называются тератогенными. В зависимости от причины возникновения нарушений различают биологические, физические и химические факторы.
Биологические факторы наиболее вредны для организма. К ним относятся различные заболевания, вызванные вредными макро- и микроорганизмами или нарушением деления клеток. Сюда же относится нарушение обмена веществ. Особенно опасным является воздействие болезней беременной матери на эмбрион.
Физические факторы, наносящие вред организму - это различного рода ионизирующие облучения, чрезмерное воздействие ультрафиолетовых лучей, шумы, вибрации и др.
К химическим факторам относятся вредные химические соединения: тяжелые металлы, фенолы, бензапирен, а также некоторые лекарственные средства, алкоголь, никотин и наркотики.
Особый вред на развитие эмбриона оказывает употребление его матерью алкоголя, наркотиков, никотина, угнетающих клеточное дыхание. Злоупотребление этими веществами часто приводит к необратимым нарушениям у эмбриона, а в некоторых случаях даже к летальному исходу.