РАСПИСАНИЕ ЗАНЯТИЙ НА НЕДЕЛЮ: 13.02.23г. - 17.02.23г.
Пн.13.02: 306, 401, 401, 408
Вт. 14.02: 508, 505, 505, 501
Ср. 15.02: 406, 505, 401, ----
Чт. 16.02: 505, 501, 306, 508
Пт. 17.02: 401, 505, ----, 501
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 401 ХИМИЯ 38,39
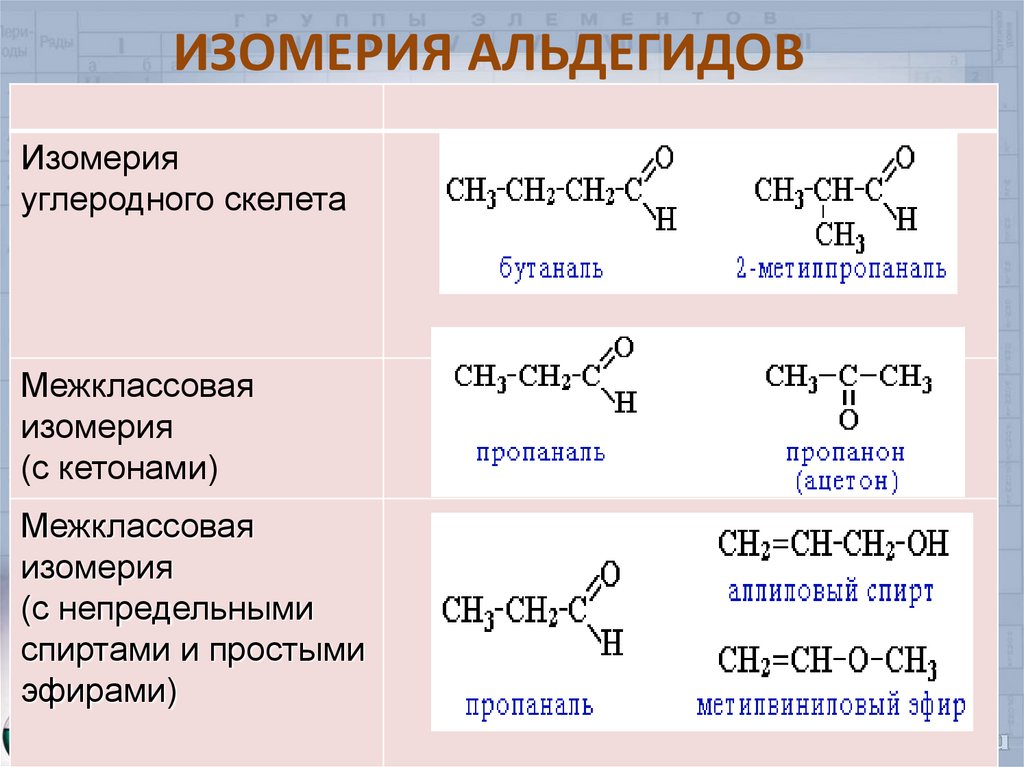
ТЕМА 38:Альдегиды. Понятие об альдегидах. Альдегидная группа как функциональная. Формальдегид и его свойства: окисление в соответствующую кислоту, восстановление в соответствующий спирт. Получение альдегидов окислением соответствующих спиртов. Применение формальдегида на основе его свойств.
Альдегиды. Понятие об альдегидах. Альдегидная группа как функциональная. . Применение формальдегида на основе его свойств.
 Формальдегид представляет собой газообразное при комнатной температуре вещество. Альдегиды до С12 — жидкости, а альдегиды нормального строения с более длинным неразветвлённым углеродным скелетом являются твёрдыми веществами. | |||||||||||||||||||
Низшие альдегиды имеют резкий запах, а высшие гомологи (С8-С13) являются компонентами многих парфюмерных изделий.
Токсичны. Способны накапливаться в организме. Кроме общетоксического, обладают раздражающим и нейротоксическим действием. Эффект зависит от молекулярной массы: чем она больше, тем слабее раздражающее, но сильнее наркотическое действие, причём ненасыщенные альдегиды токсичнее насыщенных. Некоторые обладают канцерогенными свойствами[57].
Альдегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно влияют на нервную систему. С увеличением числа атомов углерода в молекуле раздражающее действие ослабевает. Ненасыщенные альдегиды обладают более сильным раздражающим действием, чем насыщенные.
Из всех альдегидов больше всего производится формальдегида (около 6 млн тонн/год). Он, в основном, используется в производстве смол — бакелита, галалита (в сочетании с мочевиной, меламином и фенолом), для дубления кож, протравливания зерна. Также из него синтезируют лекарственные средства (уротропин) используют как консервант биологических препаратов (благодаря способности свертывать белок). Он является предшественником метилендифенилдиизоцианата, использующегося в производстве полиуретанов и гексогена (довольно сильной взрывчатки).
ТЕМА 39:Карбоновые кислоты. Понятие о карбоновых кислотах. Карбоксильная группа как функциональная. Гомологический ряд предельных однооснóвных карбоновых кислот. Получение карбоновых кислот окислением альдегидов .
Карбоновые кислоты - органические вещества, молекулы которых содержат одну или несколько карбоксильных групп.
Карбоксильная группа ![]() (сокращенно —COOH) - функциональная группа карбоновых кислот - состоит из карбонильной группы и связанной с ней гидроксильной группы.
(сокращенно —COOH) - функциональная группа карбоновых кислот - состоит из карбонильной группы и связанной с ней гидроксильной группы.
По числу карбоксильных групп карбоновые кислоты делятся на одноосновные, двухосновные и т.д.
Общая формула одноосновных карбоновых кислот R—COOH. Пример двухосновной кислоты - щавелевая кислота HOOC—COOH.
По типу радикала карбоновые кислоты делятся на предельные (например, уксусная кислота CH3COOH), непредельные [например, акриловая кислота
Изомеры и гомологи
Одноосновные предельные карбоновые кислоты R—COOH являются изомерами сложных эфиров ![]() (сокращенно R'—COOR'') с тем же числом атомов углерода. Общая формула и тех, и других CnH2nO2.
(сокращенно R'—COOR'') с тем же числом атомов углерода. Общая формула и тех, и других CnH2nO2.
| г о м о л о г и | HCOOH метановая (муравьиная) | ||||
| CH3COOH этановая (уксусная) | HCOOCH3 метиловый эфир муравьиной кислоты | ||||
| CH3CH2COOH пропановая (пропионовая) | HCOOCH2CH3 этиловый эфир муравьиной кислоты | CH3COOCH3 метиловый эфир уксусной кислоты | |||
бутановая (масляная) | 2-метилпропановая | HCOOCH2CH2CH3 пропиловый эфир муравьиной кислоты | CH3COOCH2CH3 этиловый эфир уксусной кислоты | CH3CH2COOCH3 метиловый эфир пропионовой кислоты | |
| и з о м е р ы | |||||
Алгоритм составления названий карбоновых кислот
- Найдите главную углеродную цепь - это самая длинная цепь атомов углерода, включающая атом углерода карбоксильной группы.
- Пронумеруйте атомы углерода в главной цепи, начиная с атома углерода карбоксильной группы.
- Назовите соединение по алгоритму для углеводородов.
- В конце названия допишите суффикс "-ов", окончание "-ая" и слово "кислота".
В молекулах карбоновых кислот p-электроны атомов кислорода гидроксильной группы взаимодействуют с электронами ![]() -связи карбонильной группы, в результате чего возрастает полярность связи O—H, упрочняется
-связи карбонильной группы, в результате чего возрастает полярность связи O—H, упрочняется ![]() -связь в карбонильной группе, уменьшается частичный заряд (
-связь в карбонильной группе, уменьшается частичный заряд (![]() +) на атоме углерода и увеличивается частичный заряд (
+) на атоме углерода и увеличивается частичный заряд (![]() +) на атоме водорода.
+) на атоме водорода.

Последнее способствует образованию прочных водородных связей между молекулами карбоновых кислот.
Физические свойства предельных одноосновных карбоновых кислот в значительной степени обусловлены наличием между молекулами прочных водородных связей (более прочных, чем между молекулами спиртов). Поэтому температуры кипения и растворимость в воде у кислот больше, чем у соответствующих спиртов.
Получение карбоновых кислот
- Окисление альдегидов.
В промышленности: 2RCHO + O2 2RCOOH
2RCOOH
Лабораторные окислители: Ag2O, Cu(OH)2, KMnO4, K2Cr2O7 и др. - Окисление спиртов: RCH2OH + O2
 RCOOH + H2O
RCOOH + H2O - Окисление углеводородов: 2C4H10 + 5O2
 4CH3COOH + 2H2O
4CH3COOH + 2H2O - Из солей (лабораторный способ): CH3COONaкр. + H2SO4 конц.
 CH3COOH
CH3COOH + NaHSO4
+ NaHSO4
ГРУППА 505 ХИМИЯ 24,25
ТЕМА 24:Контрольная работа №1
Контрольная работа.(
У меня в блоге смотрите закладку "Решаем задачи" там есть решенные аналогичные (и не только) задачи))
1.Задача. При пропускании сероводорода объемом 2,8 л (нормальные условия) через избыток раствора сульфата меди (II) образовался осадок массой 11,4г.
Определите выход продукта реакции.
Дано:
V(H2S)=2,8 л;
m(осадка)= 11,4 г; н.у.
Найти: η =?
2.Задача. Какую массу фосфора надо сжечь для получения оксида фосфора (V) массой 7,1 г?
Дано: m(P2O5)=7,1 г.
Найти: m(Р) =?
.ВЫПОЛНИТЕ ТЕСТЫ ( на бумаге и здесь)
ТЕМА 25:Вода. Растворы. Растворение. Вода как растворитель.
А видел ли кто-нибудь из вас воду?
Вопрос показался вам нелепым? Но он относится к совершенно чистой воде, в которой нет никаких примесей. Если быть честным и точным в ответе, то придется сознаться, что такую воду ни я, ни вы пока не видели. Именно поэтому на стакане с водой после надписи «Н2О» стоит знак вопроса. Значит, в стакане не чистая вода, а что тогда?
В этой воде растворены газы: N2, O2, CO2, Ar, соли из почвы, катионы железа из водопроводных труб. Кроме того, в ней взвешены мельчайшие частицы пыли. Вот что мы называем ч и с т о й в о д о й! Много ученых работает над решением трудной проблемы – получить абсолютно чистую воду. Но пока получить такую ультрачистую воду не удалось. Однако вы можете возразить, что есть дистиллированная вода. Кстати, что она собой представляет?
На самом деле мы получаем такую воду, когда стерилизуем банки перед консервированием. Переворачиваем банку вверх дном, помещаем ее над кипящей водой. На донышке банки появляются капельки, это и есть дистиллированная вода. Но как только мы перевернем банку, в нее заходят газы из воздуха, и снова в банке – раствор. Поэтому грамотные хозяйки стараются сразу после стерилизации заполнить банки нужным содержимым. Говорят, что продукты в этом случае будут храниться дольше. Возможно, они правы. Можете поэкспериментировать! Именно потому, что вода способна растворять в себе различные вещества, ученые не могут до сих пор получить идеально чистую воду в больших объемах. А она бы так пригодилась, например, в медицине для приготовления лекарств.
Кстати, находясь в стакане, вода «растворяет» стекло. Поэтому чем толще стекло, тем дольше прослужат стаканы. А что такое морская вода?
Это раствор, в котором содержится много веществ. Например, поваренная соль. А как можно выделить поваренную соль из морской воды?
Выпариванием. Кстати, именно так поступали наши предки. В Онеге были солеварни, где из морской воды выпаривали соль. Соль продавали новгородским купцам, покупали своим невестам и женам дорогие украшения, шикарные ткани. Таких нарядов, как у поморок, не было даже у московских модниц. А все лишь благодаря знаниям свойств растворов! Итак, сегодня мы с вами говорим о растворах и растворимости. Запишем в тетради определение раствора.
Раствор – однородная система, состоящая из молекул растворителя и растворённого вещества, между которыми происходят физические и химические взаимодействия.
Если в сосуд с водой поместить кристаллы поваренной соли, сахара или перманганата калия (марганцовки), то мы можем наблюдать, как количество твердого вещества постепенно уменьшается. При этом вода, в которую были добавлены кристаллы, приобретает новые свойства: у нее появляется соленый или сладкий вкус (в случае марганцовки появляется малиновая окраска), изменяется плотность, температура замерзания и т.д. Полученные жидкости уже нельзя назвать водой, даже если они неотличимы от воды по внешнему виду (как в случае с солью и сахаром). Это – растворы. ОПЫТ!!!
Растворы не отстаиваются и сохраняются все время однородными. Если раствор профильтровать через самый плотный фильтр, то ни соль, ни сахар, ни марганцовокислый калий не удается отделить от воды. Следовательно, эти вещества в воде раздроблены до наиболее мелких частиц – молекул или ионов.
Растворами называются гомогенные (т.е. однородные) смеси переменного состава из двух или более веществ. Наиболее распространенное агрегатное состояние растворов – жидкое.
Под переменным составом раствора понимают то простое обстоятельство, что соотношение смешанных друг с другом веществ может непрерывно изменяться в определенных пределах. Например, раствор соли можно разбавлять чистой водой или, наоборот, упаривать, но полученные при этом жидкости в любом случае будут называться растворами соли. Приведнное выше определение не охватывает всех свойств растворов, поэтому в конце параграфа мы его уточним.
Любой раствор состоит из растворителя и растворенного вещества:
Из двух или нескольких компонентов раствора растворителем является тот, который взят в большем количестве и имеет то же агрегатное состояние, что и раствор в целом.
Не всегда обязательно вода является растворителем – существуют и неводные растворы. Однако когда речь идет о водных растворах, воду считают растворителем и в тех случаях, когда ее меньше. Например, говорят о 96%-ном растворе этилового спирта в воде, а не о 4 %-ном растворе воды в спирте.
** Существуют растворы не только жидкие, но и твердые. В твердых растворах частицы одного вещества хаотично распределены среди частиц какого-нибудь другого, но обязательно твердого вещества. Например, водород охотно растворяется в некоторых металлах (платине, палладии), и это пример твердого раствора. Смеси газов (например, воздух) не называют растворами. Дело в том, что важным свойством растворов является заметное взаимодействие между частицами растворителя и растворенных веществ, а в газах такое взаимодействие практически отсутствует.
Давайте разберемся в том, как происходит растворение веществ. Для этого понаблюдаем, как растворяется добавленный в чай сахар. Если чай холодный, то сахар растворяется медленно. Наоборот, если чай горячий и размешивается ложечкой, то растворение происходит быстро.
Попадая в воду, молекулы сахара, находящиеся на поверхности кристаллов сахарного песка, образуют с молекулами воды межмолекулярные (водородные) связи. При этом с одной молекулой сахара связывается несколько молекул воды. Тепловое движение молекул воды заставляет связанные с ними молекулы сахара отрываться от кристалла и переходить в толщу молекул растворителя (рис. 7-2).
Рис. 7-2. Молекулы сахара (белые кружочки), находящиеся на поверхности кристалла сахара, окружены молекулами воды (темные кружочки). Между молекулами сахара и воды возникают межмолекулярные связи, благодаря которым молекулы сахара отрываются от поверхности кристалла. Молекулы воды, не связанные с молекулами сахара, на рисунке не показаны.

Растворение веществ можно сравнить с перетаскиванием мебели. Представьте, что на время ремонта школьные столы (или парты) составили в спортзале в строгом порядке аккуратным штабелем. Этот упорядоченный штабель является моделью кристаллического вещества, а каждый стол – как бы "молекулой" такого вещества. После окончания ремонта учеников попросили помочь перетащить столы. В спортзал вбежала ватага учеников (эта ватага не что иное, как растворитель, а каждый ученик – молекула растворителя), кто-то залез наверх, кто-то тянет столы снизу – короче, работа закипела. Очень скоро столы, каждый из которых несут где двое, а где четверо ребят, оказываются в разных концах школы, а от штабеля в спортзале не остается и следа.
Количество молекул, способных перейти в раствор, часто ограничено. Молекулы вещества не только покидают кристалл, но и вновь присоединяются к кристаллу из раствора. Пока кристаллов относительно немного, больше молекул переходит в раствор, чем возвращается из него – идет растворение. Но если растворитель находится в контакте с большим количеством кристаллов, то число уходящих и возвращающихся молекул становится одинаковым и для внешнего наблюдателя растворение прекращается.
Например, при комнатной температуре мы не можем растворить в 100 мл воды более 200 г сахара или более 35,9 г поваренной соли. В таких случаях говорят, что раствор стал насыщенным.
Раствор, в котором данное вещество при данной температуре уже больше не растворяется, называется НАСЫЩЕННЫМ.
В насыщенном растворе при данной температуре содержится максимально возможное количество растворенного вещества.
** Если вернуться к примеру со школьными столами, то там тоже возможно образование "насыщенного раствора". Это может произойти в том случае, если столов окажется слишком много и для них в классах уже не будет хватать места. В этом случае часть учеников будет просто-напросто вынуждена вернуться и поставить столы в тот же штабель, откуда они были взяты. Таким образом, количество мебели в спортзале перестанет уменьшаться. Разумеется, ученики гораздо умнее молекул воды и не станут дальше делать бесполезную работу. В реальном растворе, где есть тепловое движение молекул, молекулы продолжают “трудиться”, транспортируя частицы растворенного вещества из кристалла в раствор и обратно.
Такая ситуация называется ДИНАМИЧЕСКИМ равновесием (равновесием в движении). В связи с этим можно дополнить определение насыщенного раствора:
Насыщенным называется такой раствор, который находится в динамическом равновесии с избытком растворенного вещества.
Следовательно, никакое самое сильное перемешивание не помогает растворить в насыщенном растворе дополнительные порции вещества. Однако, если повысить температуру, то раствор вновь может стать ненасыщенным и растворить еще определенную порцию кристаллов.
Мы говорим: "сахар растворяется в воде хорошо" или "мел плохо растворяется в воде". Но можно и количественно оценить способность того или иного вещества к растворению или, другими словами, растворимость вещества.
РАСТВОРИМОСТЬЮ называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях является его содержание в насыщенном растворе.
Если в 100 г воды растворяется более 10 г вещества, то такое вещество называют хорошо растворимым. Если растворяется менее 1 г вещества – вещество малорастворимо. Наконец, вещество считают практически нерастворимым, если в раствор переходит менее 0,01 г вещества. Абсолютно нерастворимых веществ не бывает. Даже когда мы наливаем воду в стеклянный сосуд, очень небольшая часть молекул стекла неизбежно переходит в раствор.
Растворимость, выраженная при помощи массы вещества, которое может раствориться в 100 г воды при данной температуре, называют также коэффициентом растворимости.
В целом растворимость разных веществ определяется многими сложными причинами, некоторые из которых до сих пор не ясны. Поэтому трудно предсказать растворимость какого-либо вещества по его химической формуле или агрегатному состоянию.
В качестве примера приведем растворимость (в граммах вещества на 100 г воды при комнатной температуре) нескольких веществ: твердых, жидких и газообразных, среди которых многие имеют похожие химические формулы (таблица 7-2).
Таблица 7-2. Растворимость некоторых веществ в воде при комнатной температуре.
Название вещества | Формула | Агрегатное состояние | Растворимость (г/100 г воды) |
Серная кислота | H2SO4 | жидкость | любое количество |
Хлористый водород | HCl | газ | 71,9 |
Хлорид натрия | NaCl | крист. | 35,9 |
Сульфат меди | CuSO4 .5H2O | крист. | 20,7 |
Сульфат кальция | CaSO4 | крист. | 0,2 |
Тетрахлорид углерода | CCl4 | жидкость | 0,08 |
Сульфат бария | BaSO4 | крист. | 0,00023 |
Хлорид серебра | AgCl | крист. | 0,00015 |
Растворимость большинства (но не всех!) твердых веществ с увеличением температуры увеличивается, а растворимость газов, наоборот, уменьшается. Это связано прежде всего с тем, что молекулы газов при тепловом движении способны покидать раствор гораздо легче, чем молекулы твердых веществ.
** Если измерять растворимость веществ при разных температурах, то обнаружится, что одни вещества заметно меняют свою растворимость в зависимости от температуры, другие – не очень сильно (см. табл. 7-3).
Таблица 7-3. Влияние температуры на растворимость некоторых твердых веществ. В таблице приведена растворимость в г/100 г воды.
Вещество | Температура, ° C | ||||
0 | 20 | 50 | 80 | 100 | |
KBr | 53,5 | 65,2 | 80,8 | 94,6 | 103,3 |
NaCl | 35,7 | 35,9 | 36,8 | 38,1 | 39,4 |
CaSO4 | 0,176 | 0,206 | 0,180 | 0,102 | 0,066 |
Если полученные в опытах значения нанести на оси координат, то получаются так называемые кривые растворимости различных веществ (рис. 7-3). Эти кривые имеют практическое значение. По ним легко узнать, сколько вещества (например, KNO3) выпадет в осадок при охлаждении до 20 oС насыщенного раствора, приготовленного при 80 oС.
Рис. 7-3. Кривые растворимости твердых (а) и газообразных (б) веществ.

Чистые кристаллы отфильтровывают от охлажденного, загрязненного примесями раствора. Этот способ очистки называется ПЕРЕКРИСТАЛЛИЗАЦИЕЙ. Так очищают, например, многие лекарственные препараты.
Давление не оказывает заметного влияния на растворимость твердых веществ, потому что при растворении не происходит заметного изменения объема системы. Зато увеличение давления повышает растворимость газов. В этом можно убедиться, открыв бутылку с минеральной водой, в которой углекислый газ растворяют под давлением. Как только бутылку открывают, давление в ней падает и тут же уменьшается растворимость газа, который начинает выделяться из раствора в виде пузырьков.
** Когда молекулы растворенного вещества связываются с молекулами воды, то получаются, строго говоря, новые химические соединения. Эти молекулярные агрегаты не имеют постоянного состава и поэтому не являются теми химическими соединениями, которые мы привыкли выражать формулами. Их общее название – гидраты. С гидратами мы уже познакомились в предыдущем параграфе. Процесс связывания веществ с водой называется гидратацией.

Если на разрушение кристаллической решетки тратится больше энергии, чем образуется при получении гидратов, то раствор может охлаждаться. Например, если в стакан с водой поместить твердый нитрат аммония NH4NO3 и поставить стакан на влажный картон, то картон примерзает к стакану – настолько низко падает температура раствора.
Молекулы воды из гидратной оболочки иногда могут вступать в химическую реакцию с растворенным веществом, образуя уже настоящее химическое соединение с постоянным составом, которые можно выделить из раствора, осторожно упаривая воду. Эти соединения называются кристаллогидратами. С кристаллогидратом CuSO4.5H2O (медный купорос) вы уже знакомы.
Приведенные факты говорят о том, что растворение не является чисто физическим явлением, хотя и можно вернуть растворенное вещество в неизменном виде путем выпаривания растворителя. Казалось бы – нет изменения вещества – нет и химических превращений. На самом деле при выпаривании растворов происходит разрушение гидратов (реакция разложения) и вновь образуется кристаллическое вещество. Таким образом, и растворение вещества и выпаривание раствора имеют признаки химических реакций.
Главное, что в самом растворе вещество находится в качественно новом состоянии – в виде гидратов. Поэтому растворение следует считать не физическим, а физико-химическим процессом. С этой точки зрения более полным определением раствора является следующее:
Растворами называют физико-химические однородные смеси переменного состава, состоящие из двух или нескольких веществ и продуктов их взаимодействия.
Напомним, что под переменным составом растворов подразумевают прежде всего возможность непрерывно изменять (в определенных пределах) соотношение растворенного вещества и растворителя. В то же время какой-либо конкретный раствор, если он находится в плотно закупоренном сосуде, и если в нем со временем не происходит необратимых реакций, имеет, конечно, постоянный состав.
ГРУППА 501 ХИМИЯ 42,43
ТЕМА 42,43:Соли как электролиты. Соли средние, кислые и оснóвные. Химические свойства солей в свете теории электролитической диссоциации. Способы получения солей.
Соли – это сложные вещества, образованные атомами металлов и кислотными остатками.
С точки зрения теории электролитической диссоциации соли - это электролиты, диссоциирующие в водных растворах на катионы металлов и анионы кислотных остатков.
Соли бывают средние (нормальные), кислые и основные.
Средние соли – это продукты полного замещения водорода в кислоте на атомы металла или гидроксогруппы ОН- в основании на кислотный остаток. Например: имеем серную кислоту H2SO4. Средние соли этой кислоты будут иметь состав Na2SO4, CaSO4, Al2(SO4)3. Средние соли ортофосфорной кислоты H3PO4: К3PO4, Ca3(PO4)2, AlPO4. Средние соли в водных растворах диссоциируют всегда в одну ступень:
NaCI ® Na+ + CI -
Al2(SO4)3 ® 2AI3+ + 3SO42-.
Кислые соли можно рассматривать как продукты неполного замещения атомов водорода кислоты на атомы металлов. Кислые соли могут быть образованы только от многоосновных кислот. Хлороводородная кислота HCl кислых солей не имеет. Серная кислота H2SO4 образует кислые соли в состав которых входит анион HSO4-: NaHSO4, Cu(HSO4)2, Fe(HSO4)3. Фосфорная кислота Н3РО4 имеет два типа кислых солей: с анионами Н2РО4-, НРО42-.
Кислые соли диссоциируют ступенчато:
KH2PO4 ® K+ + H2PO4-,
H2PO4- H+ + HPO42-,
HPO42- H+ + PO43-,
Кислые соли чаще всего образуются в избытке кислоты:
Mg(OH)2 + 2H2SO4 Mg(HSO4)2 + 2H2O.
кислая соль
Mg(OH)2 + H2SO4 MgSO4 + 2H2O
средняя соль
Основные соли можно рассматривать как продукты неполного замещения ионов ОН- основания на ионы кислотных остатков. Они могут быть образованы только многокислотными основаниями. Гидроксиды щелочных металлов основных солей не имеют.
Гидроксиду меди Сu(ОН)2 соответствуют основные соли с катионом СuОН+: CuOHNO3, (CuOH)2SO4, (CuOH)3PO4.
Гидроксид хрома (III) Cr(ОН)3 образует два ряда основных солей с катионами Cr(ОН)2+, CrОН2+:
Cr(OH)2CI,
CrOHCI2,
(Cr(OH)2)2SO4,
CrOHSO4,
(Cr(OH)2)3PO4,
(CrOH)3(PO4)2.
Основные соли диссоциируют ступенчато:
CuOHNO3 ® CuOH+ + NO3- (первая ступень),
CuOH+ Cu2+ + OH- (вторая ступень).
Основные соли образуются в избытке основания:
2Cu(OH)2 + H2SO4 (CuOH)2SO4 + 2H2O
основная соль
Cu(OH)2 + H2SO4 CuSO4 + 2H2O
средняя соль
Номенклатура солей:
1. Средние соли бескислородных кислот.
Название данных солей образуется следующим образом.
В начале называется анион, названия одноатомных анионов образуются из корней латинских названий соответствующих элементов с суффиксом «ид» (Cl - – хлорид, F - – фторид, S2- – сульфид), затем называется катион. Одноатомные катионы обозначаются русским названием элемента в родительном падеже. Если элемент имеет переменную валентность, то она указывается в названии. Например:
NaCl – хлорид натрия;
Са3Р2 – фосфид кальция;
Fe2S3 – сульфид железа (III).
2. Средние соли кислородсодержащих кислот.
Названия анионов кислородосодержащих кислот составляются из корня латинского названия элемента, образующего кислоту, с добавлением суффиксов: «ат» (когда кислотообразующий элемент проявляет высшую степень окисления):
+6 +5
(SO4)2- – сульфат, (NO3)- – нитрат;
«ит» (когда кислотообразующий элемент проявляет низшую степень окисления):
+4 +3
(SO3)2- – сульфит, (NO2)- – нитрит.

+6
Na2SO4 – сульфат натрия;
+5
К3 РО4 – фосфат калия;
+2 +5
Cu(NO3)2 - нитрат меди (II);
+1 +5
CuNO3 - нитрат меди (I);
+4
CaSO3 - сульфит кальция;
+3
AI(NO2)3 - нитрит алюминия;
+2
Fe(NO2)2 - нитрит железа (II).
Если данный кислотообразующий элемент образует кислоты более, чем в двух степенях окисления, то суффикс «ат» применяется во всех названиях атомов кислот, русские названия которых содержат суффиксы «оватая», «овая» и «ная». При этом к названию аниона, в котором кислотообразующий элемент имеет высшую степень окисления добавляется приставка «пер». Так, анион хлорноватой кислоты:
+5
ClО3- – называется хлорат-ион, а анион хлорной кислоты:
+7
ClО4- – перхлорат-ион.
В названиях анионов кислот, русские названия которых содержат суффиксы «оватистая» и «истая», используется суффикс «ит». К названию же аниона, в котором кислотообразующий элемент имеет низшую степень окисления, добавляется приставка «гипо». Так, анион хлористой кислоты ClO2- – называется хлорит-ион, а хлорноватистый ClO-– гипохлорит-ион.
Кислородосодержащие кислоты хлора | СОЛИ |
HСlO – хлорноватистая кислота | KСlO – гипохлорит калия |
HСlO2 – хлористая кислота | KСlO2 – хлорит калия |
HClO3 – хлорноватая кислота | KСlO3 – хлорат калия |
HClO4 – хлорная кислота | KClO4 – перхлорат калия |
Если в названии кислоты используются приставки «мета», «орто» и другие, то и в названии соли они сохраняются: НРО3 – метафосфорная кислота, КРО3 – метафосфат калия,
H3PO4 - ортофосфорная кислота, K3PO4 - ортофосфат калия.
В названиях анионов кислых солей с одним атомом водорода содержится приставка «гидро» (от латинского названия водорода Hydrogenium – гидрогениум). Если же в кислотном остатке несколько атомов водорода, то в названии кислой соли сохраняется приставка «гидро», но с греческим числительным, показывающим число атомов водорода в анионе:
NaHSO4 – гидросульфат натрия;
Са(НСО3)2 – гидрокарбонат кальция;
FeНРО4 – гидрофосфат железа (II);
КН2РО4 – дигидрофосфат калия;
Fe(Н2РО4)3 – дигидрофосфат железа (Ш).
В состав катионов основных солей входят катион соответствующего металла и группа ОН-, которой дано сложное название, состоящее из корня латинского названия водорода «гидро» и слова «оксид»: гидроксид – ион, или гидроксо – «группа». Причем в названиях сдвоенные буквы «О» превращаются в одну. Число ОН- – групп в сложном катионе указывается греческим числительным:
ZnOHCl – хлорид гидроксоцинка;
FeOHSO4 – сульфат гидроксожелеза (III);
[Al(OH)2]2SO4 – сульфат дигидроксоалюминия;
SnOHNO3 – нитрат гидроксоолова (II).
При составлении формул придерживаются следующих правил:
по суффиксу в названии средней соли определяют какой кислоты соль: бескислородной или кислородсодержащей.
Например:
1. Хлорид натрия: «ид» показывает, что это соль бескислородной кислоты с анионом Cl-. Катионом является Na+. Записываем сначала катион, затем анион Na+Cl-. Катион и анион однозарядны, индексы не используются.
2. Сульфид алюминия: Al3+S2- истинная формула Al2S3, молекула электронейтральна.
3. Сульфат железа (III): «ат» показывает, что это соль кислородсодержащей кислоты, в которой сера в максимальной степени окисления. Это анион SO42-. Катион железа – Fe3+. Записываем сначала катион и анион, а затем индексы, выравнивающие число положительных и отрицательных зарядов: Fe3+(SO4)2- - истинная формула Fe2(SO4)3.
По названию кислой соли определяют, какой кислоты соль (бескислородной или кислородсодержащей) и сколько атомов водорода входит в состав сложного атома. Далее поступают как при составлении формул средних солей.
Например:
1. Гидросульфид железа (III). Соль бескислородной сероводородной кислоты. Анион содержит один атом водорода НS- , катион Fe2+. Записываем катион, сложный анион и индексы: Fe2+(HS)-, следовательно формула будет Fe(HS)2.
2. Дигидрофосфат кальция. Соль кислородсодержащей фос-форной кислоты. Сложный анион содержит два («ди») атома водорода, катион Са2+. Записываем Са2+(Н2РО4)-. Ставим индексы: Са(Н2РО4)2. Молекула электронейтральна.
По названию основной соли определяют, какой кислоты данная соль и сколько гидроксогрупп входит в состав сложного катиона. Записывают сложный катион, затем анион и индексы, уравнивающие заряды. Если металл имеет переменную валентность, то она указывается в названии соли. Например:
1. Хлорид гидроксотитана (IV),
(ТiОН)3+Cl - – правильная формула TiOHCl3.
2. Нитрат дигидроксокобальта (III)
(Сo(OH)2)+NO3- – правильная формула Сo(OH)2NO3.
Классификация солей по следующим признакам:
1. По растворимости:
рстворимые – KCI, Ba(NO3)2, CuSO4,
нерастворимые– BaSO4, AgCI, Ca3(PO4)2.
2.По свойствам:
cредние или нормальные – Na2SO4, MgCI2,
кислые – KHSO4, Ca(H2PO4)2,
основные – CuOHCI, AI(OH)2NO3.
Получение СОЛЕЙ
1. Взаимодействие металла с неметаллом:
Fe +
2. Взаимодействие металлов, расположенных в ряду напряжений левее водорода, с растворами кислот:
Zn + H2SO4 → ZnSO4 + H2
3. Взаимодействие металлов с растворами солей:
Fe + CuSO4 → FeSO4 + Cu.
4. Взаимодействие кислот с основаниями (реакция нейтрализации):
HCI + NaOH → NaCI + H2O.
5. Взаимодействие кислот с основными оксидами:
H2SO4 + CaO → CaSO4 + H2O.
6. Взаимодействие кислот с растворами солей:
H2SO4 + BaCI2 → BaSO4 + 2HCI.
7. Взаимодействие оснований с растворами солей:
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4.
8. Взаимодействие оснований с кислотными оксидами:
Ca(OH)2 + CO2 → CaCO3 + H2O.
9. Взаимодействие основных оксидов с кислотами:
CaO + CO2 → CaCO3
10. Взаимодействие растворов солей с неметаллами:
2KBr + CI2 → 2KCI + Br2.
11. Взаимодействие растворов солей между собой:
NaCI + AgNO3 → AgCI + NaNO3.
12. Получение солей аммония:
NH3 + HCI → NH4CI.
Химические свойства
1. Растворы солей взаимодействуют с металлами, расположенными в ряду напряжений левее, чем металл, входящий в состав соли:
Zn + FeSO4 → ZnSO4 + Fe.
2.Растворимые в воде соли взаимодействуют с основаниями:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4,
KHSO4 + KOH → K2SO4 + H2O.
3. Соли взаимодействуют с растворами кислот:
CaCI2 + H2SO4 → CaSO4 + 2HCI,
Ca(HCO3)2 + 2HCI → CaCI2 + H2O + CO2
MgOHCI + HCI → MgCI2 + H2O.
4.Водные растворы солей взаимодействуют между собой с образованием новых солей:
BaCI2 + Na2SO4 → BaSO4 + 2NaCI,
Ca(HCO3)2 + Na2CO3 → CaCO3 + 2NaHCO3.
5. Растворы солей взаимодействуют с неметаллами:
2NaI + Br2 → 2NaBr + I2
6. Многие соли при нагревании разлагаются, особенно
легко – карбонаты:
CaCO3 →CaO + CO2
(CuOH)2CO3 → CuO + CO2 + H2O,
2NaHCO3 → Na2CO3 + CO2 + H2O.
7. Некоторые соли взаимодействуют с водой с образованием кристаллогидратов:
CuSO4 + 5H2O ® CuSO4 . 5 Н2О.
белый цвет голубой цвет
Основные классы неорганических соединений связаны между собой. Генетической связью между ними считают тот факт, что из неорганических соединений одного класса можно получить соединение другого класса. Иногда это можно сделать в одну стадию, иногда – в несколько:







