ПОНЕДЕЛЬНИК, 18.10.21г. 306, 308, 408, 301
моя почта : rimma.lu@gmail.com
ВНИМАНИЕ!!! ОЛИМПИАДА ПО БИОЛОГИИ И ХИМИИ!!! ЗАДАНИЯ НА ВКЛАДКЕ НАШЕГО САЙТА http://kka.zorinsk.net/index.php/obuchayushchimsya/olimpiadnye-zadaniya
ГРУППА 306 ХИМИЯ 13,14
ТЕМА: Классификация органических веществ.
- строение углеродного скелета молекулы;
- наличие в молекуле функциональных групп.
Алифатические соединения с линейной цепью | Алифатические соединения с разветвлённой цепью |
 |
Карбоциклические соединения | Гетероциклические соединения |
 |  |
Насыщенные углеводороды | Ненасыщенные углеводороды |
Кислородсодержащие соединения | Азотсодержащие соединения |
ТЕМА: Классификация веществ по строению углеродного скелета и наличию функциональных групп. Гомологи и гомология.
заместители неуглеводородного характера, определяющие типичные химические свойства органического вещества и его принадлежность к определённому классу.
Функциональные группы образуют все атомы, кроме водорода, или группы атомов, связанные с атомом углерода. Функциональная группа оказывается окончательным признаком, по которому соединения относятся к тому или иному классу.
Органические соединения с одной функциональной группой называют монофункциональными, соединения с несколькими одинаковыми функциональными группами — полифункциональными, соединения с несколькими разными функциональными группами — гетерофункциональными.
Функциональные группы и их обозначение приведено в таблице.
Важнейшие функциональные группы
| Функциональная группа | Класс соединения | Общая формула | |
|---|---|---|---|
| Обозначение | Название | ||
| Галоген | Галогенпроизводные углеводородов | ||
| Гидроксильная группа | Спирты, фенолы | ||
| Карбонильная группа | Альдегиды, кетоны | ||
| Карбоксильная группа | Карбоновые кислоты | | |
| Аминогруппа | Амины | ||
| Нитрогруппа | Нитросоединения | ||
| Сульфогруппа | Сульфокислоты | ||
Органические соединения с одной функциональной группой называют монофункциональными, соединения с несколькими одинаковыми функциоанльными группами — полифункциональными. Примером полифункциональных соединений являются, например многоатомные спирты (этиленгликоль, глицерин и др.), дикарбоновые кислоты (щавелевая кислота).
Соединения с несколькими разными функциональными группами называются гетерофункциональными. Гетерофункциональными соединениями являются, например, аминокислоты.
Разные соединения, входящие в состав одного класса, могут отличаться друг от друга как химической активностью, так и агрегатным состоянием, растворимостью и другими физическими свойствами. На свойства органических соединений одного класса влияет длина углеродного скелета.
Важнейшее понятие органической химии — гомологи.
соединения, принадлежащие к одному классу, обладающие сходными свойствами, но отличающиеся по составу на одну или несколько групп
Например, гомологами являются щавелевая и малоновая кислоты, глицин и аланин.
Гомологи образуют гомологический ряд, состав которого можно выразить одной общей формулой, например: алканы —
 Коротко о главном
Коротко о главном
Для классификации органических соединений и построения их названий в молекуле органического соединения принято выделять углеродный скелет и функциональные группы.
Углеродный скелет — последовательность химически связанных между собой атомов углерода. Углеродные скелеты разделяют на ациклические (не содержащие циклов), циклические и гетероциклические, т. е. содержащие атомы, отличные от атомов углерода (азот, кислород и др.). Ациклические скелеты бывают неразветвлёнными и разветвлёнными.
Разнообразные соединения рассматриваются как производные углеводородов, полученные введением в их молекулы функциональных групп.
Функциональные группы — это заместители неуглеводородного характера, определяющие его типичные химические свойства и принадлежность к определенному классу органических веществ.
Гомологи — это соединения, принадлежащие к одному классу, но отличающиеся по составу на одну или несколько групп
 Вопросы для самоконтроля
Вопросы для самоконтроля
Поясните необходимость классификации органических соединений.
Как вы считаете, почему многие органические вещества обладают сходными свойствами?
По каким признакам можно классифицировать сходные по свойствам органические вещества?
Что такое углеродный скелет?
Что такое функциональная группа? Приведите примеры важнейших функциональных групп.
Может ли молекула органического соединения содержать несколько одинаковых или разных функциональных групп? Аргументируйте свой ответ.
Чем отличаются друг от друга соединения, принадлежащие к одному и тому же классу органических соединений?
Поясните, почему соединения, принадлежащие к одному гомологическому ряду, обладают сходными свойствами, но в то же время имеют некоторые отличия.
 Классификация органических соединений
Классификация органических соединений
ГРУППА 308 ХИМИЯ 15,16
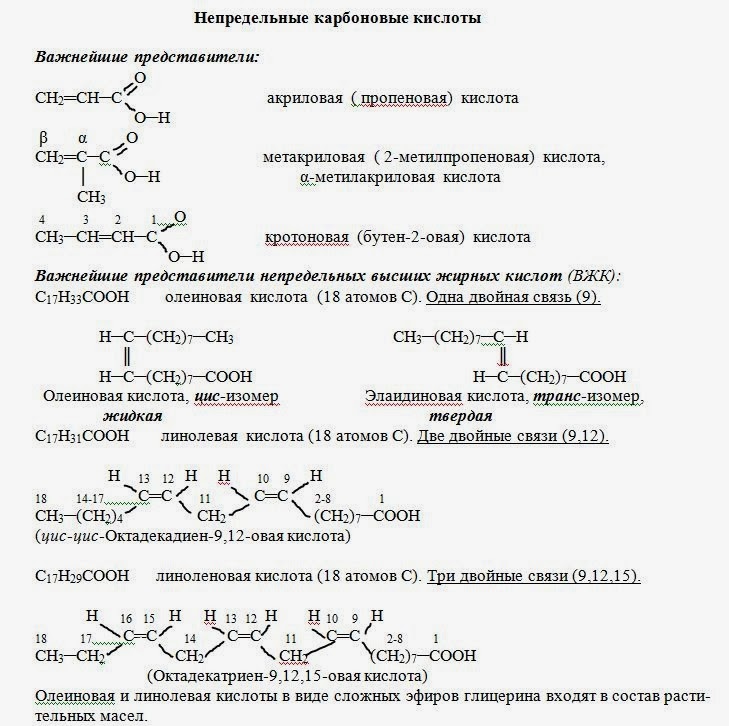
ТЕМА: Краткие сведения о непредельных карбоновых кислотах.
Номенклатура, изомерия.
В группе непредельных кислот наиболее часто используют эмпирические названия:
СН2=СН-СООН - акриловая (пропеновая) кислота,
СН2=С(СН3)-СООН - метакриловая (2-метилпропеновая) кислота.
Изомерия в группе непредельных одноосновных кислот связана с:
а) изомерией углеродного скелета;
б) положением двойной связи;
в) цис-транс-изомерией.
ТЕМА:Генетическая связь карбоновых кислот с другими классами органических соединений
ТЕМА: Практическая работа№3. Получение и свойства карбоновых кислот.
Практическая работа № 3. Получение и свойства карбоновых кислот
Цель работы: Получить уксусную кислоту и изучить её свойства.
Реактивы и оборудование: ацетат натрия, серная кислота (конц.), уксусная кислота, магний (порошок), цинк, гидроксид натрия, карбонат натрия, фенолфталеин, универсальная индикаторная бумага, прибор для получения и собирания кислоты, спиртовка, пробирку, вата, спички.
Ход работы:
Внимание!!! Работа с кислотами!! Соблюдайте ТБ!
Опыт 1. Получение уксусной кислоты.
В пробирку с ацетатом натрия прибавить 1- 2 мл концентрированной серной кислоты. Закрыть пробирку пробкой с газоотводной трубкой, конец которой опустите в другую пробирку вход в пробирку прикрыть ваткой, смотрите рисунок:
Смесь в пробирке осторожно нагревайте до тех пор, пока в приёмнике – пробирке не соберётся 1 -2 мл жидкости. Прекратите нагревание, закройте спиртовку.
Опустите в пробирку с образовавшейся жидкости универсальную индикаторную бумагу. Как изменился цвет индикатора? Почему? Запишите уравнение диссоциации уксусной кислоты.
Опишите запах, образовавшейся жидкости? Соблюдайте осторожность при определении запаха! Составьте уравнение данной химической реакции.
Опыт 2. Взаимодействие уксусной кислоты с металлами.
Посмотрите видео-опыт «Взаимодействие уксусной кислоты с металлами»
В одну пробирку положите гранулу цинка, в другую порошок магния. В обе пробирки прилейте 1 мл уксусной кислоты. Что наблюдаете? Сравните скорость этих реакций? Запишите соответствующие уравнения химических реакций, назовите продукты, укажите тип реакции.
Опыт 3. Взаимодействие уксусной кислоты с основаниями.
Посмотрите видео-опыт «Взаимодействие уксусной кислоты с основаниями»
В пробирку налейте 1 мл гидроксида натрия и добавьте 1 каплю фенолфталеина. Что наблюдаете? Почему?
Затем добавьте к содержимому пробирки уксусную кислоту. Почему происходит обесцвечивание? Запишите УХР (УРАВНЕНИЕ ХИМИЧЕСКОЙ РЕАКЦИИ), назовите продукты.
Название опыта. Что делали. | УХР. Наблюдения. Выводы |
опыт 2 опыт 3 | 2СН3СООН + Мg = H2↑ + ( CH3COO)2 Mg- выдел. газ 2СН3СООН + Zn = H2 ↑ + ( CH3COO)2 Zn - выдел. газ |
ГРУППА 408 ХИМИЯ 13
ТЕМА: Решение задач на нахождение молекулярной формулы газообразного углеводорода по массе (объему) продуктов сгорания.
При сжигании углеводорода массой 2,1 г получили 6,6 г оксида углерода(IV) и 2,7 г воды. Относительная плотность органического соединения по водороду 42. Выведите молекулярную формулу углеводорода.
Дано: Решение: m(СхНу) = 2,1 г m(СО2) = 6,6 г m(H2О) = 2,7 г D(Н2) = 42 Найти молекулярную формулу углеводорода. | Решение: 1. По относительной плотности найдём молярную массу углеводорода: D(Н2) = М(СхНу); М(Н2) М(СхНу) = 2 г/моль · 42 = 84 г/моль. 2. Рассчитаем массу и количество вещества оксида углерода(IV), выделившегося при сгорании 1 моль (или 2,1г 6,6г СхНу + О2 ® СО2 + Н2О; х = m(СО2) = Найдем количество вещества СО2, Найдём количество вещества СО2, выделившееся при сгорании 1 моль углеводорода: Мr(СО2) = 12 +16 · 2 = 44; М(СО2) = 44 г/моль; ν(СО2) = 3. Рассчитаем массу и количество вещества воды, выделившейся при сгорании 1 моль углеводорода. Для этого составим схему уравнения реакции горения углеводорода: 2,1г 2,7г СхНу + О2 ® СО2 + Н2О. Составим и решим пропорцию: у = m(H2О) = Найдём количество вещества воды, которое содержится в 108 г: Мr(H2О) = 1 · 2 + 16 = 18; М(H2О) = 18 г/моль; ν(H2О) = 4. Определим молекулярную формулу органического соединения: СхНу + 9О2 ® 6СО2 + 6Н2О. В 6 моль оксида углерода(IV), образовавшихся при сгорании 1 моль углеводорода, содержится 6 моль атомов углерода; в 6 моль воды, образовавшейся при сгорании 1 моль углеводорода, содержится 12 атомов водорода. Следовательно: в 1 моль углеводорода содержалось 6 моль атомов углерода и 12 моль атомов водорода. Молекулярная формула углеводорода С6Н12. атомов водорода Ответ: С6Н12. |
ГРУППА 301 ХИМИЯ 13,14
ТЕМА: Валентность.
Валентность -это свойство атома химического элемента присоединять или замещать определенное число атомов другого элемента, т.е., иными словами, это количество химических связей, которые атом данного химического элемента может образовывать с другими атомами.
Валентность углерода в органических соединениях равна IV. Этот тезис представляет собой одно из основных положений теории строения органических соединений А.М. Бутлерова.
Для углерода характерно наличие двух валентностей- высшей IV и низшей II. Однако, если изобразить структурные формулы органических веществ, не учитывая положения теории, валентность углерода будет представляться дробным числом, чего не может быть, поскольку величина валентности всегда является целым числом.
Согласно, теории строения органических соединений А.М. Бутлерова атомы в молекулах органических соединений связаны между собой в определенной последовательности, это означает, что атомы углерода могут быть связаны между собой, причем не всегда обязательно одинарными связями. Например: — этан;
— пропен.
ТЕМА: Химическое строение как порядок соединения атомов в молекулы по валентности. Изготовление моделей молекул органических веществ.
Во времена А. М. Бутлерова в органической химии широко использовали эмпирические (молекулярные) и структурные формулы. Последние отражают порядок соединения атомов в молекуле согласно их валентности, которая обозначается черточками.
Н
1
Н-С-Н
l
Н
Для простоты записи часто используют сокращенные структурные формулы, в которых черточками обозначают только связи между атомами углерода, а также связи в функциональных группах.
Сокращенные МОЛЕКУЛЯРНЫЕ формулы
С2Н6
Затем, по мере развития знаний о природе химической связи и о влиянии электронного строения молекул органических веществ на их свойства, стали пользоваться электронными формулами, в которых ковалентную связь условно обозначают двумя точками. В таких формулах часто показывают направление смещения электронных пар в молекуле. Например, для уксусного альдегида
Современная органическая химия различает два основных типа изомерии: структурную (изомерию цепи, изомерию положения кратных связей, изомерию гомологических рядов, изомерию положения функциональных групп) и стереоизомерию (геометрическую, или цис-, трсшсизомерию, оптическую, или зеркальную, изомерию).
вещества, имеющие одинаковую молекулярную формулу, но разное строение и разные физические и химические свойства.
Например, формуле
Этанол Диметиловый эфир
Итак, вы смогли убедиться в том, что второе положение теории химического строения, четко сформулированное А. М. Бутлеровым, было неполным. С современных позиций это положение требует дополнения:
- свойства веществ зависят не только от их качественного и количественного состава, но и от их
- химического,
- электронного,
- пространственного строения.
Создание теории строения веществ сыграло важнейшую роль в развитии органической химии. Теория строения создала предпосылки для объяснения и прогнозирования различных видов изомерии молекул органических соединений, а также направлений и механизмов протекания химических реакций.
На основе этой теории химики-органики создают вещества, которые не только заменяют природные, но по свойствам значительно их превосходят. Так, синтетические красители гораздо лучше и дешевле многих природных, например ализарина и индиго. В больших количествах производят синтетические каучуки с самыми разнообразными свойствами. Широкое применение находят пластмассы и волокна, изделия из которых используют в технике, быту, медицине, сельском хозяйстве.
Сравнивая две величайшие теории химии — теорию строения А. М. Бутлерова и теорию периодичности Д. И. Менделеева, — нетрудно заметить, что в обеих теориях так много общего в путях их становления, направлениях развития и общенаучном значении. Впрочем, в истории любой другой ведущей научной теории (теории Ч. Дарвина, генетике, квантовой теории и т. д.) можно найти такие общие этапы.
ВОПРОСЫ ПЕРВОГО ТУРА ОЛИМПИАДЫ ПО ХИМИИ для 1 и 2 курсов
ПРИМЕЧАНИЕ: Выбираются 5 вопросов, тематика которых уже изучена.
При ответе на поставленные вопросы придерживайтесь следующих правил:
- опираться на наличие не только фактических знаний, но и на умение мыслить логически, обосновывать свою точку зрения;
- изложение ответа не должно быть коротким и однозначным, а представлять собой целый ряд правильных или правдоподобных утверждений и предположений.
Выполненные задания присылать на эл. почту - rimma.lu@rambler.ru
ЗАДАНИЯ:
Брутто-формула каолина (белой глины) может быть записана как H4 Si2 Al2 O9. Установлено, что это вещество состоит из нескольких хорошо известных оксидов. Представьте формулу каолина в виде оксидов. (2 балла)
2. Подберите коэффициенты в следующих уравнениях реакций:
NH3 + O2 → N2 + H2 O,
K + H2 O → KOH + H2,
(NH4)2Cr2 O7 → N2 + H2 O + Cr2 O3,
P2 O5 + H2 O → H3 PO4. (4 балла)
3.Доктор Пилюлькин готовит к полету раствор иода. Для этого он в 100 мл спирта (плотность 0,8 г/мл) растворяет 0,5 г иода. Определите массовую долю йода в полученном растворе. (3балла)
4. Бедному Асовсем неудобно в своей квартире: сверху его грозиться сжечь Б, справа – отравить ядовитый Д, а живущий слева тихий Еиногда начинает буянить и совсем не ясно, что от него ждать – либо отравит, либо подожжет квартиру. Но когда Е успокаивается, то начинает светиться бледно-зеленым светом и всех радует. Задание: Определите, кто такие А, Б, Д, Е ?
5.В 25 мл раствора 20%-ной соляной кислоты растворили 4,0 г сульфида железа (II), после выделения газа в раствор добавили 1,68 г железных опилок. Рассчитайте массовые доли веществ в полученном растворе. (8 баллов)
6.В доме лондонского ювелира исчез алмаз необычного голубого цвета. Срочно приглашенный в дом знаменитый сыщик Шерлок Холмс обратил внимание на баллон с хлором, отводная трубка от которого была погружена в колбу с раствором пероксида водорода. “Где хранился алмаз?” – спросил Холмс. “В маленьком алюминиевом футляре, который стоял вот здесь”, – ответил ювелир и показал на серую кучку пепла рядом с включенной горелкой. “Алмаза уже не вернуть”, – заметил Шерлок Холмс. Задание:Ювелир прислал нам схему места происшествия и попросил вас объяснить, что же все-таки случилось?
7.Самки бабочки медведицы сигнализируют самцам с помощью пахучего вещества – аттрактанта. Это 2-метил-замещенный алкан. Его относительная молекулярная масса равна 254. Составьте структурную формулу данного алкана. (2 балла)
8.Перед вами в трех шкатулках находятся: в первой – натуральный и фальшивый бриллианты; во второй – натуральный и фальшивый жемчуг; в третьей – натуральное и поддельное золотое изделие. Задание: С помощью каких химических реакций можно отличить натуральные объекты? (6 баллов)
- Цианид калия – один из самых сильных ядов, и хранят его обязательно в сейфе под замком. Но однажды утром лаборант, вынув из сейфа банку с надписью KCN, обнаружил, что крышки нет, характерный запах миндаля исчез, а между тем объем содержимого не уменьшился. Анализ показал, что вещество в банке вовсе не цианид калия, при подливании к нему соляной кислоты наблюдалось характерное шипение. Задание: Определите, что за вещество в банке, и кто виноват в пропаже? (5 баллов)
- Отрывок из повести Хаггарда “Жемчужина Нила”: “Она вынула из уха одну из тех огромных жемчужин … и …опустила жемчужину в уксус. Наступило молчание, потрясенные гости, замерев, наблюдали, как жемчужина медленно растворяется в крепком уксусе. Вот от нее не осталось и следа, и тогда Клеопатра подняла кубок, покрутила его, взбалтывая уксус, и выпила весь до последней капли”.Задание: Объясните почему Клеопатра смогла выпить “крепкий уксус”, а также составьте уравнение реакции. (3 балла)