СУББОТА 30.04.22 г. 303,405,401,406,305
ГРУППА 303 ХИМИЯ 15,16
ТЕМА: Сложные эфиры и жиры. Получение сложных эфиров реакцией этерификации. Сложные эфиры в природе, их значение. Применение сложных эфиров на основе свойств
ТЕМА:Сложные эфиры в природе, их значение. Применение сложных эфиров на основе свойств.
СЛОЖНЫЕ ЭФИРЫ И ЖИРЫ. ПОЛУЧЕНИЕ СЛОЖНЫХ ЭФИРОВ РЕАКЦИЕЙ ЭТЕРИФИКАЦИИ. СЛОЖНЫЕ ЭФИРЫ В ПРИРОДЕ, ИХ ЗНАЧЕНИЕ. ПРИМЕНЕНИЕ СЛОЖНЫХ ЭФИРОВ НА ОСНОВЕ СВОЙСТВ.Что такое сложные эфиры? Запись в тетради. Сложные эфиры — это вещества, которые образуются в результате взаимодействия органических или кислородсодержащих неорганических кислот со спиртами (реакции этерификации). Общая формула сложных эфиров одноатомных спиртов и одноосновных карбоновых кислот:
2.Сложные эфиры в природе. Запись в тетради. Сложные эфиры – функциональные производные карбоновых кислот, в молекулах которых гидроксильная группа (-ОН) замещена на остаток спирта (-OR)
Сложные эфиры карбоновых кислот – соединения с общей формулой R–COOR', где R и R' – углеводородные радикалы. Сложные эфиры – жидкости, обладающие приятными фруктовыми запахами. В воде они растворяются очень мало, но хорошо растворимы в спиртах. Сложные эфиры очень распространены в природе. Их наличием обусловлены приятные запахи цветов и фруктов. Они даже могут находиться в коре некоторых деревьев.
Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Воски не растворяются в воде. Их можно формовать в нагретом состоянии. Примерами животных восков могут служить пчелиный воск, а также ворвань (спермацет), содержащийся в черепной коробке кашалота (кашалотовый воск). Пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат): CH3(CH2)14–CO–O–(CH2)29CH3. 3.Физические свойства сложных эфиров. Запись в тетради. Физические свойства сложных эфиров:
4.Название сложных эфиров. Запись в тетради. Название сложных эфиров: Краткие названия сложных эфиров строятся по названию радикала (R') в остатке спирта и названию группы RCOO- в остатке кислоты. Например, этиловый эфир уксусной кислоты CH3COOC2H5 называется этилацетат. 5.Получение сложных эфиров. Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты. Реакция этерификации.
6. Применение сложных эфиров: 1) лекарственные средства; 2,3)парфюмерия и косметика; 4) синтетические и искусственные волокна; 5) лаки; 6) производство напитков и кондитерских изделий.
|
ТЕМА: Жиры как сложные эфиры. Классификация жиров. Химические свойства жиров: гидролиз и гидрирование жидких жиров. Мыла.
ЖИРЫ, ИХ СТРОЕНИЕ, СВОЙСТВА И ПРИМЕНЕНИЕ
Жиры – ценный химический продукт, один из главных компонентов животных и растительных клеток. Этот урок будет посвящен изучению строения и наиболее характерных свойств жиров.
«Химия везде, химия во всем:
Во всем, чем мы дышим,
Во всем, что мы пьем,
Во всем, что едим».




I. Жиры в природе и их роль
Люди давно научились выделять жир из натуральных объектов и использовать его в повседневной жизни. Жир сгорал в примитивных светильниках, освещая пещеры первобытных людей, жиром смазывали полозья, по которым спускали на воду суда. Жиры – основной источник нашего питания. Но неправильное питание, малоподвижный образ жизни приводит к избыточному весу. Животные пустынь запасают жир как источник энергии и воды. Толстый жировой слой тюленей и китов помогает им плавать в холодных водах Северного Ледовитого океана.
Жиры широко распространены в природе. Наряду с углеводами и белками они входят в состав всех животных и растительных организмов и составляют одну из основных частей нашей пищи. Источниками жиров являются живые организмы. Среди животных это коровы, свиньи, овцы, куры, тюлени, киты, гуси, рыбы (акулы, тресковые, сельди). Из печени трески и акулы получают рыбий жир – лекарственное средство, из сельди – жиры, используемые для подкормки сельскохозяйственных животных. Растительные жиры чаще всего бывают жидкими, их называют маслами. Применяются жиры таких растений, как хлопок, лен, соя, арахис, кунжут, рапс, подсолнечник, горчица, кукуруза, мак, конопля, кокос, облепиха, шиповник, масличная пальма и многих других.
Жиры выполняют различные функции: строительную, энергетическую (1 г жира дает 9 ккал энергии), защитную, запасающую. Жиры обеспечивают 50% энергии, требуемой человеку, поэтому человеку необходимо потреблять 70–80 г жиров в день. Жиры составляют 10–20% от массы тела здорового человека. Жиры являются незаменимым источником жирных кислот. Некоторые жиры содержат витамины А, D, Е, К, гормоны.
Многие животные и человек используют жир в качестве теплоизолирующей оболочки, например, у некоторых морских животных толщина жирового слоя достигает метра. Кроме того, в организме жиры являются растворителями вкусовых веществ и красителей. Многие витамины, например витамин А, растворяются только в жирах.
Некоторые животные (чаще водоплавающие птицы) используют жиры для смазки своих собственных мышечных волокон.
Жиры повышают эффект насыщения пищевыми продуктами, т. к. они перевариваются очень медленно и задерживают наступление чувства голода.
II. История открытия жиров
Еще в 17 в. немецкий ученый, один из первых химиков-аналитиков Отто Тахений (1652–1699) впервые высказал предположение, что жиры содержат «скрытую кислоту».
В 1741 французский химик Клод Жозеф Жоффруа (1685–1752) обнаружил, что при разложении кислотой мыла (которое готовили варкой жира со щелочью) образуется жирная на ощупь масса.
То, что в состав жиров и масел входит глицерин, впервые выяснил в 1779 знаменитый шведский химик Карл Вильгельм Шееле.
Впервые химический состав жиров определил в начале прошлого века французский химик Мишель Эжен Шеврёль, основоположник химии жиров, автор многочисленных исследований их природы, обобщенных в шеститомной монографии "Химические исследования тел животного происхождения".
1813 г Э. Шеврёль установил строение жиров, благодаря реакции гидролиза жиров в щелочной среде.Он показал, что жиры состоят из глицерина и жирных кислот, причем это не просто их смесь, а соединение, которое, присоединяя воду, распадается на глицерин и кислоты.
III. Синтез жиров

В 1854 французский химик Марселен Бертло (1827–1907) провел реакцию этерификации, то есть образования сложного эфира между глицерином и жирными кислотами и таким образом впервые синтезировал жир.

Общая формула жиров (триглицеридов):

Жиры – сложные эфиры глицерина и высших карбоновых кислот. Общее название таких соединений – триглицериды.



Животные жиры содержат главным образом глицериды предельных кислот и являются твердыми веществами.
Растительные жиры, часто называемые маслами, содержат глицериды непредельных карбоновых кислот. Это, например, жидкие подсолнечное, конопляное и льняное масла.

Природные жиры содержат следующие жирные кислоты
Насыщенные: стеариновая (C17H35COOH) пальмитиновая (C15H31COOH) масляная (C3H7COOH) | В составе животных жиров |
Ненасыщенные: олеиновая (C17H33COOH, 1 двойная связь) линолевая (C17H31COOH, 2 двойные связи) линоленовая (C17H29COOH, 3 двойные связи) арахидоновая (C19H31COOH, 4 двойные связи, реже встречается) | В составе растительных жиров |
Жиры содержатся во всех растениях и животных. Они представляют собой смеси полных сложных эфиров глицерина и не имеют чётко выраженной температуры плавления.
V. Физические свойства жиров
При комнатной температуре жиры (смеси триглицеридов) – твердые, мазеобразные или жидкие вещества. Как любая смесь веществ, они не имеют четкой температуры плавления (т.е. плавятся в некотором диапазоне температур). Определенной температурой плавления характеризуются лишь индивидуальные триглицериды.
Консистенция жиров зависит от их состава:
- в твердых жирах преобладают триглицериды с остатками насыщенных кислот, имеющие относительно высокие температуры плавления;
- для жидких жиров (масел), напротив, характерно высокое содержание триглицеридов ненасыщенных кислот с низкими температурами плавления.
Причиной снижения температуры плавления триглицеридов с остатками ненасыщенных кислот является наличие в них двойных связей с цис-конфигурацией. Это приводит к существенному изгибу углеродной цепи, нарушающему упорядоченную (параллельную) укладку длинноцепных радикалов кислот.
Сравним пространственное строение ненасыщенной и насыщенной и кислот с равным числом углеродных атомов в цепи: олеиновой C17H33COOH и стеариновой C17H35COOH.

На молекулярной модели олеиновой кислоты виден изгиб цепи по связи С=С, препятствующий плотной упаковке молекул.

В углеродной цепи стеариновой кислоты отсутствуют изгибы, поэтому ее молекулы способны к плотной параллельной укладке.
Чем плотнее упаковка молекул вещества, тем выше температуры его фазовых переходов (т.плав., т.кип.). Соответственно, температура плавления тристеарата глицерина (71 oC) существенно больше, чем у триолеата (–17 oC).
Жиры практически не растворимы в воде, но при добавлении мыла или других поверхностно-активных веществ (эмульгаторов), они способны образовывать стойкие водные эмульсии. Жиры ограниченно растворимы в спирте и хорошо растворимы во многих неполярных и малополярных растворителях – эфире, бензоле, хлороформе, бензине.
- Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твердыми веществами с невысокой температурой плавления (исключение – рыбий жир). В твёрдых жирах преобладают остатки насыщенных кислот.
- Растительные жиры – масла (подсолнечное, соевое, хлопковое и др.) – жидкости (исключение – кокосовое масло, масло какао-бобов). Масла содержат в основном остатки ненасыщенных (непредельных) кислот.
Видео-опыт: "Определение непредельности жиров"
Особенно важны полиненасыщенные кислоты с несколькими двойными связями:
- линолевая CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH,
- линоленовая CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH,
- арахидоновая CH3(CH2)4CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOH
VI. Химические свойства жиров
1. Гидролиз, или омыление
Происходит под действием воды, с участием ферментов или кислотных катализаторов (обратимо) , при этом образуются спирт - глицерин и смесь карбоновых кислот:

или щелочей (необратимо). При щелочном гидролизе образуются соли высших жирных кислот, называемые мылами. Мыла получаются при гидролизе жиров в присутствии щелочей:
Мыла — это калиевые и натриевые соли высших карбоновых кислот.
2. Гидрирование жиров
Это превращение жидких растительных масел в твердые жиры – имеет большое значение для пищевых целей. Продукт гидрогенизации масел – твердый жир (искусственное сало, саломас). Маргарин – пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкого и др.), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др.).
Так в промышленности получают маргарин:

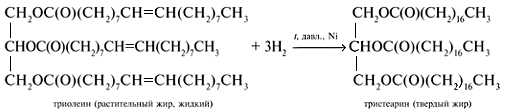
- Пищевая промышленность
- Фармацевтика
- Производство мыла и косметических изделий
- Производство смазочных материалов
Животные жиры и растительные масла, наряду с белками и углеводами – одна из главных составляющих нормального питания человека. Они являются основным источником энергии: 1 г жира при полном окислении (оно идет в клетках с участием кислорода) дает 9,5 ккал (около 40 кДж) энергии, что почти вдвое больше, чем можно получить из белков или углеводов. Кроме того, жировые запасы в организме практически не содержат воду, тогда как молекулы белков и углеводов всегда окружены молекулами воды. В результате один грамм жира дает почти в 6 раз больше энергии, чем один грамм животного крахмала – гликогена. Таким образом, жир по праву следует считать высококалорийным «топливом». В основном оно расходуется для поддержания нормальной температуры человеческого тела, а также на работу различных мышц, поэтому даже когда человек ничего не делает (например, спит), ему каждый час требуется на покрытие энергетических расходов около 350 кДж энергии, примерно такую мощность имеет электрическая 100-ваттная лампочка.
Известно, что значительную долю потребляемого жира должны составлять растительные масла, которые содержат очень важные для организма соединения – полиненасыщенные жирные кислоты с несколькими двойными связями. Эти кислоты получили название «незаменимых». Как и витамины, они должны поступать в организм в готовом виде. Из них наибольшей активностью обладает арахидоновая кислота (она синтезируется в организме из линолевой), наименьшей – линоленовая (в 10 раз ниже линолевой). По разным оценкам суточная потребность человека в линолевой кислоте составляет от 4 до 10 г. Больше всего линолевой кислоты (до 84%) в сафлоровом масле, выжимаемом из семян сафлора – однолетнего растения с ярко-оранжевыми цветками. Много этой кислоты также в подсолнечном и ореховом масле.
По мнению диетологов, в сбалансированном рационе должно быть 10% полиненасыщенных кислот, 60% мононенасыщенных (в основном это олеиновая кислота) и 30% насыщенных. Именно такое соотношение обеспечивается, если треть жиров человек получает в виде жидких растительных масел – в количестве 30–35 г в сутки. Эти масла входят также в состав маргарина, который содержит от 15 до 22% насыщенных жирных кислот, от 27 до 49% ненасыщенных и от 30 до 54% полиненасыщенных. Для сравнения: в сливочном масле содержится 45–50% насыщенных жирных кислот, 22–27% ненасыщенных и менее 1% полиненасыщенных. В этом отношении высококачественный маргарин полезнее сливочного масла.
Необходимо помнить
Насыщенные жирные кислоты отрицательно влияют на жировой обмен, работу печени и способствуют развитию атеросклероза. Ненасыщенные (особенно линолевая и арахидоновая кислоты) регулируют жировой обмен и участвуют в выведении холестерина из организма. Чем выше содержание ненасыщенных жирных кислот, тем ниже температура плавления жира. Калорийность твердых животных и жидких растительных жиров примерно одинакова, однако физиологическая ценность растительных жиров намного выше. Более ценными качествами обладает жир молока. Он содержит одну треть ненасыщенных жирных кислот и, сохраняясь в виде эмульсии, легко усваивается организмом. Несмотря на эти положительные качества, нельзя употреблять только молочный жир, так как никакой жир не содержит идеального состава жирных кислот. Лучше всего употреблять жиры как животного, так и растительного происхождения. Соотношение их должно быть 1:2,3 (70% животного и 30% растительного) для молодых людей и лиц среднего возраста. В рационе питания пожилых людей должны преобладать растительные жиры.
Жиры не только участвуют в обменных процессах, но и откладываются про запас (преимущественно в брюшной стенке и вокруг почек). Запасы жира обеспечивают обменные процессы, сохраняя для жизни белки. Этот жир обеспечивает энергию при физической нагрузке, если с пищей жира поступило мало, а также при тяжелых заболеваниях, когда из-за пониженного аппетита его недостаточно поступает с пищей.
Обильное потребление с пищей жира вредно для здоровья: он в большом количестве откладывается про запас, что увеличивает массу тела, приводя порой к обезображиванию фигуры. Увеличивается его концентрация в крови, что, как фактор риска, способствует развитию атеросклероза, ишемической болезни сердца, гипертонической болезни и др.
ЖИРЫ
1. Важнейшими представителями природных сложных эфиров являются жиры.



2.Классификация жиров:
1) твердые – это жиры, в состав которых входят предельные карбоновые кислоты. Это жиры животного происхождения (говяжий, свиной, бараний и т.д.), исключение составляет рыбий жир;
2) жидкие – это жиры, в состав которых входят непредельные карбоновые кислоты. Это жиры растительного происхождения, или масла (подсолнечное масло, соевое масло, рапсовое масло и т.д.), исключение составляет пальмовое масло.
3.. Химические свойства жиров:
А). Жиры нерастворимы в воде, но хорошо растворимы в органических растворителях – бензоле, гексане;
Б). Гидрированием жидких жиров получают твердые сложные эфиры. Именно эта реакция лежит в основе получения из растительного масла твердого жира – маргарин.

В). Жиры подвергаются гидролизу.

Г). Если проводить гидролиз жиров в щелочной среде, то произойдет омыление жиров.

4. Что такое мыла?
Запись в тетрадь.
Мыла – натриевые или калиевые соли высших карбоновых кислот. Натриевые соли высших карбоновых кислот имеют твердое агрегатное состояние, а калиевые – жидкое (жидкое мыло).
При изготовлении мыла в него добавляют душистые вещества, глицерин, красители, антисептики, растительные экстракты.
Исходным сырьем для получения мыла служат растительные масла (подсолнечное, хлопковое и др.), животные жиры, а также гидроксид натрия или кальцинированная сода. Растительные масла предварительно подвергаются гидрогенизации, т. е. их превращают в твердые жиры. Применяются также заменители жиров — синтетические карбоновые жирные кислоты с большей молекулярной массой.»
Почему мыло теряет свою моющую способность в жесткой воде?
(Если мы используем для мытья и стирки жесткую воду, а такая вода содержит ионы Са 2+ и Mg2+,то мыло теряет свою моющую способность.)
Как вы думаете почему?
(Это происходит в результате того, что кальциевые и магниевые соли высших карбоновых кислот нерастворимы в воде. Запишем уравнение реакции:
2С17Н35СООNa + СаСI2 = (C17 H35COO)2Ca ↓ + 2NaCI)
Почему после мытья волос твердым мылом в жесткой воде нужно прополоскать их раствором уксуса?
(Чтобы удалить нерастворимые соли кальция и жирных кислот.)
Как используя мыльный раствор отличить родниковую воду от снеговой? (В родниковой выпадет осадок).
. Тестирование
1 - В результате гидролиза жидкого жира образуются:
1) твердые жиры и глицерин; 3) глицерин и непредельные кислоты;
2) глицерин и предельные кислоты; 4) твердые жиры и смесь кислот.
2 - В каком веществе жиры не растворяются?
1) в бензоле; 3) в воде;
2) в бензине; 4) в хлороформе.
3 - Для превращения жидких жиров в твердые используют реакцию:
1) дегидрогенизации; 3) гидрогенизации;
2) гидратации; 4) дегидроциклизации.
4 - В результате гидрирования жидких жиров образуются:
1) твердые жиры и непредельные кислоты; 3) твердые жиры и глицерин;
2) твердые жиры и предельные кислоты; 4) твердые жиры.
Видео-опыт: "Определение непредельности жиров"
ГРУППА 405 БИОЛОГИЯ 48,49
ТЕМА:Сообщества и экосистемы.Биоценоз и биогеоценоз.Влияние человека на экосистемы
О том, что сообщества — не случайные образования — свидетельствует то, что в сходных по географическому положению и природным условиям районах возникают похожие сообщества.
Биотоп и биоценоз образуют биогеоценоз, в котором длительное время поддерживаются устойчивые взаимодействия между элементами живой и неживой природы.
![[BI9ZD_8-01]_[IL_02]-k.png](https://ykl-res.azureedge.net/1a321a43-64bb-4a5a-9b52-ee2fa7e701f4/%5BBI9ZD_8-01%5D_%5BIL_02%5D-k.png)
- Микроэкосистема.
- Мезоэкосистема
= биогеоценоз.
- Макроэкосистема — биом, или природная зона.
Влияние деятельности человека на экосистему
Природа является напарником человека. Но не всегда отношения человечества и природы взаимовыгодны – чаще всего человек берет все, не отдавая ничего взамен. Люди являются немаловажным природным звеном, поэтому их деятельность заметно сказывается на различных экосистемах.
ВЛИЯНИЕ ЧЕЛОВЕКА НА ПРИРОДНЫЕ ЭКОСИСТЕМЫ
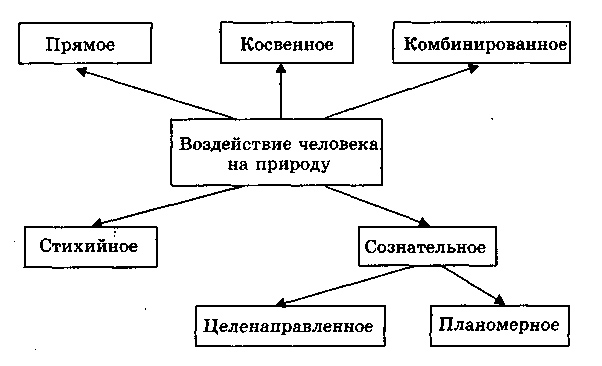
Значительное влияние на природные экосистемы оказывает в основном целенаправленная или прямая деятельность человека.
Автомобили, без которых мы не можем представить повседневную жизнь, оставляют большой отпечаток на концентрации химических элементов в воздухе, почве, на растительности и животных. Элементами, изменяющими жизнь экосистем, являются цинк и свинец.
При разработке новых месторождений необходимых элементов человек меняет формы и состав ландшафтов. Такое воздействие приводит к переходу токсичных тяжелых металлов из минеральной формы в водные растворы. При этом количество этих элементов не меняется, но повышается риск попадания таких вод в растительный и животный миры.
Деятельность современного человека связана с химическими и техногенными соединениями, не имеющим аналогов в природе. При этом большинство их этих веществ не перерабатывается, поэтому происходит огромный выброс фреона, оружейного плутония, цезия и пестицидов в природу.
Влияние человека на природные экосистемы имеет и положительные стороны.
Для сохранения редких видов растений и животных создаются природные заповедники. Такие территории создаются человеком как в условиях дикой природы, так и в искусственно созданных объектах: зоологических и ботанических садах, парках и заповедниках.
Для хозяйственных целей людьми создаются новые виды растений и животных. Такая деятельность способствует увеличению и сохранению природных популяций природного мира.
Положительное влияние на природные экосистемы оказывает высадка новых лесов и озеленение городов. Искусственные озера, водохранилища также благоприятны для появления новых природных экосистем.
Сегодня люди пытаются найти замену природным ископаемым. Причиной этому служит нехватка ресурсов для современного быстроразвивающегося общества. Человек начал добывать энергию от ветра, солнца и воды.
ПОСЛЕДСТВИЯ ДЕЯТЕЛЬНОСТИ ЧЕЛОВЕКА В ЭКОСИСТЕМАХ
Из-за сжигания топлива загрязнена атмосфера. Промышленные предприятия выделяют огромное количество вредных газов, оседающих на почве во время осадков.
Загрязнение морей и океанов также остается одной из основных проблем современного общества. Нефтяные пятна, нитраты и фосфаты, выбрасываемые в воды, разрушают большинство экосистем.
Многие производства продолжают выбрасывать на земную поверхность радиоактивные и ядовитые вещества, отрицательно сказывающиеся как на природе, так и на человеке.
Благодаря использованию очистительных фильтров, в атмосферу, воду и почву стало выбрасываться меньше вредных веществ и газов. А использование экологически безопасных и природных источников энергии - воды, солнца и ветра, - привело к сохранению и накоплению природных ресурсов.
Созданные человеком заповедники, парки и сады, благоприятно сказались на увеличении популяций редких и вымирающих видов животного мира и всех экосистем.
Люди устраивают субботники, природные акции, дни без автомобилей и часы без света. Каждый человек, участвующий в подобных акциях вносит свой незаменимый вклад в восстановление природных экосистем.
ГРУППА 401 ХИМИЯ 53
ТЕМА Обратимые и необратимые химические реакции. Химическое равновесие и способы его смещения
ПОНЯТИЕ ПРЯМОЙ И ОБРАТНОЙ РЕАКЦИИ
Рассмотрим некоторую абстрактную реакцию, которую запишем в виде:
А+В→АВ, Прямая реакция. Но многие химические реакции могут идти в обратную сторону.
АВ ![]() А+В; Обратная реакция.
А+В; Обратная реакция.
Для краткости такую реакцию записывают, используя две стрелки, одну – вперед, другую – назад.
А+В![]() АВ
АВ
При повышении температуры скорость большинства химических реакций увеличивается. Но оказывается, что в случае некоторых реакций продукт реакции при температуре, когда она идет с хорошей скоростью, уже начинает разлагаться. В частности, такая ситуация реализуется при взаимодействии водорода с йодом при получении йодоводорода.
Н2 + I2![]() (1)
(1)
Скорость химической реакции увеличивается с увеличением концентрации исходных веществ и соответственно уменьшается с уменьшением концентрации исходных веществ. Получается, что, по мере прохождения реакций, скорость прямой реакции будет уменьшаться, т. к. исходные вещества будут расходоваться. А скорость обратной реакции будет возрастать, потому что концентрация вещества АВ исходного для обратной реакции будет постепенно увеличиваться. До каких пор скорость прямой реакции будет уменьшаться, а обратной увеличиваться? Это будет до того момента, когда скорости прямой и обратной реакции станут равными. Наступит химическое равновесие. Рис. 1.

Рис. 1
Химическое равновесие – это состояние реакционной системы, в котором скорости прямой и обратной реакции равны.
КОНСТАНТА РАВНОВЕСИЯ
Равновесная концентрация веществ
Равновесная концентрация веществ – это концентрации веществ в реакционной смеси, находящихся в состоянии химического равновесия. Равновесная концентрация обозначается химической формулой вещества, заключенной в квадратные скобки.
Например, следующая запись![]() обозначает, что равновесная концентрация водорода в равновесной системе составляет 1 моль/л.
обозначает, что равновесная концентрация водорода в равновесной системе составляет 1 моль/л.

Рис. 2
Химическое равновесие (Рис. 2) отличается от привычного для нас понятия «равновесие». Химическое равновесие – динамическое. В системе, находящейся в состоянии химического равновесия, происходят и прямая, и обратная реакции, но их скорости равны, и поэтому концентрации участвующих веществ не меняются. Химическое равновесие характеризуется константой равновесия, равной отношению констант скоростей прямой и обратной реакций.
![]()
Константы скорости прямой и обратной реакции – это скорости данной реакции при концентрациях исходных для каждой из них веществ в равных единицах. Также константа равновесия равна отношению равновесных концентраций продуктов прямой реакции в степенях стехиометрических коэффициентов к произведению равновесных концентраций реагентов.
![]()
Если ![]() , то в системе больше исходных веществ. Если
, то в системе больше исходных веществ. Если ![]() , то в системе больше продуктов реакции.
, то в системе больше продуктов реакции.
ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ
Если константа равновесия значительно больше 1, такую реакцию называют необратимой.
Необратимыми называются химические реакции, которые происходят только в одном направлении до полного расходования одного из реагентов.
Например, это реакция:
4Р+5О2 =2Р2О5 (2)
Обратимыми называются химические реакции, которые осуществляются во взаимно противоположных направлениях при одних и тех же условиях.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА СМЕЩЕНИЕ РАВНОВЕСИЯ
Если изменить внешние условия, то состояние химического равновесия нарушится. Смещение равновесия в зависимости от изменения внешних условий в общем виде определяется
· Принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывают воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то оно смещается в направлении того процесса, протекание которого ослабляет эффект произведённого воздействия.
Так, повышение температуры вызывает смещение равновесия в направлении того из процессов, течение которого сопровождается поглощением тепла, а понижение температуры действует в противоположном направлении.
Равновесие смещается вправо, если повысились равновесные концентрации продуктов прямой реакции. Если повышаются равновесные концентрации исходных веществ прямой реакции, то равновесие смещается влево. Какие факторы можно изменять, чтобы сместить равновесие? Это
· Температура
· Давление
· Концентрации веществ
· Добавление катализатора
· Изменение площади реакционной поверхности гетерогенных реакций
Добавление катализатора и изменение площади реакционной поверхности гетерогенных реакций не оказывают влияние на смещение химического равновесия.

Остальные факторы рассматриваем более детально.
Температура
Реакция синтеза аммиака (Рис. 3)
относится к экзотермическим реакциям. При прохождении прямой реакции теплота выделяется, а при прохождении обратной – поглощается. Если увеличить температуру, то, согласно правилу Ле Шателье, равновесие сместится в таком направлении, чтобы уменьшить это воздействие. В данном случае влево, так как теплота поглощается. Реакция синтеза аммиака проводится при температуре около 500![]()
Если реакция эндотермическая, то повышение температуры приведет к смещению равновесия вправо.
Изменение концентрации веществ
При увеличении концентрации какого-либо из веществ, участвующих в равновесной реакции, равновесие реакции сместится в сторону его расходования, а соответственно, при уменьшении концентрации какого-либо из веществ – в сторону реакции его образования. Например, при увеличении концентрации азота в реакции синтеза аммиака, равновесие сместится вправо, т. е. в сторону расходования азота. Если же в этой реакции удалять из реакционной смеси аммиак, то равновесие сместится в сторону его образования. Сделать это можно, например, при растворении аммиака в воде.
Изменение давления
Изменение давления может оказывать влияние только на реакции с участием газообразных веществ. Если в реакции синтеза аммиака увеличить давление, равновесие сместится в сторону уменьшения числа моль газа. Если слева число моль газа больше, чем справа, равновесие сместится в сторону образования аммиака.
Если число моль газа одинаково и слева и справа, например, в реакции получения оксида азота (II),
N2 +O2![]() (3)
(3)
то изменение давления не будет оказывать влияние на положение химического равновесия в таких реакциях. Изучение химического равновесия имеет большое значение, как для теоретических исследований, так и для решения практических задач. Определяя положение равновесия для различных температур и давлений, можно выбрать наиболее благоприятные условия проведения химического процесса. Окончательный выбор условий требует учета влияния их и на скорость процесса.
Подведение итога урока
На уроке была изучена тема «Химическое равновесие», рассмотрены условия смещения равновесия в случае обратимых реакций.
ГРУППА 406 ХИМИЯ 47,48,49
ТЕМА: Экзотермические и эндотермические реакции. Тепловой эффект химических реакций. Термохимические уравнения.
Окислительно-восстановительные реакции. Степень окисления. Окислитель и восстановление. Восстановитель и окисление. Метод электронного баланса для составления уравнений окислительно-восстановительных реакций.
Скорость химических реакций. Понятие о скорости химических реакций. Зависимость скорости химических реакций от различных факторов: природы реагирующих веществ, их концентрации, температуры, поверхности соприкосновения и использования катализаторов.
ГРУППА 305 ХИМИЯ 19
ТЕМА:Химические свойства алканов (метана, этана): горение, замещение, разложение, дегидрирование










