Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com Тетрадь привезете, когда перейдем на очную форму обучения.)
Моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
СПРАВА НАХОДИТСЯ АРХИВ- ТАМ СМОТРИМ ДАТУ И ГРУППЫ
РАСПИСАНИЕ ЗАНЯТИЙ НА НЕДЕЛЮ: 24.04.23г. -28.04.23г.
Пн. 24.04: -,506,-,403
Вт. 25.04:403,403,505,-
Ср. 26 .04: 506,-,-, 508
Чт. 27.04: -,-,505, 508
Пт. 28.04: -,-,-,-
ГРУППА 506 ХИМИЯ 31,32
ТЕМА: Электролиты.
Согласно теории электролитической диссоциации С. Аррениуса и Д. И. Менделеева можно сформулировать основные положения теории электролитической диссоциации (ТЭД):
- При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
- Электролитическая диссоциация - процесс обратимый (обратная реакция называется ассоциацией).
Степень электролитической диссоциации
Основываясь на теории электролитической диссоциации можно дать определения важнейшим классам неорганических соединений
| Название | Определение | Уравнение диссоциации |
| Оксиды | Неэлектролиты, состоят из атомов элемента и кислорода | Не диссоциируют в водных растворах |
| Кислоты | Электролиты, при диссоциации образуют катионы водорода | |
| Основания | Электролиты, при диссоциации образуют гидроксид-анионы.Растворимые в воде основания называют щелочами | |
| Соли | Электролиты, при диссоциации образуют катионы металла и анионы кислотного остатка | |
ТЕМА:Степень электролитической диссоциации.
Механизмы электролитической диссоциации для веществ с различными типами химической связи. Гидратированные и негидратированные ионы.Степень электролитической диссоциации.
еорию электролитической диссоциации предложил шведский ученый С. Аррениус в 1887 году.
Электролитическая диссоциация – это распад молекул электролита с образованием в растворе положительно заряженных (катионов) и отрицательно заряженных (анионов) ионов.
Например, уксусная кислота диссоциирует так в водном растворе:
CH3COOH⇄H++CH3COO-.
Диссоциация относиться к обратимым процессам. Но различные электролиты диссоциируют по-разному. Степень зависит от природы электролита, его концентрации, природы растворителя, внешних условий (температуры, давления).
Степень диссоциации α – отношение числа молекул, распавшихся на ионы, к общему числу молекул:
α=v´(x)/v(x).
Степень может варьироваться от 0 до 1 (от отсутствия диссоциации до ее полного завершения). Обозначается в процентах. Определяется экспериментальным путем. При диссоциации электролита происходит увеличение числа частиц в растворе. Степень диссоциации показывает силу электролита.
Различают сильные и слабые электролиты.
Сильные электролиты – это те электролиты, степень диссоциации которой превышает 30%.
Электролиты средней силы – это те, степень диссоциации которой делит в пределах от 3% до 30%.
Слабые электролиты – степень диссоциации в водном 0,1 М растворе меньше 3%.
Примеры слабых и сильных электролитов.
Сильные электролиты | Слабые электролиты |
Практически все соли и кислоты: HBr, KOH, NaOH, Ca(OH)2, HNO3, HClO4. | Большинство кислот и оснований: H2S. H2CO3. Al(OH)3, NH4OH. |
Сильные электролиты в разбавленных растворах нацело распадаются на ионы, т.е. α = 1. Но эксперименты показывают, что диссоциация не может быть равна 1, она имеет приближенное значение, но не равна 1. Это не истинная диссоциация, а кажущаяся.
Например, пусть у некоторого соединения α = 0,7. Т.е. по теории Аррениуса в растворе «плавает» 30% непродиссоцииовавших молекул. А 70% образовали свободные ионы. А электролстатическая теория дает другое определение этому понятию: если α = 0,7, то все молекулы диссоциированы на ионы, но ионы свободны лишь на 70%, а оставшиеся 30% - связаны электростатическими взаимодействиями.
ЕМА:Практическая работа №1
Приготовление раствора заданной концентрации.
Практическая работа №1.
ТЕМА:Приготовление раствора заданной концентрации.
Цель: - научиться практически готовить растворы с заданной
массовой долей растворённого вещества.
Задачи: - повторить и использовать правила ТБ
-повторить и практически применить знания о растворах
и массовой доле растворённого вещества,
- познакомиться с устройством лабораторных весов и
правилами
взвешивания,
-формировать коммуникативные компетентности.
Оборудование и реактивы:
Весы лабораторные, химические стаканы (V = 50мл),
стеклянные палочки, мензурки (V =50мл), дистиллированная вода, поваренная соль.
Ход работы.
Приготовление растворов солей с определённой массовой
долей растворённого вещества.
Теоретическая часть (закрепление знаний формул для расчетов массовой доли вещества, умение решения задач разных типов)
1.Приготовить 20 г.водного раствора соли массовой долей соли 5%.
2.Какую массу щелочи необходимо взять для приготовления 50 г 16%-ного раствора?
3. К 600 г 50% р-ра соли добавили 100 г воды. Чему равна массовая доля соли в полученном растворе?
Ход работы (Практическая часть)
Практическую часть начнём с проверки знаний правил ТБ, которые важно помнить при выполнении работы.
1) Нельзя пробовать вещества на вкус.
2) Нельзя брать вещества руками.
3) Если взяли реактива больше, чем требуется, нельзя высыпать ( выливать) обратно в банку (склянку).
4) Нюхать вещества с осторожностью.
5) Работать аккуратно и внимательно , соблюдая порядок и дисциплину.
6) По окончанию работы привести в порядок рабочее место и вымыть руки с мылом.
Приготовление раствора с определенной массовой долей растворенного вещества. Приготовить раствор хлорида натрия массой
m(NaCl) = 300 · 0,12 = 36 (г);
m(H2O) = 300 - 36 = 264 (г), что соответствует объему 264 мл воды.
В колбу или стакан на 500-700 мл поместим предварительно взвешенную навеску соли массой
Вывод
- Что такое массовая доля растворённого вещества?
- Что говорит о растворе его массовая доля?
ГРУППА 403 ХИМИЯ 26,27
ТЕМА: Практическая работа №3
Решение экспериментальных задач на идентификацию органических соединений.
Практическая работа №3
Решение экспериментальных задач на идентификацию органических соединений.Распознавание пластмасс и волокон
Практическая работа №3
Решение экспериментальных задач на идентификацию органических соединений.
Распознавание пластмасс и волокон.
Цель работы: повторить основные качественные реакции органических веществ, научиться решать экспериментальные задачи на распознавание органических веществ.
Реактивы и оборудование: раствор KMnO4(розовый), Аммиачный раствор оксида серебра – реактив Толленса[Ag(NH3)2]OH (упрощённо +Ag2O NH3 раствор→), раствор FeCl3(светло-жёлтый), свежеосаждённый гидроксид меди (II) в сильнощелочной среде, лакмус, фенолфталеин, насыщенный раствор соли кальция.
Литература: Г.Е.Рудзитис, Ф.Г.Фельдман, химия 10 класс, стр.149
С правилами по технике безопасности ознакомлен:______________________(подпись)
Ход работы:
Оформить работу в виде отчетной таблицы.
Отчетная таблица
Что делали | Что наблюдали | Уравнения реакций | Выводы |
|
|
|
|
|
|
|
1.Распознавание уксусной кислоты (уксусная кислота –одна из самых древних кислот ,которую удалось выделить и использовать человечеству. В организме человека за сутки образуется до 400 грамм этой кислоты)
СuSО4 + 2NаОН → | Сu(ОН)2 ↓ | + Nа2SО4 |
голубой осадок |
2СН3 – СООН + Сu(ОН)2 → (СН3 – СОО)2Сu + Н2О
Получить свежеосажденный гидроксид меди. Прилить к нему 1 – 2 мл этанола. Голубой осадок растворяется, образуя раствор такого же цвета.
2. Распознавание глюкозы
СuSО4 + 2NаОН → | Сu(ОН)2 ↓ | + Nа2SО4 |
голубой осадок |
СН2ОН – (СНОН)4 – СНО + 2Сu(ОН)2 ![]() СН2ОН – (СНОН)4 – СООН + Сu2О↓ +2Н2О
СН2ОН – (СНОН)4 – СООН + Сu2О↓ +2Н2О
К 1 – 2 мл глюкозы прилить свежеосажденный гидроксид меди. Сначала осадок растворяется, затем при нагревании раствор приобретает окраску от красной до желто – оранжевой. Это свидетельствует о наличии в исследуемой жидкости глюкозы.
3. Распознавание глицерина(глицерин входит в состав мазей, в пищевой промышленности глицерин под кодом Е-422).
2СН2ОН – СНОН – СН2ОН + Сu(ОН)2 → глицерат меди (II) + 2Н2О
К 2 мл глицерина прилить свежеосажденный гидроксид меди. Раствор окрашивается в ярко – синий цвет в результате образования комплексного соединения глицерата меди (II).
4. Распознавание сахарозы. Сахар-сложное орган.в-во, содержащее много С. Чтобы доказать возьмем немного сахара и добавим к нему серную кислоту. Она забирает воду, получается свободный углерод(черное в-во) С12Н22О11-----серн.к-та------------12С+11Н2О
5.Распознавание крахмала. Капнем р-ром иода на картофель и белый хлеб. Если образуется синее пятно, то они содержат крахмал.
6. Определение кислотности р-ров глицерина и мыла с помощью имеющихся индикаторов.
(лакмус, фенолфталеин,метилоранж). Глицерин имеет слабокислую среду, а мыло-щелочную.
Общий вывод(на основе цели)!
(((
1. Распознавание уксусной кислоты (уксусная кислота – одна из самых древних кислот, которую удалось выделить и использовать человечеству. В организме человека за сутки образуется до 400 грамм этой кислоты) СuSО4 + 2NаОН →Сu(ОН)2 ↓+ Nа2SО4
2СН3 – СООН + Сu(ОН)2 → (СН3 – СОО)2Сu + Н2О
Получить свежеосажденный гидроксид меди. Прилить к нему 1 – 2 мл этанола. Голубой осадок растворяется, образуя раствор такого же цвета.
2. Распознавание глюкозы
СuSО4 + 2NаОН → Сu(ОН)2 ↓ + Nа2SО4
СН2ОН – (СНОН)4 – СНО + 2Сu(ОН)2 СН2ОН – (СНОН)4 – СООН + Сu2О↓ +2Н2О
К 1 – 2 мл глюкозы прилить свежеосажденный гидроксид меди. Сначала осадок растворяется, затем при нагревании раствор приобретает окраску от красной до желто – оранжевой. Это свидетельствует о наличии в исследуемой жидкости глюкозы.
3. Распознавание глицерина (глицерин входит в состав мазей, в пищевой промышленности глицерин под кодом Е-422).
2СН2ОН – СНОН – СН2ОН + Сu(ОН)2 → глицерат меди (II) + 2Н2О
К 2 мл глицерина прилить свежеосажденный гидроксид меди. Раствор окрашивается в ярко – синий цвет в результате образования комплексного соединения глицерата меди (II).
4. Распознавание сахарозы. Сахар-сложное орган. в-во, содержащее много С. Чтобы доказать возьмем немного сахара и добавим к нему серную кислоту. Она забирает воду, получается свободный углерод (черное в-во) С12Н22О11---серн.к-та--12С+11Н2О
5. Распознавание крахмала. Капнем р-ром иода на картофель и белый хлеб. Если образуется синее пятно, то они содержат крахмал.
6. Определение кислотности р-ров глицерина и мыла с помощью имеющихся индикаторов.
(лакмус, фенолфталеин,метилоранж). Глицерин имеет слабокислую среду, а мыло-щелочную.)))_
ТЕМА:
.Практическая работа . Распознавание пластмасс и волокон.
Тема: «Распознавание пластмасс и волокон»
Оборудование и реактивы: образцы пластмасс и волокон под номерами, спиртовка, спички, стеклянные палочки, тигельные щипцы, асбестовые сетки.
Распознавание пластмасс
В разных пакетах под номерами имеются образцы пластмасс. Пользуясь при веденными ниже данными, определите, под каким номером какая пластмасса находится.
Полиэтилен. Полупрозрачный, эластичный, жирный на ощупь материал. При нагревании размягчается, из расплава можно вытянуть нити. Горит синеватым пламенем, распространяя запах расплавленного парафина, продолжает гореть вне пламени.
Поливинилхлорид. Эластичный или жесткий материал, при нагревании быстро размягчается, разлагается с выделением хлороводорода. Горит коптящим пламенем, вне пламени не горит.
Полистирол. Может быть прозрачным и непрозрачным, часто хрупок. При нагревании размягчается, из расплава легко вытянуть нити. Горит коптящим пламенем, распространяя запах стирола, продолжает гореть вне пламени.
Полиметилметакрилат. Обычно прозрачен, может иметь различную окраску. При нагревании размягчается, нити не вытягиваются. Горит желтоватым пламенем с синей каймой и характерным потрескиванием, распространяя эфирный запах.
Фенолформальдегидная пластмасса. Темных тонов (от коричневого до черного). При нагревании разлагается. Загорается с трудом, распространяя запах фенола, вне пламени постепенно гаснет.
Распознавание волокон
В разных пакетах под номерами содержатся образцы волокон. Пользуясь приведенными ниже данными, определите, под каким номером какое волокно находится.
Хлопок. Горит быстро, распространяя запах жженой бумаги, после сгорания остается серый пепел.
Шерсть, натуральный шелк. Горит медленно, с запахом жженых перьев, после сгорания образуется черный шарик, при растирании превращающийся в порошок.
Ацетатное волокно. Горит быстро, образуя нехрупкий, спекшийся шарик темно-бурого цвета. В отличие от других волокон растворяется в ацетоне.
Капрон. При нагревании размягчается, затем плавится, из расплава можно вытянуть нити. Горит, распространяя неприятный запах.
Лавсан. При нагревании плавится, из расплава можно вытянуть нити. Горит коптящим пламенем с образованием темного блестящего шарика.
Краткие теоретические и учебно-методические материалы
по теме практического занятия
Полимерами называют вещества, молекулы которых состоят из множества повторяющихся структурных звеньев, соединенных между собой химическими связями. Существует два основных способа получения полимеров — реакции полимеризации и реакции поликонденсации.
Реакция полимеризации — это химический процесс соединения множества исходных молекул низкомолекулярного вещества (мономера) в крупные молекулы (макромолекулы ) полимера.
В реакцию полимеризации могут вступать соединения, содержащие кратные связи, то есть непредельные соединения. Это могут быть молекулы одного мономера или разных мономеров.
В первом случае происходит реакция гомополимеризации — соединение молекул одного мономера, во втором — реакция сополимеризации — соединение молекул двух и более исходных веществ.
К реакциям гомополимеризации относятся реакции получения полиэтилена, полипропилена, поливинилхлорида и т. д., например:
Выражение в скобках называют структурным звеном, а число n-в формуле полимера — степенью полимеризации.
К реакциям сополимеризации относится, например, реакция получения бутадиен-стирольного каучука.
Реакция поликонденсации — это химический процесс соединения исходных молекул мономера в макромолекулы полимера, идущий с образованием побочного низкомолекулярного продукта (чаще всего воды).
В реакции поликонденсации вступают молекулы мономеров с функциональными группами.
Например, реакция получения фенолформальдегидных смол: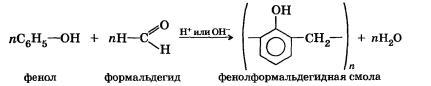
С помощью реакций поликонденсации получают полиэфиры, полиамиды, полиуретаны, полиакрил и т. д.
Пластмассы.
Пластмассами называют материалы, изготовляемые на основе полимеров. Пластмассы сочетают в себе разнообразные ценные качества, такие как лёгкость, прочность, химическая
стойкость и др., которые обусловили проникновение их в различные отрасли народного хозяйства. Кроме полимеров (их часто называют смолой) в пластмассах почти всегда содержатся другие компоненты, придающие материалу определённые качества. Полимерное вещество является для них связующим.
В пластмассы входят наполнители (древесная мука, ткань, асбест, стекловата и др.), которые улучшают их механические свойства.
Пластификаторы – повышают эластичность, устраняют хрупкость.
Стабилизаторы – способствуют сохранению свойств пластмасс в процессе их переработки и использования; красители придают необходимую окраску.
Обычные способы получения полимеров – это реакции полимеризации, лежащие в основе получения термопластичных пластмасс, и реакции поликонденсации, лежащие в основе получения термореактивных пластмасс.
Термопластичные полимеры при нагревании размягчаются и в этом состоянии легко изменяют форму, которую сохраняют при охлаждении. При следующем нагревании они снова размягчаются и могут принимать новую форму.
Термореактивные полимеры при нагревании сначала становятся пластичными, при дальнейшем нагревании утрачивают пластичность, становятся неплавкими. Повторно переработать такой полимер в новое изделие невозможно.
Наиболее типичными способами получения изделий из термопластичных пластмасс является литьё под давлением и экструзия (выдавливание), а из термореактивных пластмасс – горячее прессование.
Краткая характеристика некоторых пластмасс
Полиэтилен – твёрдый, жирный на ощупь, белого цвета термопластичный полимер. Стоек по отношению к агрессивным средам. Благодаря высокой температуре плавления, обладает существенными преимуществами перед другими материалами (полиэтиленом, полиметилметакрилатом, поливинилхлоридом), близким по свойствам.
Полипропилен идёт на изготовление высокопрочной изоляции, труб, деталей машин, химической аппаратуры. Благодаря высокой механической прочности, его используют для изготовления канатов, сетей, технических тканей.
Поливинилхлорид – обладает большой химической стойкостью, хорошими электроизоляционными свойствами и большой механической прочностью. Термопластичный полимер, на его основе изготавливают два вида пластмасс: винипласт, обладающий значительной жесткостью и пластикат – более мягкий материал.
Винипласт идёт на изготовление химически стойкой аппаратуры, ванн для никелирования, жестких плёнок. Пластикат используется для изоляции, для производства предметов широкого потребления (плащей, сумок, линолеума, клеенок, для получения материалов, заменяющих кожу – в производстве обуви).
Полиметилметакрилат – за свою прозрачность называется органическим стеклом. Обладает удовлетворительной прочностью и значительно меньшей хрупкостью, чем обычное силикатное стекло, способностью пропускать ультрафиолетовые лучи. Термопластичный полимер, находит применение в строительстве, в часовом деле, различных отраслях промышленности и в быту.
Фенолформальдегидная смола – обычно используется в смеси с наполнителями, красителями и т.п., а затем уже производят формование изделий способом горячего прессования. Термореактивный полимер. Введение различных наполнителей позволяет получить материалы, имеющие ценные свойства. Так текстолит и стеклотекстолит, армированные текстильными тканями и стеклотканью, по прочности близки к дюралюминию и стали.
Текстолит – хлопчатобумажная ткань, пропитанная фенолформальдегидной смолой и спрессованная при повышенной температуре. Устойчив к нагрузкам. Легко поддаётся механической обработке. Применяется для изготовления шарикоподшипников, шестерёнки для машин, предусмотренных для больших нагрузках.
Таблица 1 « Распознавание пластмасс»
Название пластмассы | Отношение к нагреванию | Характер горения |
Полиэтилен | Размягчается – можно вытянуть нить. | Горит синеватым пламенем, распространяя слабый запах горящего парафина. При горении отделяются капли. Вне пламени продолжает гореть. |
Поливинилхлорид (полихлорвинил) | Размягчается при 60-70˚С, выше 110-120˚С разлагается. | Горит коптящим пламенем. Вне пламени не горит. |
Полистирол | Размягчается – легко вытягиваются нити. | Горит коптящим пламенем, распространяя специфический запах. Вне пламени продолжает гореть. |
Полиметилметакрилат (орг. стекло) | Размягчается. | Горит жёлтым пламенем, с синей каймой у краев, с характерным потрескиванием, распространяя резкий запах. |
Целлулоид | Разлагается. | Горит очень быстро, оставляя следы золы. |
Фенолформальдегидные пластмасы | Разлагается при сильном нагревании | Загорается с трудом, при горении обугливается, распространяя резкий запах фенола. Вне пламени постепенно гаснет, не размягчается. |
Волокна
– природные или искусственные высокомолекулярные вещества, отличающиеся от других полимеров более высокой степенью упорядоченности молекул и, как следствие, особыми физическими свойствами, позволяющими использовать их для получения нитей. Волокна делят на натуральные (природные) и химические. Натуральные волокна могут быть растительного или животного происхождения. Химические волокна в свою очередь подразделяют на искусственные и синтетические.
Природные волокна:
Волокно растительного происхождения – хлопок, лен.
Хлопковое волокно получают из субтропического растения – хлопчатника. Хлопковое волокно легкое, достаточно прочное, мягкое, гигроскопичное.
Волокна животного происхождения – шерсть и шелк.
Шелк вырабатывают многочисленные гусеницы и пауки.
Шерсть – волокна волосяного покрова овец, коз, верблюдов и других животных.
Искусственные волокна:
Наибольшее значение среди искусственных волокон занимают ацетатное и вискозное волокна, получаемые из древесной целлюлозы.
Синтетические волокна:
из синтетических волокон наибольший интерес представляют полиамидное волокно – полиамид – 6 (капрон) и полиэфирное – полиэтиленгликольтерефталат (лавсан).
Капрон получают из капролактала, который под воздействием воды размыкает цикл, образуя ε – капроновую кислоту. Из этой кислоты в результате поликонденсации образуется полимер линейной структуры:
n H2N – (CH2)5 – COOH → [- NH – (CH2)5 – CO -]n + (n-1)H2O
Лавсан (полиэтилентерефталат) - представитель полиэфиров:

Получают реакцией поликонденсации терефталевой кислоты и этиленгликоля:
HOOC-C6H4-COOH + HO-CH2CH2-OH + HOOC-C6H4-COOH + … →
→ HOOC-C6H4-CO – O-CH2CH2-O – OC-C6H4-CO – … + nH2O
полимер-смола
В общем виде:
n HOOC-C6H4-COOH + n HO-CH2CH2-OH →
→ HO-(-CO-C6H4-CO-O-CH2CH2-O-)n-H + (n-1) H2O
Таблица 2. «Распознавание волокон»
Волокно | Сжигание |
Хлопок | Горит быстро с запахом жжёной бумаги. После горения остается серый пепел. |
Шерсть | Горит медленно с запахом жжёных перьев. После горения образуется хрупкий чёрный шарик, растирающийся в порошок. |
Ацетатное волокно | Горит быстро, образуя нехрупкий спёкшийся тёмно-бурый шарик. Вне пламени горение постепенно прекращается. |
Капрон | Плавится, образуя твёрдый блестящий шарик тёмного цвета. При горении распространяется неприятный запах. |
Лавсан | Плавится, затем горит коптящим пламенем с образованием тёмного твердого блестящего шарика. |
Нитрон | Горит, образуя тёмный рыхлый неблестящий шарик. |
Вопросы для закрепления теоретического материала к практическому занятию:
Дайте определения следующим понятиям: полимеры, структурное звено, степень полимеризации.
В чем разница между реакциями полимеризации и поликонденсации?
Какие полимеры называются термопластичными?
Какие полимеры называются термореактивными?
Дайте классификацию волокон.