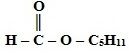28.10.22 г. Пятница. Гр. 408, 308,303,401
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 408 ХИМИЯ 21,22
Тема 21: |
Строение и свойства сложных эфиров, их применение
На данном уроке будет рассмотрена тема «Производные карбоновых кислот. Сложные эфиры». Благодаря этой теме, вы сможете познакомиться с производными карбоновых кислот. Также вы изучите самые важные функциональные производные карбоновых кислот – сложные эфиры. Рассмотрите их состав, некоторые свойства, формирование названий и сферы их применения в жизни.
I. Состав и строение сложных эфиров
Сложные эфиры – функциональные производные карбоновых кислот, в молекулах которых гидроксильная группа (-ОН) замещена на остаток спирта (-OR).
Сложные эфиры карбоновых кислот – соединения с общей формулой R–COOR', где R и R' – углеводородные радикалы.

II. Физические свойства и нахождение сложных эфиров в природе
- Летучие, бесцветные жидкости
- Плохо растворимы в воде
- Чаще с приятным запахом
- Легче воды
Сложные эфиры содержатся в цветах, фруктах, ягодах.
Они определяют их специфический запах.
Являются составной частью эфирных масел (известно около 3000 эф.м. – апельсиновое, лавандовое, розовое и т. д.)
Эфиры низших карбоновых кислот и низших одноатомных спиртов имеют приятный запах цветов, ягод и фруктов. Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
CH3(CH2)14–CO–O–(CH2)29CH3
Аромат. Структурная формула. | Название сложного эфира |
Яблоко  | Этиловый эфир 2-метилбутановой кислоты
|
Вишня  | Амиловый эфир муравьиной кислоты
|
Груша  | Изоамиловый эфир уксусной кислоты
|
Ананас  | Этиловый эфир масляной кислоты (этилбутират) |
Банан  | Изобутиловый эфир уксусной кислоты (у изоамилацетата так же напоминает запах банана) |
Жасмин  | Бензиловый эфир уксусной (бензилацетат)
|
Запахи эфиров:
Рис. 1.
Сложные эфиры нерастворимы в воде, но хорошо смешиваются со многими органическими веществами. Именно поэтому они используются как растворители для лаков и красок. Рис. 1. Этилацетат и метил ацетат – основа растворителя – жидкости для снятия лака с ногтей.
Температуры кипения сложных эфиров меньше, чем температуры кипения кислот и спиртов с близкой молярной массой. Почему? Сложные эфиры, в отличие от кислот и спиртов, не способны образовывать водородные связи между молекулами.
Сравнение температуры кипения эфиров
III. Номенклатура сложных эфиров
Краткие названия сложных эфиров строятся по названию радикала (R') в остатке спирта и названию группы RCOO- в остатке кислоты. Например, этиловый эфир уксусной кислоты CH3COOC2H5 называется этилацетат.
Названия по ИЮПАК выделены жирным шрифтом:
H–COO–C2H5 | CH3–COO–CH3–CH3 | CH2CH2–COO–C2H5 |
Этилформиат, этилметаноат; этиловый эфир муравьиной кислоты | Метилацетат, метилэтаноат; метиловый эфир уксусной кислоты | Этилбутират, этилбутаноат; этиловый эфир бутановой кислоты |

IV. Применение
- В качестве отдушек и усилителей запаха в пищевой и парфюмерной (изготовление мыла, духов, кремов) промышленности;
- В производстве пластмасс, резины в качестве пластификаторов.
Пластификаторы – вещества, которые вводят в состав полимерных материалов для придания (или повышения) эластичности и (или) пластичности при переработке и эксплуатации.
Применение в медицине
В конце XIX — начале ХХ века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
V. Получение сложных эфиров
Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.

Видео-опыт: «Получение уксусноэтилового эфира»
Видео-опыт: «Получение борноэтилового эфира»
Реакция этерификации в условиях кислотного катализа обратима. Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.
RCOOR' + H2O (H+)↔ RCOOH + R'OH
Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат-анион RCOO– не вступает в реакцию с нуклеофильным реагентом – спиртом).
Эта реакция называется омылением сложных эфиров (по аналогии со щелочным гидролизом сложноэфирных связей в жирах при получении мыла).
VI. Тренажеры
Тренажер №1: “Реакция этерификации”
Видео-опыт: «Получение уксусноэтилового эфира»
Видео-опыт: «Получение борноэтилового эфира»
Тема 22:Жиры, их строение, свойства и применение.
ЖИРЫ, ИХ СТРОЕНИЕ, СВОЙСТВА И ПРИМЕНЕНИЕ
Жиры – ценный химический продукт, один из главных компонентов животных и растительных клеток. Этот урок будет посвящен изучению строения и наиболее характерных свойств жиров.
«Химия везде, химия во всем:
Во всем, чем мы дышим,
Во всем, что мы пьем,
Во всем, что едим».




I. Жиры в природе и их роль
Люди давно научились выделять жир из натуральных объектов и использовать его в повседневной жизни. Жир сгорал в примитивных светильниках, освещая пещеры первобытных людей, жиром смазывали полозья, по которым спускали на воду суда. Жиры – основной источник нашего питания. Но неправильное питание, малоподвижный образ жизни приводит к избыточному весу. Животные пустынь запасают жир как источник энергии и воды. Толстый жировой слой тюленей и китов помогает им плавать в холодных водах Северного Ледовитого океана.
Жиры широко распространены в природе. Наряду с углеводами и белками они входят в состав всех животных и растительных организмов и составляют одну из основных частей нашей пищи. Источниками жиров являются живые организмы. Среди животных это коровы, свиньи, овцы, куры, тюлени, киты, гуси, рыбы (акулы, тресковые, сельди). Из печени трески и акулы получают рыбий жир – лекарственное средство, из сельди – жиры, используемые для подкормки сельскохозяйственных животных. Растительные жиры чаще всего бывают жидкими, их называют маслами. Применяются жиры таких растений, как хлопок, лен, соя, арахис, кунжут, рапс, подсолнечник, горчица, кукуруза, мак, конопля, кокос, облепиха, шиповник, масличная пальма и многих других.
Жиры выполняют различные функции: строительную, энергетическую (1 г жира дает 9 ккал энергии), защитную, запасающую. Жиры обеспечивают 50% энергии, требуемой человеку, поэтому человеку необходимо потреблять 70–80 г жиров в день. Жиры составляют 10–20% от массы тела здорового человека. Жиры являются незаменимым источником жирных кислот. Некоторые жиры содержат витамины А, D, Е, К, гормоны.
Многие животные и человек используют жир в качестве теплоизолирующей оболочки, например, у некоторых морских животных толщина жирового слоя достигает метра. Кроме того, в организме жиры являются растворителями вкусовых веществ и красителей. Многие витамины, например витамин А, растворяются только в жирах.
Некоторые животные (чаще водоплавающие птицы) используют жиры для смазки своих собственных мышечных волокон.
Жиры повышают эффект насыщения пищевыми продуктами, т. к. они перевариваются очень медленно и задерживают наступление чувства голода.
II. История открытия жиров
Еще в 17 в. немецкий ученый, один из первых химиков-аналитиков Отто Тахений (1652–1699) впервые высказал предположение, что жиры содержат «скрытую кислоту».
В 1741 французский химик Клод Жозеф Жоффруа (1685–1752) обнаружил, что при разложении кислотой мыла (которое готовили варкой жира со щелочью) образуется жирная на ощупь масса.
То, что в состав жиров и масел входит глицерин, впервые выяснил в 1779 знаменитый шведский химик Карл Вильгельм Шееле.
Впервые химический состав жиров определил в начале прошлого века французский химик Мишель Эжен Шеврёль, основоположник химии жиров, автор многочисленных исследований их природы, обобщенных в шеститомной монографии "Химические исследования тел животного происхождения".
1813 г Э. Шеврёль установил строение жиров, благодаря реакции гидролиза жиров в щелочной среде.Он показал, что жиры состоят из глицерина и жирных кислот, причем это не просто их смесь, а соединение, которое, присоединяя воду, распадается на глицерин и кислоты.
III. Синтез жиров

В 1854 французский химик Марселен Бертло (1827–1907) провел реакцию этерификации, то есть образования сложного эфира между глицерином и жирными кислотами и таким образом впервые синтезировал жир.

Общая формула жиров (триглицеридов):

Жиры – сложные эфиры глицерина и высших карбоновых кислот. Общее название таких соединений – триглицериды.



Животные жиры содержат главным образом глицериды предельных кислот и являются твердыми веществами.
Растительные жиры, часто называемые маслами, содержат глицериды непредельных карбоновых кислот. Это, например, жидкие подсолнечное, конопляное и льняное масла.

Природные жиры содержат следующие жирные кислоты
Насыщенные: стеариновая (C17H35COOH) пальмитиновая (C15H31COOH) масляная (C3H7COOH) | В составе животных жиров |
Ненасыщенные: олеиновая (C17H33COOH, 1 двойная связь) линолевая (C17H31COOH, 2 двойные связи) линоленовая (C17H29COOH, 3 двойные связи) арахидоновая (C19H31COOH, 4 двойные связи, реже встречается) | В составе растительных жиров |
Жиры содержатся во всех растениях и животных. Они представляют собой смеси полных сложных эфиров глицерина и не имеют чётко выраженной температуры плавления.
V. Физические свойства жиров
При комнатной температуре жиры (смеси триглицеридов) – твердые, мазеобразные или жидкие вещества. Как любая смесь веществ, они не имеют четкой температуры плавления (т.е. плавятся в некотором диапазоне температур). Определенной температурой плавления характеризуются лишь индивидуальные триглицериды.
Консистенция жиров зависит от их состава:
- в твердых жирах преобладают триглицериды с остатками насыщенных кислот, имеющие относительно высокие температуры плавления;
- для жидких жиров (масел), напротив, характерно высокое содержание триглицеридов ненасыщенных кислот с низкими температурами плавления.
Причиной снижения температуры плавления триглицеридов с остатками ненасыщенных кислот является наличие в них двойных связей с цис-конфигурацией. Это приводит к существенному изгибу углеродной цепи, нарушающему упорядоченную (параллельную) укладку длинноцепных радикалов кислот.
Сравним пространственное строение ненасыщенной и насыщенной и кислот с равным числом углеродных атомов в цепи: олеиновой C17H33COOH и стеариновой C17H35COOH.

На молекулярной модели олеиновой кислоты виден изгиб цепи по связи С=С, препятствующий плотной упаковке молекул.

В углеродной цепи стеариновой кислоты отсутствуют изгибы, поэтому ее молекулы способны к плотной параллельной укладке.
Чем плотнее упаковка молекул вещества, тем выше температуры его фазовых переходов (т.плав., т.кип.). Соответственно, температура плавления тристеарата глицерина (71 oC) существенно больше, чем у триолеата (–17 oC).
Жиры практически не растворимы в воде, но при добавлении мыла или других поверхностно-активных веществ (эмульгаторов), они способны образовывать стойкие водные эмульсии. Жиры ограниченно растворимы в спирте и хорошо растворимы во многих неполярных и малополярных растворителях – эфире, бензоле, хлороформе, бензине.
- Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твердыми веществами с невысокой температурой плавления (исключение – рыбий жир). В твёрдых жирах преобладают остатки насыщенных кислот.
- Растительные жиры – масла (подсолнечное, соевое, хлопковое и др.) – жидкости (исключение – кокосовое масло, масло какао-бобов). Масла содержат в основном остатки ненасыщенных (непредельных) кислот.
Видео-опыт: "Определение непредельности жиров"
Особенно важны полиненасыщенные кислоты с несколькими двойными связями:
- линолевая CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH,
- линоленовая CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH,
- арахидоновая CH3(CH2)4CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOH
VI. Химические свойства жиров
1. Гидролиз, или омыление
Происходит под действием воды, с участием ферментов или кислотных катализаторов (обратимо) , при этом образуются спирт - глицерин и смесь карбоновых кислот:

или щелочей (необратимо). При щелочном гидролизе образуются соли высших жирных кислот, называемые мылами. Мыла получаются при гидролизе жиров в присутствии щелочей:
Мыла — это калиевые и натриевые соли высших карбоновых кислот.
2. Гидрирование жиров
Это превращение жидких растительных масел в твердые жиры – имеет большое значение для пищевых целей. Продукт гидрогенизации масел – твердый жир (искусственное сало, саломас). Маргарин – пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкого и др.), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др.).
Так в промышленности получают маргарин:

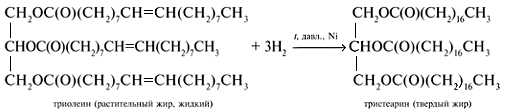
- Пищевая промышленность
- Фармацевтика
- Производство мыла и косметических изделий
- Производство смазочных материалов
Животные жиры и растительные масла, наряду с белками и углеводами – одна из главных составляющих нормального питания человека. Они являются основным источником энергии: 1 г жира при полном окислении (оно идет в клетках с участием кислорода) дает 9,5 ккал (около 40 кДж) энергии, что почти вдвое больше, чем можно получить из белков или углеводов. Кроме того, жировые запасы в организме практически не содержат воду, тогда как молекулы белков и углеводов всегда окружены молекулами воды. В результате один грамм жира дает почти в 6 раз больше энергии, чем один грамм животного крахмала – гликогена. Таким образом, жир по праву следует считать высококалорийным «топливом». В основном оно расходуется для поддержания нормальной температуры человеческого тела, а также на работу различных мышц, поэтому даже когда человек ничего не делает (например, спит), ему каждый час требуется на покрытие энергетических расходов около 350 кДж энергии, примерно такую мощность имеет электрическая 100-ваттная лампочка.
Известно, что значительную долю потребляемого жира должны составлять растительные масла, которые содержат очень важные для организма соединения – полиненасыщенные жирные кислоты с несколькими двойными связями. Эти кислоты получили название «незаменимых». Как и витамины, они должны поступать в организм в готовом виде. Из них наибольшей активностью обладает арахидоновая кислота (она синтезируется в организме из линолевой), наименьшей – линоленовая (в 10 раз ниже линолевой). По разным оценкам суточная потребность человека в линолевой кислоте составляет от 4 до 10 г. Больше всего линолевой кислоты (до 84%) в сафлоровом масле, выжимаемом из семян сафлора – однолетнего растения с ярко-оранжевыми цветками. Много этой кислоты также в подсолнечном и ореховом масле.
По мнению диетологов, в сбалансированном рационе должно быть 10% полиненасыщенных кислот, 60% мононенасыщенных (в основном это олеиновая кислота) и 30% насыщенных. Именно такое соотношение обеспечивается, если треть жиров человек получает в виде жидких растительных масел – в количестве 30–35 г в сутки. Эти масла входят также в состав маргарина, который содержит от 15 до 22% насыщенных жирных кислот, от 27 до 49% ненасыщенных и от 30 до 54% полиненасыщенных. Для сравнения: в сливочном масле содержится 45–50% насыщенных жирных кислот, 22–27% ненасыщенных и менее 1% полиненасыщенных. В этом отношении высококачественный маргарин полезнее сливочного масла.
Необходимо помнить
Насыщенные жирные кислоты отрицательно влияют на жировой обмен, работу печени и способствуют развитию атеросклероза. Ненасыщенные (особенно линолевая и арахидоновая кислоты) регулируют жировой обмен и участвуют в выведении холестерина из организма. Чем выше содержание ненасыщенных жирных кислот, тем ниже температура плавления жира. Калорийность твердых животных и жидких растительных жиров примерно одинакова, однако физиологическая ценность растительных жиров намного выше. Более ценными качествами обладает жир молока. Он содержит одну треть ненасыщенных жирных кислот и, сохраняясь в виде эмульсии, легко усваивается организмом. Несмотря на эти положительные качества, нельзя употреблять только молочный жир, так как никакой жир не содержит идеального состава жирных кислот. Лучше всего употреблять жиры как животного, так и растительного происхождения. Соотношение их должно быть 1:2,3 (70% животного и 30% растительного) для молодых людей и лиц среднего возраста. В рационе питания пожилых людей должны преобладать растительные жиры.
Жиры не только участвуют в обменных процессах, но и откладываются про запас (преимущественно в брюшной стенке и вокруг почек). Запасы жира обеспечивают обменные процессы, сохраняя для жизни белки. Этот жир обеспечивает энергию при физической нагрузке, если с пищей жира поступило мало, а также при тяжелых заболеваниях, когда из-за пониженного аппетита его недостаточно поступает с пищей.
Обильное потребление с пищей жира вредно для здоровья: он в большом количестве откладывается про запас, что увеличивает массу тела, приводя порой к обезображиванию фигуры. Увеличивается его концентрация в крови, что, как фактор риска, способствует развитию атеросклероза, ишемической болезни сердца, гипертонической болезни и др.
Тема 29,30:Обобщение и повторение изученного материала темы: «Металлы».
Проверочная работа по теме: «Металлы».
Без металлов немыслим современный уровень земной цивилизации. Взгляните на периодическую систему элементов: из них свыше 80 относится к металлам и каждый из них по – своему удивителен и интересен.
Сегодня на уроке мы будем повторять пройденный материал и решать задачи по теме “Металлы”. Вас ждут интересные задания и необычные приключения. Итак, начинаем! А чтобы ваше настроение поднялось до экзотермического уровня, предлагаю следующее задание.
Задание: Расшифруйте выражение, которое и станет девизом нашего урока:
Au Ni Al Na In Eu – Sr Ir Li Am. Ответ: «Знание – сила»
Задание «Закончить предложения»
В периоде
1. Заряд ядра атома … (увеличивается)
2. Число внешних слоев в атоме … (не изменяется)
3. Число электронов во внешнем электронном слое атома … (увеличивается от 1 до 8)
4. Радиус атома … (уменьшается)
5. Металлические свойства атомов … (уменьшаются)
В главной подгруппе
1. Заряд ядра атома … (увеличивается)
2. Число внешних слоев в атоме … (увеличивается)
3. Число электронов во внешних электронных слоях атомов … (одинаковое)
4. Радиус атома … (увеличивается)
5. Металлические свойства атомов … (увеличивается)
III. Повторение и обобщение
Актуализация знаний по теме “Физические свойства металлов.”
беседа «Общая характеристика металлов»:
Учитель:
1. Какие элементы относят к металлам?
Как расположены металлы в периодической системе Д.И. Менделеева?
Как объяснить существование большой группы твердых веществ, именуемых металлами, легко поддающихся механической обработке? Они гнутся, куются, прокатываются в листы, превращаются в проволоку и тонкую фольгу. Всем хорошо знакомы лепестки золотой фольги, покрывающие купола старинных соборов; вольфрамовые спирали, сияющие ярким светом в лампах накаливания; медные и алюминиевые провода линии электропередач…
Ковалентные и ионные химические связи не позволили бы металлам вести себя столь странно.
Какая связь у металлов?
Какую связь называют металлической?
Какой тип кристаллической решётки в металлах?
Чем она отличается от всех других кристаллических решеток? (в узлах металлической кристаллической решетки располагаются атомы и положительные ионы)
Какие физические свойства характерны для веществ с металлической кристаллической решёткой? (электропроводность, теплопроводность, металлический блеск, пластичность)
Какими физическими свойствами отличаются металлы друг от друга? (Плотностью, температурой кипения и плавления)
Викторина
Блиц-опрос:
Назовите металл самый легкий
Ответ: литийНазовите самый тугоплавкий металл
Ответ: ВольфрамНазовите металл жидкий
Ответ: РтутьНазовите самый электропроводный металл
Ответ: СереброНазовите самый твердый металл
Ответ: хром.
2). Назови элемент
I. Электронное строение атома металла
В детстве мы читали о нем в сказке Андерсена. Его звон слышали заблудившиеся путники и находили дорогу. Он может болеть «чумой» Какой это металл? (2.8.18.18.4)
Ответ: олово.При раскопках этрусских гробниц (1000 лет до н.э) были обнаружены зубные протезы. Вопрос: из какого металла они были сделаны? ([X] 4f145d106s1)
Ответ: золото.Определите элемент по его электронно-графическому изображению.

Ответ: калий.
II. Этимология металлов
Металл, названный в честь великого русского химика, открывшего периодический закон химических элементов, учёного, педагога и общественного деятеля.
Ответ: Md (менделевий).Металл, названный в честь Земли Русской.
Ответ: Рутений (Ru).Этот элемент – металл, названный в честь естественного спутника Земли.
Ответ: Се (Селен).
III. Сплавы металлов.
Сталь. Сплав железа (98%) и углерода (1,5%)
Бронза. Сплав меди с оловом. Цвет бронзы, с увеличением процентного содержания олова, переходит из красного (90% меди) в желтый (85%меди), белый (50%) и стально-серый (до 35% меди).
Мельхиор. Сплав. Меди (75%) и никеля (25%)
Латунь. Сплав меди (60-80%) с цинком
Задание 1.
1. Электронная формула атома. 1s22s22p63s1.Определите элемент, напишите для него формулы оксида и гидроксида и укажите их характер. (Ответ: Na, Na2O – основный оксид, NaOH – щелочь или гидроксид натрия).
2. Электронная формула атома 1s22s22p63s23p1.Определите элемент, напишите для него формулы высшего оксида и гидроксида, летучего соединения с водородом и укажите их характер. (Ответ: AL – алюминий, AL2O3 – амфотерный оксид, AL(OH)3 – нерастворимое амфотерное основание)
Задание 2. «Решалки»
Высший оксид элемента ЭО. Его оксид содержит 28,57% кислорода. Определите элемент. (Ответ: Са, СаО – основный оксид).
Решение:
Э : О = 71,43 : 28,57 = (71,43 : Х) : (28,57 : 16). Х = 71,43 х 16 : 28,57 = 40
это Са.
Мы вспомнили физические свойства металлов. На этих свойствах основано применение металлов.
Где применяются металлы? Какой металл наиболее используемый?
Но вы знаете, что большинство металлов в природе находятся в виде различных соединений.
В каком виде встречаются металлы в природе?
Ответ: свободном, в виде оксидов и сульфидов (средняя часть ряда), солей (активные металлы – щелочные и щелочноземельные)
Давайте вспомним способы получения металлов, а для этого проведем аукцион.
Задание«Аукцион» Составьте как можно больше способов получения железа из его оксида. На доске запись:
Fe2О3, Al, H2, CO, Cu, O2
Ответ: Fe2О3 + 2Al = 3Fe + Al2О3
Fe2О3 + 3H2 = 2Fe + 3H2O
Fe2О3 + 3CO = 2Fe + 3CO2
«Химические свойства металлов»
А теперь вспомните химические свойства металлов. Назовите основные химические свойства металлов. С чем реагируют металлы? Как протекают данные реакции, при каких условиях?
Общий вывод:
Металлы вступают в реакцию:
С неметаллами
С водой (с учетом условий)
С кислотами (с учетом правил ряда напряжений металлов)
С солями (с учетом правил ряда напряжений металлов)
Допишите уравнения реакций, расставьте коэффициенты:
Один учащиеся у доски, сверяют правильность ответов по компьютеру.
1) Na + HOH ––> … +…
2) Fe + Cu SO4 ––> … + …
3) Zn + HCl ––> … + …
4) Mg + O2 ––> …
5) Ca + S ––> …
6) Al + Cl2 ––> …
В ряду левее водорода
Среди металлов нет урода:
Все растворимы в кислоте,
А те, что с краю, и в воде.
Зато на правом фланге “знать”
Кислот в упор не хочет знать…
--- О чем идет речь в этом стихотворении? Да, чтобы правильно составить уравнения реакций металлов с другими веществами, нужно знать его положение в электрохимическом ряду напряжений металлов.
Задание : найти, объяснить, прокомментировать только те реакции, которые практически осуществимы.
1) 2Na + 2HCl = 2NaCl + H2
2) 2Mg + 2HCl = MgCl2 + H2
3) Mg + 2HNO3 = Mg(NO3)2 + H2
4) 4Mg + 10 HNO3 конц. = 4Mg(NO3)2 +N2O + 5H2O
5) 2Al+6H2SO4 конц. = Al 2(SO4)3 + 3SO2 + 6H2O
6) Mg + 2CH3COOH = (CH3COO)2Mg + H2
Учитель: Итак, правильные реакции четные 2,4,6. Почему?
Задание
Допишите уравнения возможных реакций:
Au+ H2 O =
Fe + HCl =
Zn + H3PO4 =
Cu + H2O =
Al + HCl =
Pb + H2SO4(разб.) =
Ag + HCl =
Учитель: Определите тип реакций.
Данные реакции относя к ОВР, т. е. реакции протекающие с изменением степени окисления. И не всегда методом подбора можно уравнять данные реакции. Какой метод можно использовать для уравнивания уравнения реакции?
Задание :
Кто быстрее уравняет коэффициенты в уравнении реакции
Zn + H2SO4 = ZnSO4 + H2S+ H2O
(рекомендую использовать метод электронного баланса).
Решение: 4Zn +5 H2SO4 = 4ZnSO4 + H2S+4H2O
Или (благородные металлы не растворяются в кислотах, но в концентрированной серной кислоте серебро растворяется)
2Ag + 2H2SO4 = Ag2SO4 + SO2 + 2H2OР
Решить задачу:
– Какой объем (н.у.) оксида углерода (IV) выделится при взаимодействии соляной кислоты с 50 г минерала сидерита, содержащего 80 % FeCO3?
Fe CO3 +2HCl → FeCl2 +H2 O + CO2
m (чис.) Fe CO3 = 50 •0,8 =40 г
n (Fe CO3 ) = n/ M= 40/ 116 = 0,345 моль
n (CO2 ) = n (Fe CO3 ) = 0,345 моль
V (CO2 ) = n•Vm =0,345 • 22,4 = 7,7 л
Ответ: V (CO2) = 7,7 л
Самопроверка и взаимопроверка
а теперь выполним тестовые задания.
Задание 8.
1. Металлические свойства в ряду элементов Be, Mg, Ca, Sr, Ba:
а) не изменяются,
б) ослабевают,
в) усиливаются,
г) изменяются периодически
2. Сталь – это сплав:
а) марганца с хлором,
б) никеля с кремнием,
в) фосфора с серой,
г) железа с углеродом.
3. Реагирует с водой при комнатной температуре:
а) железо,
б) цинк,
в) медь,
г) кальций.
4. Широко используется в электротехнике:
а) железо,
б) медь,
в) литий,
г) кальций.
5. Не реагирует с водой даже при нагревании:
а) магний,
б) цинк,
в) железо,
г) медь.
6. Металлические свойства в ряду элементов Si, Al, Mg, Na:
а) не изменяются,
б) ослабевают,
в) усиливаются,
г) изменяются периодически.
7. Бронза – это сплав:
а) цинка с оловом,
б) алюминия с марганцем,
в) железа с фосфором,
г) меди с оловом.
ВЫПОЛНИТЕ КОНТРОЛЬНУЮ РАБОТУ:
1)Самый распространенный металл в земной коре:
А)Fe Б)Ti В)Al Г)Са
2)В лампах накаливания используют металлическую нить из:
А)Al Б)Fe В)Сu Г)W
3) Наиболее легкоплавкий металл:
А)Li Б)Al В)Hg Г)Сu
4) Наиболее тугоплавкий металл:
А)Fe Б)Cu В)W Г)Са
5)К металлам не относится последовательность элементов:
А)Са,Zn, Cd Б)В,As,Se В)К,Na,Mg Г)Cu,W,Au
6) При горении натрия на воздухе образуется:
А) Na2O Б)Na2O2 В)NaO Г)Na3N
7)Щелочной металл, образующий нитрид при н.у.:
А)К Б)Са В)Li Г)Na
8)Растворимый гидроксид образуется при взаимодействии с водой:
А)К Б)Mg В)Ag Г)Сu
9)При высокой температуре из воды вытесняет водород:
А)Cu Б)Fe В)Ag Г)Hg
10)Более слабыми восстановителями чем водород являются:
А)Са,Al Б)Fe,Co В)Bi,Ag Г)Sn,Pb
11)Уменьшение активности металлов в ряду:
А)Fe,Zn,Pb,Cd Б)Fe,Zn,Cd,Pb В)Zn,Fe,Cd,Pb Г)Zn,Fe,Cd,Pb
12)Водород не восстановит металл из :
А)СаО Б)CuO В) Cr2O3 Г) MnO2
13)С соляной кислотой не взаимодействует:
А)Mg Б)Zn В)Ca Г)Cu
14)Cоединение CaH2 называют:
А)амид кальция Б)гидрат кальция В)гидрид кальция Г)гидроксид кальция
ГРУППА 303 ЭКОЛОГИЯ 9
Тема 9: ИСПОЛЬЗОВАНИЕ И ОХРАНА НЕДР.
ОТКРОЙТЕ УЧЕБНИК ЭКОЛОГИИ (это ссылка на электронный учебник.) СТР.247-253. ПАРАГРАФ 37. ПРОЧИТАЙТЕ, СОСТАВЬТЕ ПЛАН ОТВЕТА. РАССМОТРИТЕ РИСУНКИ.
ГРУППА 401 экология 7,8
Тема 7,8: РОСТ ЧИСЛЕННОСТИ НАСЕЛЕНИЯ
ОТКРОЙТЕ УЧЕБНИК ЭКОЛОГИИ (это ссылка на электронный учебник.) СТР. 202-205 ПАРАГРАФ 31. ПРОЧИТАЙТЕ, СОСТАВЬТЕ ПЛАН ОТВЕТА.РАССМОТРИТЕ РИСУНКИ, ОТВЕТЬТЕ НА ВОПРОС ДИСКУССИИ письменно стр.205 .