ПЯТНИЦА 11.12.20 г. 206,308,201,108
ГРУППА 206
ТЕМА:Карбоновые кислоты. Понятие о карбоновых кислотах. Карбоксильная группа как функциональная. Гомологический ряд предельных однооснóвных карбоновых кислот. Получение карбоновых кислот окислением альдегидов.Химические свойства уксусной кислоты: общие свойства с минеральными кислотами и реакция этерификации.
Карбоновые кислоты - органические вещества, молекулы которых содержат одну или несколько карбоксильных групп.
Карбоксильная группа ![]() (сокращенно —COOH) - функциональная группа карбоновых кислот - состоит из карбонильной группы и связанной с ней гидроксильной группы.
(сокращенно —COOH) - функциональная группа карбоновых кислот - состоит из карбонильной группы и связанной с ней гидроксильной группы.
По числу карбоксильных групп карбоновые кислоты делятся на одноосновные, двухосновные и т.д.
Общая формула одноосновных карбоновых кислот R—COOH. Пример двухосновной кислоты - щавелевая кислота HOOC—COOH.
По типу радикала карбоновые кислоты делятся на предельные (например, уксусная кислота CH3COOH), непредельные [например, акриловая кислота
Изомеры и гомологи
Одноосновные предельные карбоновые кислоты R—COOH являются изомерами сложных эфиров ![]() (сокращенно R'—COOR'') с тем же числом атомов углерода. Общая формула и тех, и других CnH2nO2.
(сокращенно R'—COOR'') с тем же числом атомов углерода. Общая формула и тех, и других CnH2nO2.
| г о м о л о г и | HCOOH метановая (муравьиная) | ||||
| CH3COOH этановая (уксусная) | HCOOCH3 метиловый эфир муравьиной кислоты | ||||
| CH3CH2COOH пропановая (пропионовая) | HCOOCH2CH3 этиловый эфир муравьиной кислоты | CH3COOCH3 метиловый эфир уксусной кислоты | |||
бутановая (масляная) | 2-метилпропановая | HCOOCH2CH2CH3 пропиловый эфир муравьиной кислоты | CH3COOCH2CH3 этиловый эфир уксусной кислоты | CH3CH2COOCH3 метиловый эфир пропионовой кислоты | |
| и з о м е р ы | |||||
Алгоритм составления названий карбоновых кислот
- Найдите главную углеродную цепь - это самая длинная цепь атомов углерода, включающая атом углерода карбоксильной группы.
- Пронумеруйте атомы углерода в главной цепи, начиная с атома углерода карбоксильной группы.
- Назовите соединение по алгоритму для углеводородов.
- В конце названия допишите суффикс "-ов", окончание "-ая" и слово "кислота".
В молекулах карбоновых кислот p-электроны атомов кислорода гидроксильной группы взаимодействуют с электронами ![]() -связи карбонильной группы, в результате чего возрастает полярность связи O—H, упрочняется
-связи карбонильной группы, в результате чего возрастает полярность связи O—H, упрочняется ![]() -связь в карбонильной группе, уменьшается частичный заряд (
-связь в карбонильной группе, уменьшается частичный заряд (![]() +) на атоме углерода и увеличивается частичный заряд (
+) на атоме углерода и увеличивается частичный заряд (![]() +) на атоме водорода.
+) на атоме водорода.

Последнее способствует образованию прочных водородных связей между молекулами карбоновых кислот.
Физические свойства предельных одноосновных карбоновых кислот в значительной степени обусловлены наличием между молекулами прочных водородных связей (более прочных, чем между молекулами спиртов). Поэтому температуры кипения и растворимость в воде у кислот больше, чем у соответствующих спиртов.
Химические свойства кислот
Упрочнение ![]() -связи в карбонильной группе приводит к тому, что реакции присоединения для карбоновых кислот нехарактерны.
-связи в карбонильной группе приводит к тому, что реакции присоединения для карбоновых кислот нехарактерны.
- Горение:CH3COOH + 2O2
 2CO2 + 2H2O
2CO2 + 2H2O - Кислотные свойства.
Из-за высокой полярности связи O-H карбоновые кислоты в водном растворе заметно диссоциируют (точнее, обратимо с ней реагируют):HCOOH HCOO- + H+ (точнее HCOOH + H2O
HCOO- + H+ (точнее HCOOH + H2O  HCOO- + H3O+)
HCOO- + H3O+)
Все карбоновые кислоты - слабые электролиты. С увеличением числа атомов углерода сила кислот убывает (из-за снижения полярности связи O-H); напротив, введение атомов галогена в углеводородный радикал приводит к возрастанию силы кислоты. Так, в рядуHCOOH CH3COOH
CH3COOH  C2H5COOH
C2H5COOH
сила кислот снижается, а в рядуCH3COOH 
CH2ClCOOH 
CHCl2COOH 
CCl3COOH уксусная кислота монохлоруксусная кислота дихлоруксусная кислота трихлоруксусная кислота
- возрастает.
Карбоновые кислоты проявляют все свойства, присущие слабым кислотам:Mg + 2CH3COOH (CH3COO)2Mg + H2
(CH3COO)2Mg + H2
CaO + 2CH3COOH (CH3COO)2Ca + H2O
(CH3COO)2Ca + H2O
NaOH + CH3COOH CH3COONa + H2O
CH3COONa + H2O
K2CO3 + 2CH3COOH 2CH3COOK + H2O + CO2
2CH3COOK + H2O + CO2
- Этерификация (реакция карбоновых кислот со спиртами, приводящая к образованию сложного эфира):



+ H2O муравьиная кислота этанол этиловый эфир
муравьиной кислоты
В реакцию этерификации могут вступать и многоатомные спирты, например, глицерин. Сложные эфиры, образованные глицерином и высшими карбоновыми кислотами (жирными кислотами) - это жиры.
+ 


+ 3H2O глицерин карбоновые кислоты триглицерид
Жиры представляют собой смеси триглицеридов. Предельные жирные кислоты (пальмитиновая C15H31COOH, стеариновая C17H35COOH) образуют твердые жиры животного происхождения, а непредельные (олеиновая C17H33COOH, линолевая C17H31COOH и др.) - жидкие жиры (масла) растительного происхождения. - Замещение в углеводородном радикале:
CH3—CH2—COOH + Cl2 
CH3—CHCl—COOH + HCl пропионовая кислота  -хлорпропионовая кислота
-хлорпропионовая кислота
Замещение протекает в -положение.
-положение.
Особенность муравьиной кислоты HCOOH состоит в том, что это вещество - двуфункциональное соединение, оно одновременно является и карбоновой кислотой, и альдегидом:
Поэтому муравьиная кислота кроме всего прочего реагирует и с аммиачным раствором оксида серебра (реакция серебряного зеркала; качественная реакция):HCOOH + Ag2O(аммиачный раствор) CO2 + H2O + 2Ag
CO2 + H2O + 2Ag
Получение карбоновых кислот
- Окисление альдегидов.
В промышленности: 2RCHO + O2 2RCOOH
2RCOOH
Лабораторные окислители: Ag2O, Cu(OH)2, KMnO4, K2Cr2O7 и др. - Окисление спиртов: RCH2OH + O2
 RCOOH + H2O
RCOOH + H2O - Окисление углеводородов: 2C4H10 + 5O2
 4CH3COOH + 2H2O
4CH3COOH + 2H2O - Из солей (лабораторный способ): CH3COONaкр. + H2SO4 конц.
 CH3COOH
CH3COOH + NaHSO4
+ NaHSO4
ГРУППА 308
ТЕМА:Понятие о диеновых углеводородах. Природный каучук.
СОСТАВИТЬ КОНСПЕКТ ПО ПРЕЗЕНТАЦИИ
Практическая работа №2. Получение этилена и изучение его свойств.
Цель: научиться получать в лаборатории этилен; изучить физические и химические свойства этилена.
Оборудование: пробирки, пробка с газоотводной трубкой, штатив, спиртовая горелка, спички.
Реактивы: C2H5OH, H2SO4(конц.), песок, бромная вода (Br2), KMnO4.
Ход работы
С правилами техники безопасности ознакомлен(а) и обязуюсь их выполнять.
В пробирку налили 1 мл этилового спирта и осторожно добавьте 6—9 мл концентрированной серной кислоты. Затем всыпали немного прокаленного песка (чтобы предотвратить толчки жидкости при кипении). Закрыли пробирку пробкой с газоотводной трубкой, закрепили ее в штативе и осторожно нагрели содержимое пробирки.

В пробирке начинается выделяться газ - этилен.
С2H5OH C2H4↑ + H2O.
В ходе реакции концентрированная серная кислота забирает воду из спирта, врезультате образуется этилен.
Такую реакцию называют – реакция дегидратации.
2.
Изучение свойств этилена.
В другую пробирку налили 2-3 мл бромной воды. Опустили газоотводную трубку первой пробирки до дна пробирки с бромной водой и пропускали через неё выдедяющийся газ.

При пропускании газа через бромную воду, происходит обесцвечивание бромной воды.
H2C=CH2 + Br2 → CH2Br – CH2Br
В ходе реакции происходит окисление этилена бромной водой по двойной связи.
В третью пробирку налили 2-3 мл разбавленного раствора KMnO4, поодкисленного серной кислотой, и пропустили через него газ.

При пропускании газа через подкисленный раствор KMnO4, происходит обесцвечивание раствора KMnO4.
5C2H4+12KMnO4+18H2SO4→10CO2+6K2SO4+
+12MnSO4+28H2O.
В ходе реакции происходит окисление этилена подкисленным раствором перманганата калия.
Выделяющиеся газ первой пробирки подожгли.

Этилен на воздухе горит ярким светящимся пламенем.
С2Н4 + 3О2 → 2СО2+2Н2О.
Этилен горит ярким светящимся пламенем, что доказывает наличие кратных связей.
Вывод: на данной практической работе мы научились получать в лаборатории этилен реакцией дегидратации спиртов; изучили химические свойства этилена, а именно, действие этилена на бромную воду и подкисленный раствор перманганата калия.
ГРУППА 201
ТЕМА:Химические свойства этилена: горение, качественные реакции (обесцвечивание бромной воды и раствора перманганата калия), гидратация, полимеризация. Применение этилена на основе свойств.
В природе этот газ практически не встречается: он образуется в незначительных количествах в тканях растений и животных как промежуточный продукт обмена веществ. Попутно это — самое производимое органическое соединение в мире. Газ этилен служит сырьем для получения полиэтилена.
Свойства этилена
Этилен (другое название — этен) — химическое соединение, описываемое формулой С2H4. В природе этилен практически не встречается. Это бесцветный горючий газ со слабым запахом. Частично растворим в воде (25,6 мл в 100 мл воды при 0°C), этаноле (359 мл в тех же условиях). Хорошо растворяется в диэтиловом эфире и углеводородах.
Этилен является простейшим алкеном (олефином). Содержит двойную связь и поэтому относится к ненасыщенным соединениям. Играет чрезвычайно важную роль в промышленности, а также является фитогормоном.
Химические свойства этилена
Этилен способен присоединять водород (гидрирование) (5), галогены (галогенирование) (6), галогеноводороды (гидрогалогенирование) (7) и воду (гидратация) (8):
CH2=CH2 + H2→ CH3-CH3 (kat = Pt) (5);
CH2=CH2 + Br2→BrCH-CHBr (6);
CH2=CH2 + H-Cl → H2C-CHCl (7);
CH2=CH2 + H-OH → CH3-CH2-OH (H+, to) (8).
В зависимости от условий проведения реакции окисления этилена могут быть получены многоатомные спирты (9), эпоксиды (10) или альдегиды (11):
CH2=CH2 + 2KMnO4 + 2KOH → HO-CH2-CH2-OH + 2K2MnO4 (9);
2CH2=CH2 + O2 → 2C2OH4 (эпоксид) (kat = Ag,to) (10);
2CH2=CH2 + O2 → 2CH3-C(O)H (kat = PdCl2, CuCl) (11).
В результате горения этилена происходит разрыв всех связей в молекуле, а продуктами реакции являются углекислый газ и воды:
C2H4 + 2O2→ 2CO2 + 2H2O.
Этилен подвергается полимеризации:
nCH2=CH2→ -[-CH2-CH2-]-n (kat, to).
Кроме этого, если проводить галогенирование этилена при температуре 400oС, то разрыва двойной связи происходить не будет, будет замещаться один атом водорода в углеводородном радикале:
CH2=CH2 + Cl2→ CH2=CH-Cl + HCl.
Сырье для полиэтилена и не только
Этилен — самое производимое органическое соединение в мире; общее мировое производство этилена в 2005 году составило 107 миллионов тонн и продолжает расти на 4–6% в год. Источником промышленного получения этилена является пиролиз различного углеводородного сырья, например, этана, пропана, бутана, содержащихся в попутных газах нефтедобычи; из жидких углеводородов — низкооктановые фракции прямой перегонки нефти. Выход этилена – около 30%. Одновременно образуется пропилен и ряд жидких продуктов (в том числе ароматических углеводородов).
При хлорировании этилена получается 1,2-дихлорэтан, гидратация приводит к этиловому спирту, взаимодействие с HCl – к этилхлориду. При окислении этилена кислородом воздуха в присутствии катализатора образуется окись этилена. При жидкофазном каталитическом окислении кислородом получается ацетальдегид, в тех же условиях в присутствии уксусной кислоты – винилацетат. Этилен является алкилирующим агентом , например, в условиях реакции Фриделя-Крафтса способен алкилировать бензол и другие ароматические соединения. Этилен способен полимеризоваться в присутствии катализаторов как самостоятельно, так и выступать в роли сомономера, образуя обширный ряд полимеров с различными свойствами.
Применение
Этилен является одним из базовых продуктов промышленной химии и стоит в основании ряда цепочек синтеза. Основное направление использования этилена — в качестве мономера при получении полиэтилена (наиболее крупнотоннажный полимер в мировом производстве). В зависимости от условий полимеризации получают полиэтилены низкого давления и полиэтилены высокого давления.
Также полиэтилен применяют для производства ряда сополимеров, в том числе с пропиленом, стиролом, винилацетатом и другими. Этилен является сырьем для производства окиси этилена; как алкилирующий агент – при производстве этилбензола, диэтилбензола, триэтилбензола.
Этилен применяют как исходный материал для производства ацетальдегида и синтетического этилового спирта. Также он используется для синтеза этилацетата, стирола, винилацетата, хлористого винила; при производстве 1,2-дихлорэтана, хлористого этила.
Этилен используют для ускорения созревания плодов — например, помидоров, дынь, апельсинов, мандаринов, лимонов, бананов; дефолиации растений, снижения предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к материнским растениям, что облегчает механизированную уборку урожая.
ГРУППА 108
ТЕМА: Химические элементы- неметаллы.
Неметаллы
Общая характеристика
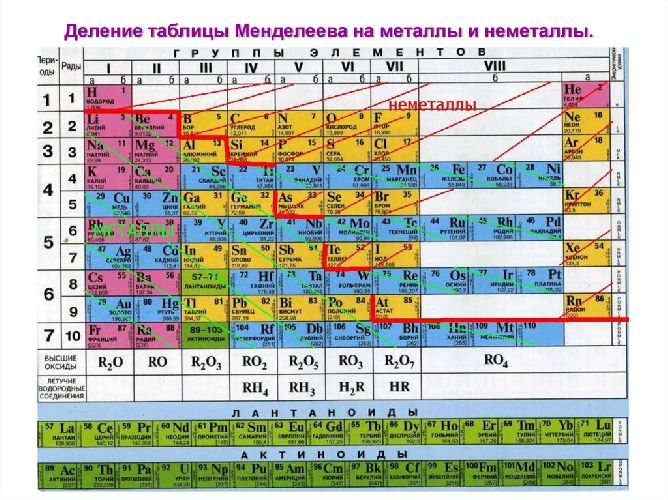
К неметаллическим элементам относятся p-элементы, а также водород и гелий, которые в свою очередь относятся к s-элементам. Они расположены правее и выше диагонали бор-астат. Всего же известно 22 неметалла. У наиболее типичных неметаллов заполнение электронами внешнего уровня близко к максимальному, а радиусы атомов – минимальные среди элементов данного периода.
Рис. 1. Группа неметаллов в периодической системе.
Атомы неметаллов имеют более высокие значения электроотрицательности, а соответственно высокие энергии ионизации и большое сродство к электрону. В связи с этим характер неметаллов таков, что, в отличии от металлов, могут проявлять окислительные свойства. В реакциях они могут восстанавливаться, присоединяя столько электронов, чтобы общее их количество на внешнем уровне достигло восьми (завершенный уровень, стабильное состояние атома).
Особенности строения неметаллов заключаются в том, что внешний электронный слой у большинства атомов неметаллов содержит от 4 до 8 электронов.
Другие неметаллы (кроме фтора) могут проявлять и положительные степени окисления, образуя ковалентные связи с другими элементами.
Физические свойства
Для большинства неметаллов простых веществ в твердом агрегатном состоянии характерна молекулярная кристаллическая решетка. То есть эти неметаллы являются кристаллическими веществами. Поэтому при обычных условиях они имеют вид газов, жидкостей или твердых веществ с низкими температурами плавления. Примерами таких веществ являются газы: водород H2 , неон Ne, жидкость – бром Br2 , твердые вещества йод I2, сера S8, фосфор P4 (белый фосфор). Существуют неметаллы (бор, углерод, кремний), которые имеют атомные кристаллические решетки.
 Рис. 2. Неметаллы – жидкости, газы, твердые.
Рис. 2. Неметаллы – жидкости, газы, твердые.
Важнейшие элементы, которые содержаться в живых организмах – органогены. Они образуют воду, белки, витамины, жиры. К ним относятся 6 элементов: углерод, кислород, водород, азот, фосфор, сера.
Химические свойства и соединения
Водородные соединения неметаллов в основном являются летучими соединениями, в водных растворах имеющими кислотный характер. Они имеют молекулярные структуры, ковалентную полярную связь. Некоторые из них (вода, аммиак, фтороводород) образуют водородные связи. Соединения образуются при непосредственном взаимодействии неметаллов с водородом. Электронная формула серы с водородом выглядит следующим образом:
Все водородные соединения – восстановители (кроме HF), причем их восстановительная сила возрастает справа налево по периоду и сверху вниз по подгруппе.
Неметаллы взаимодействуют с металлами и другими неметаллами:
В результате получается натриевая соль соляной кислоты

Рис. 3. натриевая соль соляной кислоты.
соединения неметаллов с кислородом, как правило, являются кислотными оксидами, которым соответствуют кислородосодержащие кислоты. Структура оксидов типичных неметаллов молекулярная (SO3, P4 O10). Чем выше степень окисления неметалла, тем сильнее соответствующая оксокислота. Так, хлор непосредственно не взаимодействует с кислородом, однако образует ряд оксокислот, которым соответствуют оксиды, ангидриды этих кислот.
Неметаллы находят применение в разных отраслях промышленности. Вот список отраслей, где их использование является наиболее востребованным.
| Область применения | Примеры, перечень неметаллов, применяемых в той или иной промышленности |
| промышленность | Сера, азот и фосфор часто используют для получения кислот. Серу также используют на производстве резины. |
| транспорт | важным неметаллом в транспортной промышленности является водород. Его используют в качестве топлива. При сгорании такой вид топлива не загрязняет окружающую среду. |
| аграрная отрасль | сера используется для борьбы с вредными насекомыми и болезнями растений |
| медицина | Кислород используют для восстановления дыхания (кислородные подушки), уголь в форме активированного угля, который способен выводить из организма вредные вещества. |
| пищевая промышленность | азот используют для продления срока годности продуктов |
Что мы узнали?
В этой статье кратко излагается основная информация о неметаллах, их строении, и о том, с чем реагируют неметаллы. Неметаллами могут быть газы, жидкости и твердые вещества с кристаллической решеткой. Самым активным неметаллом является фтор, который имеет степень окисления-1.
Тест по теме
- Вопрос 1 из 10Сколько существует неметаллов?
Подробнее: https://obrazovaka.ru/himiya/nemetally-9-klass.html
