29.01.21 г. 208, 201, 303
ГРУППА 208
Практическая работа «Решение экспериментальных задач по органической химии»
Цель:1)закрепить и применить
знания курса химии в области химических свойств кислородосодержащих
органических веществ;
2)научиться применять знания по качественному анализу на распознавание
органических веществ;
3)закрепить умения по составлению уравнений реакций по качественному
распознанию органических веществ;
4)закрепить знания правил поведения в химическом кабинете, при выполнении
работы.
Оборудование: штатив с пробирками,
держатель, спиртовка, химический стакан, спички, растворы реактивов: C₂H₂O₄,C₆H₅OH,CH₃COOH,C₂H₅OH, CH₃–(CH₂)₇–CH₌ CH− (CH₂)₇– CH₃– COOH, C₃H₈O₃, таблица «Качественные
реакции»
Вспомним ПТБ при работе в кабинете, с органическими веществами. Далее
провожу повторный инструктаж.
Задание: Прочтите внимательно
задачу и предложите последовательные шаги по решению данной задачи.
(Интересные факты о веществах: все эти вещества находят применение в
медицине. Фенол используют для производства препарата от туберкулеза, этиловый
спирт для производства настоек, обработки медицинского инструментария, глицерин
входит в состав мазей. В пищевой промышленности глицерин под кодом Е-422.
Все
вещества в больших концентрациях ядовиты!)
Задача: Какие сходства и особенности для веществ: C₆H₅OH, C₂H₅OH, C₃H₈O₃
Возможные варианты взаимопревращений:
Дано:
фенол
этиловый спирт
глицерин
Определить-?
Решение: Возможные варианты взаимопревращений
Во все пробирки приливаем FеCL₃ (хлорид
железа(III). С фенолом
появится фиолетовое окрашивание с образованием фенолята железа(III)-
качественная реакция на фенол . К двум оставшимся растворам приливаем Cu(OH)2 (гидроксид
меди (II).
В случае образования раствора темно-синего цвета свидетельствует о
образовании комплексного соединения глицерата меди(II) – качественная реакция
на глицерин..
Методом исключения остается этиловый спирт.
Задача
Задание: Прочти внимательно задачу и предложи последовательные шаги по
решению данной задачи.
(Интересные факты о веществах: уксусная кислота –одна из самых древних
кислот ,которую удалось выделить и использовать человечеству. В организме
человека за сутки образуется до 400 грамм этой кислоты. Щавелевая кислота
содержится в щавеле, соли – оксалаты- в ревене, продукты питания с щавелевой
кислотой и её солями необходимо включать в рацион питания для полноценного
функционирования сердечно - сосудистой системы.)
Задача: Какие сходства и особенности для веществ: :
C₂H₂O₄,CH₃COOH, CH₃–(CH₂)₇–CH₌ CH− (CH₂)₇– CH₃– COOH
Модельный ответ к задаче №3
Дано:
Щавелевая кислота
Уксусная кислота
Олеиновая кислота
Определить-?
Решение: Возможные варианты взаимопревращений
Щавелевая кислота среди предложенных веществ является двухосновной, слабой,
термически неустойчивой. При нагревании всех образцов, только в случае, где
щавелевая кислота, будет выделение углекислого газа CO₂, который легко доказать с помощью
помутнения известковой воды
Ca(OH)2 + CO2 = CaCO3(белый осадок) + H2O.
В две оставшие пробирки с растворами приливаем KMnO₄, перманганат калия, обесцвечивание
раствора –качественная реакция на наличие кратных связей в веществе – в нашем
случае в олеиновой кислоте.
Методом исключения остается уксусная кислота
Вывод:…(Что
научились делать?)
ГРУППА 201
|
Тема:Межклассовая изомерия с алкадиенами. |
Алкадиены
Алкадиены - непредельные (ненасыщенные) углеводороды, имеющие в молекуле две двойных связи С=С. Каждая такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкадиены также называют диеновыми углеводородами. Первый член гомологического ряда - пропадиен - CH2=C=CH2. Общая формула их гомологического ряда - CnH2n-2.
Номенклатура и изомерия алкадиенов
Названия алкенов формируются путем добавления суффикса "диен" к названию алкана с соответствующим числом: пропадиен, бутадиен, пентадиен и т.д.
При составления названия алкадиена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойные связи. Нумерация атомов углерода в ней начинается с того края, к которому ближе двойная связь. В конце названия указывают атомы углерода, у которых начинается двойная связь.
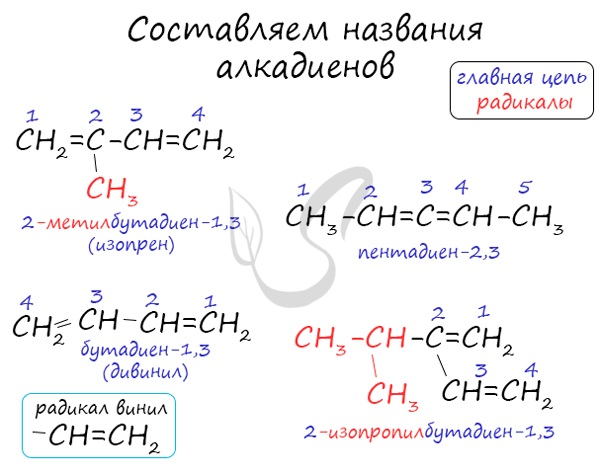
Атомы углерода, прилежащие к двойной связи находятся в sp2 гибридизации.
Для алкадиенов характерна изомерия углеродного скелета, положения двойных связей, межклассовая изомерия с алкинами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
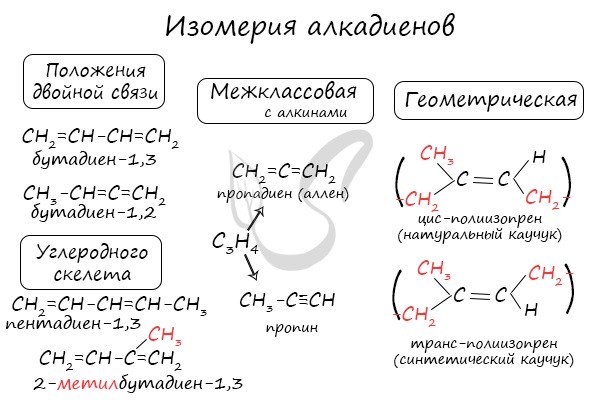
Также к синтетическим каучукам относится бутадиен-1,3 (дивинил).
ПРОВЕРЬТЕ СЕБЯ, ПРОЙДИТЕ ТЕСТ (С ПОДСКАЗКАМИ) ЗДЕСЬ:
https://studarium.ru/article-test/184
ГРУППА 303
ТЕМА:Гидролиз солей. Гидролиз солей различного типа.
|
