ПОНЕДЕЛЬНИК 14.12.20 г. 305,303,308,301,108.
ГРУППА 305
ТЕМА::ЯДРО. ПРОКАРИОТЫ.ЭУКАРИОТЫ. ПЛАЗМОЛИЗ.
Задание, просмотрите видео, запишите лаб.работу., ответьте на вопросы.Лабораторная работа №1
Тема: плазмолиз и деплазмолиз в клетках кожицы лука
Цель: сформировать умение проводить опыт по получению плазмолиза, закрепить умения работать с микроскопом, проводить наблюдение и объяснять полученные результаты. Оборудование: микроскопы, предметные и покровные стекла, стеклянные палочки, стаканы с водой, фильтровальная бумага, раствор поваренной соли, репчатый лук.
Ход работы
1. Приготовьте препарат кожицы лука, рассмотрите клетки под микроскопом. Обратите внимание на расположение цитоплазмы относительно клеточной оболочки. 2. Удалите с микропрепарата воду, приложив фильтровальную бумагу к краю покровного стекла. Нанесите на предметное стекло каплю раствора поваренной соли. Наблюдайте за изменением положения цитоплазмы. 3. Фильтровальной бумагой удалите раствор поваренной соли. Капните на предметное стекло 2-3 капли воды. Наблюдайте за состоянием цитоплазмы. 4. Объясните наблюдаемое явление. Ответьте на вопросы: куда двигалась вода (в клетки или из них) при помещении ткани в раствор соли? Чем можно объяснить такое направление движения воды? Куда двигалась вода при помещении ткани в воду? Чем это объясняется? Как вы думаете, что бы могло произойти в клетках, если бы их оставили в растворе соли на длительное время? Можно ли использовать раствор соли для уничтожения сорняков?
ТЕМА:прокариоты, эукариоты.(308 гр.)
Термины «прокариоты» и «эукариоты» были предложены французским ботаником Э.Шаттоном в 1925 г.
Деление организмов на прокариотические и эукариотические сохранялось довольно долго (до 1990-х гг.), пока американский микробиолог К.Вёзе не обнаружил, что в среде прокариотов находится большая группа особей с существенными генетическими различиями.
В этой связи он предложил разделить прокариотов на бактерии и археи. В настоящий момент разделение живых организмов на эукариотов, бактерии и археи считается общепризнанным.
Прокариоты — это...
Прокариоты – это одноклеточные живые организмы без оформленного клеточного ядра. Они не развиваются, не переходят в многоклеточную форму и способны к автономному существованию.
Прокариоты – самая представительная форма жизни на Земле по количеству видов. Например, 1 грамм плодородной почвы может содержать порядка 10 млрд.бактериальных клеток.
Как уже отмечено выше, к прокариотам относятся бактерии (в том числе цианобактерии или сине-зелёные водоросли) и археи.
У прокариотов молекула органического вещества не отделена от цитоплазмы, а прикреплена к клеточной мембране. У них, как правило, бесполый способ размножения, а ДНК имеет кольцевую форму. У большинства прокариотов геном (что это?) представлен одиночной хромосомой.

Прокариоты – это древнейшие и в то же время самые примитивные организмы на нашей планете. Они встречаются повсеместно: в воздухе, в воде, в почве, внутри живых организмов.
Их можно обнаружить в океанических глубинах, на горных вершинах, во льдах Антарктиды и Арктики. В атмосфере споры бактерий присутствуют на высоте до 15 км, а в грунт они проникают на глубину более 4 км.
По форме бактериальные клетки отличаются огромным разнообразием. Они могут быть в виде палочек (бациллы), округлыми (диплококи), шестиугольными, звездообразными, стебельковыми и т.д. Диплококки образуют пары, стрептококки – цепочки, стафилококки – скопления наподобие виноградных гроздей.
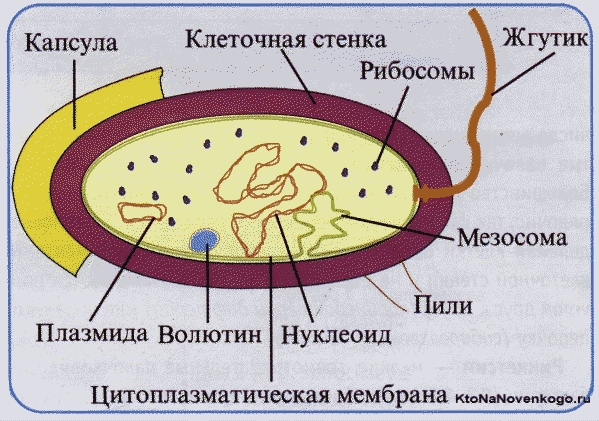
Строение бактериальной клетки в упрощённом виде выглядит следующим образом:
- клеточная оболочка (стенка);
- плазматическая мембрана;
- цитоплазма;
- хромосомная кольцевая ДНК (прикреплена к мембране);
- плазмиды (небольшие не прикреплённые к мембране кольцевые ДНК с небольшим набором генов);
- рибосомы;
- прокариотический жгутик(и).
Эукариоты — это...
В отличие от прокариотов, эукариоты – это ядерные живые организмы (т.е. их клетки содержат ядро).
Они могут быть как одноклеточными, так и многоклеточными, однако строение клеток у них однотипное.
В группу эукариотов (они могут быть одно- или многоклеточными) входят растения, животные (в том числе человек) и грибы.
Клетки эукариот разделены системой мембран на отдельные отсеки, имеют схожий химический состав и однотипный обмен веществ.
Генетический материал сконцентрирован, главным образом, в хромосомах, которые образованы цепочками ДНК и белковыми молекулами. В цитоплазме располагаются мембранные органоиды.

Непременным структурным элементом любой эукариотической клетки является ядро. В нём, а также в митохондриях животные клетки хранят наследственную информацию.
В растительных клетках эта информация находится не только в ядре и митохондриях, но ещё и в пластидах. Объёмное соотношение между ядром и цитоплазмой называется ядерно-цитоплазматическим индексом, с помощью которого можно оценить уровень метаболизма (это что?).
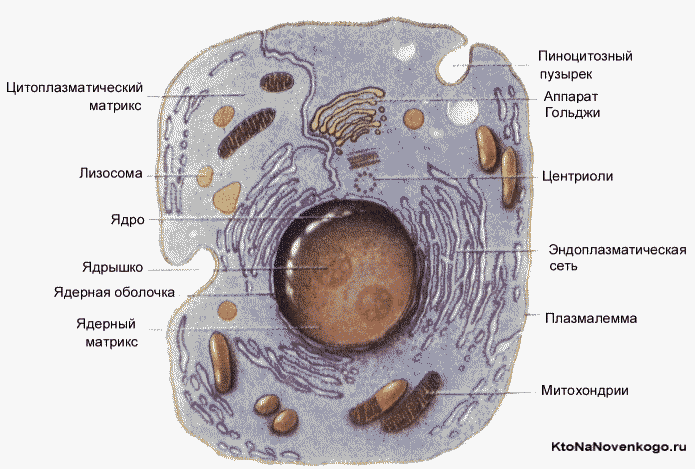
В состав клетки эукариот входят следующие основные компоненты:
- ядро;
- ядерная мембрана;
- линейная ДНК;
- цитоплазма;
- митохондрии;
- плазматическая или клеточная мембрана;
- хромосомы;
- рибосомы;
- лизосомы (у животных клеток для переваривания клеточных микромолекул);
- хлоропласты (у растительных клеток для обеспечения фотосинтеза);
- эукариотический жгутик(и).
ГРУППА 303
ТЕМА:СТЕПЕНЬ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ.
Степень электролитической диссоциации
Поскольку электролитическая диссоциация - процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Другими словами, различные электролиты, согласно теории С. Аррениуса, диссоциируют на ионы в различной степени. Полнота распада (сила электролита) характеризуется количественной величиной – степенью диссоциации.
Степень диссоциации (α – греческая буква альфа) - это отношение числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N):
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
Степень диссоциации зависит от природы электролита и растворителя, от концентрации электролита, температуры.
1. Зависимость степени диссоциации от природы: чем полярнее химическая связь в молекуле электролита и растворителя, тем сильнее выражен процесс диссоциации электролита на ионы и тем выше значение степени диссоциации.
2. Зависимость степени диссоциации от концентрации электролита: с уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается.
3. Зависимость степени диссоциации от температуры: степень диссоциации возрастает при повышении температуры (повышение температуры приводит к увеличению кинетической энергии растворённых частиц, что способствует распаду молекул на ионы).
Сильные и слабые электролиты
В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% — средними, менее 3% — слабыми электролитами.
Классификация электролитов в зависимости от степени электролитической диссоциации (памятка)
Классификация электролитов | Сильные электролиты | Средние электролиты | Слабые электролиты |
Значение степени диссоциации (α) | α>30% | 3%≤α≤30% | α<3% |
Примеры | 1. Растворимые соли; 2. Сильные кислоты (НСl, HBr, HI, НNО3, НClO4, Н2SO4(разб.)); 3. Сильные основания – щёлочи. | H3PO4 H2SO3 | 1. Почти все органические кислоты (CH3COOH, C2H5COOH и др.); 2. Некоторые неорганические кислоты (H2CO3, H2S и др.); 3. Почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH); 4. Вода. |
Определение сильных и слабых электролитов
Тренажёр "Сильные и слабые электролиты"
Практическая работа №1.
ТЕМА:Приготовление раствора заданной концентрации.
Цель: - научиться практически готовить растворы с заданной
массовой долей растворённого вещества.
Задачи: - повторить и использовать правила ТБ
-повторить и практически применить знания о растворах
и массовой доле растворённого вещества,
- познакомиться с устройством лабораторных весов и
правилами
взвешивания,
-формировать коммуникативные компетентности.
Оборудование и реактивы:
Весы лабораторные, химические стаканы (V = 50мл),
стеклянные палочки, мензурки (V =50мл), дистиллированная вода, поваренная соль.
Ход работы.
Приготовление растворов солей с определённой массовой
долей растворённого вещества.
Теоретическая часть (закрепление знаний формул для расчетов массовой доли вещества, умение решения задач разных типов)
1.Приготовить 20 г.водного раствора соли массовой долей соли 5%.
2.Какую массу щелочи необходимо взять для приготовления 50 г 16%-ного раствора?
3. К 600 г 50% р-ра соли добавили 100 г воды. Чему равна массовая доля соли в полученном растворе?
Ход работы (Практическая часть)
Практическую часть начнём с проверки знаний правил ТБ, которые важно помнить при выполнении работы.
1) Нельзя пробовать вещества на вкус.
2) Нельзя брать вещества руками.
3) Если взяли реактива больше, чем требуется, нельзя высыпать ( выливать) обратно в банку (склянку).
4) Нюхать вещества с осторожностью.
5) Работать аккуратно и внимательно , соблюдая порядок и дисциплину.
6) По окончанию работы привести в порядок рабочее место и вымыть руки с мылом.
Приготовление раствора с определенной массовой долей растворенного вещества. Приготовить раствор хлорида натрия массой
m(NaCl) = 300 · 0,12 = 36 (г);
m(H2O) = 300 - 36 = 264 (г), что соответствует объему 264 мл воды.
В колбу или стакан на 500-700 мл поместим предварительно взвешенную навеску соли массой
Вывод
- Что такое массовая доля растворённого вещества?
- Что говорит о растворе его массовая доля?
ГРУППА 308
ТЕМА:Ацетилен и его гомологи.
Алкины – это алифатические (ациклические), непредельные (ненасыщенные) углеводороды, с одной тройной углерод-углеродной связью С≡С в цепи и общей формулой СnH2n-2 , где n ≥ 2
2. Строение
Ацетилен – первый член гомологического ряда ацетиленовых углеводородов, или алкинов.
Молекулярная формула ацетилена C2H2
Структурная формула ацетилена H–C≡C–H
Электронная формула H : С : : : С : Н
Углеродные атомы ацетилена, связанные тройной связью, находятся в состоянии sp-гибридизации. При образовании молекулы ацетилена у каждого атома С гибридизуются по одной s- и p-орбитали. В результате этого каждый атом С приобретает по две гибридных орбитали, а две p-орбитали остаются негибридными. Две гибридных орбитали взаимно перекрываются, и между атомами С образуется σ-связь. Остальные две гибридных орбитали перекрываются с s-орбиталями атомов H, и между ними и атомами С тоже образуются σ -связи. Четыре негибридных p-орбитали размещены взаимно перпендикулярно и перпендикулярно направлениям σ-связей. В этих плоскостях p-орбитали взаимно перекрываются, и образуются две π -связи, которые относительно непрочные и в химических реакциях легко разрываются.
Таким образом, в молекуле ацетилена имеются три σ -связи (одна связь C–C и две связи C–H) и две π -связи между двумя С атомами. Тройная связь в алкинах – не утроенная простая, а комбинированная, состоящая из трех связей: одной σ - и двух π -связей.
Молекула ацетилена имеет линейное строение. Появление третьей связи вызывает дальнейшее сближение атомов С: расстояние между их центрами составляет 0,120 нм.
Запомните!
1. Длина связи 0,12 нм
2. Угол 180
3. Линейная молекула
4. Связи – σ и 2π
5. Sp- гибридизация
3. Физические свойства
С2Н2 – Ацетилен – бесцветный газ, легче воздуха, мало растворим в воде, в чистом виде почти без запаха.
Свойства гомологов изменяются аналогично алкенам. По физическим свойствам алкины напоминают алкены и алканы. Температуры их плавления и кипения увеличиваются с ростом молекулярной массы. В обычных условиях алкины С2–С3 – газы, С4–С16 – жидкости, высшие алкины – твердые вещества. Наличие тройной связи в цепи приводит к повышению температуры кипения, плотности и растворимости их в воде по сравнению с олефинами и парафинами.
4. Изомерия и номенклатура
Структурная изомерия
1. Изомерия положения тройной связи (начиная с С4Н6):
2. Изомерия углеродного скелета (начиная с С5Н8):
3. Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С4Н6:
Пространственная изомерия относительно тройной связи в алкинах не проявляется, т.к. заместители могут располагаться только одним способом - вдоль линии связи.
Гомологи ацетилена:

1) Бертло первым высказал предположение о том, что ацетилен, подобно метану и этилену, начинает собой гомологический ряд:
2) это ряд ацетиленовых углеводородов с одной тройной связью между атомами углерода в молекуле;
3) согласно систематической номенклатуре название таких углеводородов образуются путем замены суффикса – ан соответствующих предельных углеводородов на – ин;
4) как и этиленовые углеводороды, атомы углерода нумеруются, начиная с того конца, к которому ближе кратная (тройная) связь:
а) бутин-1 СН ≡≡ С-СН2-СН3;
б) бутин-2 СН3-С ≡≡ С-СН3.
Особенности изомерии:
а) обусловлена разветвлением углеродного скелета;
б) характерное положение тройной связи;
в) помогает в получении и использовании ацетилена в различных сферах.
ГРУППА 301
ТЕМА: Основания как электролиты, их классификация по различным признакам. Химические свойства оснований в свете теории
электролитической диссоциации. Разложение нерастворимых в воде оснований. Основные способы получения оснований. Основания – это сложные вещества, состоящие из атомов металлов и одной или нескольких гидроксогрупп (ОН-). С точки зрения теории электролитической диссоциации это электролиты (вещества, растворы или расплавы которых проводят электрический ток), диссоциирующие в водных растворах на катионы металлов и анионы только гидроксид - ионов ОН-. Растворимые в воде основания называются щелочами. К ним относятся основания, которые образованы металлами 1-й группы главной подгруппы (LiOH, NaOH и другие) и щелочноземельными металлами (Са(ОН)2, Sr(ОН)2, Ва(ОН)2). Основания, образованные металлами других групп периодической системы в воде практически не растворяются. Щелочи в воде диссоциируют полностью: NaOH ® Na+ +
Многокислотные основания в воде диссоциируют ступенчато:
Ba(OH)2 ® BaOH+ + Ba(OH)+ Cтупенчатой диссоциацией оснований объясняется образование основных солей.
Получение
1. Взаимодействие активного металла с водой:
2Na + 2H2O → 2NaOH + H2 Ca + 2H2O → Ca(OH)2 + H2 Mg + 2H2O 2. Взаимодействие основных оксидов с водой (только для щелочных и щелочноземельных металлов):
Na2O + H2O → 2NaOH, CaO + H2O → Ca(OH)2. 3. Промышленным способом получения щелочей является электролиз растворов солей:
2NaCI + 4H2O 4. Взаимодействие растворимых солей со щелочами, причем для нерастворимых оснований это единственный способ получения: Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4 MgSO4 + 2NaOH → Mg(OH)2 Нерастворимые основания Определение Нерастворимые основания ― основания, в составе которых нет активных металлов (подгруппы Ia и IIа ниже магния). Получение • Способ получения нерастворимых оснований ― соль + щелочь: Fe(NO3)3 + 3NaOH → Fe (OH)3↓ + 3NaNO3 Fe3+ + 3OH- → Fe(OH)3 • Нерастворимые основания нельзя получить из соответствующего оксида и воды ― они не реагируют (искл.оксид магния). MeO + H2O — не реагирует Неактивный Классификация нерастворимых оснований • основные • амфотерные нерастворимые основания основные амфотерные формула MeOH +1; +2 (кр. искл) MeOH +3; +4; (+2) искл. разлагаются при повышении температуры Cu(OH)2 → CuO + H2O синий черный во влажном состоянии Zn(OH)2 → ZnO + H2O реагируют с кислотами Mg(OH)2 + 2HCl → MgCl2 +2H2O Mg(OH)2 + 2H+ → Mg2+ + 2H2O Be(OH)2 + 2HCl → BeCl2 + 2H2O Be(OH)2 + 2H+ → Be2+ + 2H2O реагирует со щелочами в растворе NaOH + Al(OH)3 → Na[Al(OH)4] OH- + Al(OH)3 → [Al(OH) |
ТЕМА: Строение и свойства простых веществ — неметаллов.
В простых веществах атомы неметаллов связаны ковалентной неполярной связью. Благодаря этому формируется более устойчивая электронная система, чем у изолированных атомов. При этом образуются одинарные (например, в молекулах водорода Н2, галогенов F2, Br2, I2), двойные (например, в молекулах серы S2), тройные (например, в молекулах азота N2) ковалентные связи.
- ЗАПОМНИ. Многие химические элементы-неметаллы образуют несколько простых веществ — аллотропных модификаций.
Простые вещества — неметаллы могут иметь:
1. Молекулярное строение. При обычных условиях большинство таких веществ представляют собой газы (Н2, N2, O2, F2, Cl2, O3) или твердые вещества (I2, P4, S8), и лишь один-единственный бром (Br2) является жидкостью. Все эти вещества имеют молекулярное строение, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярного взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
2. Атомное строение. Эти вещества образованы длинными цепями атомов (Cn, Bn, Sin, Sen, Ten). Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением ковалентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала.
- ЗАПОМНИ. Все неметаллы — диэлектрики, т. к. их внешние электроны использованы на образование химических связей.
Многие элементы-неметаллы образуют несколько простых веществ — аллотропных модификаций. Это свойство атомов называют аллотропией. Аллотропия может быть связана и с разным составом молекул (O2, О3), и с разным строением кристаллов. Аллотропными модификациями углерода являются графит, алмаз, карбин, фуллерен.
Чтобы выявить свойства, характерные для всех неметаллов, надо обратить внимание на их расположение в периодической системе элементов и определить конфигурацию внешнего электронного слоя (табл. 5).
Таблица 5
Конфигурация внешнего электронного слоя атомов неметаллов
Номер периода | Номер группы | Элементы | Число электронов на внешнем слое |
1 | I | Н | 1s1 |
2 | III | В | 2s22р1 |
3 | IV | С, Si | ns2np2 |
4 | V | N, P, As | ns2np3 |
5 | VI | O, S, Se, Te | ns2np4 |
6 | VII | F, Cl, Br, I, At | ns2np5 |
В периоде:
· заряд ядра увеличивается;
· радиус атома уменьшается;
· число электронов внешнего слоя увеличивается;
· электроотрицательность увеличивается;
· окислительные свойства усиливаются;
· неметаллические свойства усиливаются.
В главной подгруппе:
· заряд ядра увеличивается;
· радиус атома увеличивается;
· число электронов на внешнем слое не изменяется;
· электроотрицательность уменьшается;
· окислительные свойства ослабевают;
· неметаллические свойства ослабевают.
Для большинства металлов, за редким исключением (золото, медь и некоторые другие), характерна серебристо-белая окраска. А вот у простых веществ — неметаллов гамма цветов значительно разнообразнее: P, Seаморф. — желтые; Bаморф. — коричневый; О2(ж) — голубой; Si, Asмет. — серые; Р4 — бледно-желтый; I1(г.) — фиолетово-черный с металлическим блеском;Br2(ж.) — бурая жидкость; Cl2(г.) — желто-зеленый; F2(г.) — бледно-зеленый; S8(тв.) — желтая. Кристаллы неметаллов непластичны, и любая деформация вызывает разрушение ковалентных связей. Большинство неметаллов не имеют металлического блеска.
