20.01.23г. ПЯТНИЦА 401,505,501
РАСПИСАНИЕ ЗАНЯТИЙ
НА НЕДЕЛЮ: 16.01.23Г.-20.01.23
|
|
|||||
|
1,2 |
306 |
508 |
406 |
- |
401 |
|
3,4 |
401 |
505 |
505 |
501 |
505 |
|
5 |
401 |
505 |
401 |
306 |
- |
|
6,7 |
408 |
501 |
- |
508 |
501 |
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 401 ХИМИЯ 23,24
ТЕМА 23,24:Химические свойства алканов (метана, этана): горение, замещение, разложение, дегидрирование.
Применение алканов на основе свойств.
Химические свойства алканов (метана, этана): горение, замещение, разложение, дегидрирование. Применение алканов на основе свойств. Ознакомление с коллекцией образцов нефти и продуктов ее переработки.
Физические и химические свойства алканов
Метан и его газообразные гомологи (до бутана включительно) содержатся в природном и попутном нефтяном газах. Жидкие алканы — основная часть нефти. Твёрдые предельные углеводороды (парафин) растворены в нефти, которая и служит источником их получения.
При обычных условиях алканы не реагируют с концентрированными кислотами и щелочами, не окисляются сильными окислителями, такими как перманганат калия.
Однако при нагревании химическое поведение алканов резко меняется. Все алканы горят бледно-голубым пламенем с образованием углекислого газа и воды:
Горение алканов сопровождается выделением большого количества теплоты, что определяет их использование в качестве топлива.
Следует помнить, что углеводороды относятся к пожаро- и взрывоопасным веществам. Утечка бытового газа грозит страшными последствиями. Для того чтобы вовремя обнаружить наличие в воздухе бытового газа, к нему добавляют вещества с резким неприятным запахом — одоранты. Если вы почувствовали на кухне, в подъезде или на улице запах газа, следует немедленно обратиться в экстренную службу по телефону 104, проветрить помещение и ни в коем случае не пользоваться открытым огнём или электроприборами. В случае пожара службу спасения вызывают по телефону 101 или 112 (с сотового телефона бесплатно).
Предельные углеводороды используют не только как топливо, но и в качестве сырья для химической промышленности, поскольку их свойства отнюдь не ограничиваются реакцией горения.
В предельных углеводородах атомы водорода могут замещаться другими атомами или группами, в частности атомами галогенов (хлора и брома). Эти реакции замещения протекают ступенчато при освещении смеси газов: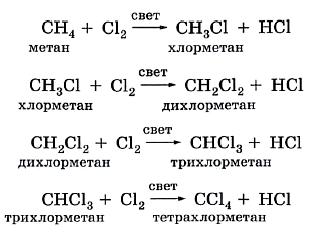
Галогенпроизводные алканов — прекрасные растворители, хладагенты (рабочие жидкости, которыми заправляют бытовые холодильники и промышленные холодильные установки), реагенты для органического синтеза.
Если предельные углеводороды нагревать без доступа воздуха при более высокой температуре, то они не выдерживают такого воздействия и разлагаются. Например, из метана при нагревании свыше 1000 °С образуется два ценных продукта — сажа (углерод) и водород:![]()
Сажу, полученную таким образом, используют для изготовления автомобильных шин и резины, она входит в состав красок и туши.
Алканы с неразветвлённой цепью углеродных атомов при нагревании превращаются в более устойчивые соединения с разветвлённой цепью. Например, из н-бутана можно получить изобутан:
Поскольку состав исходного вещества и продукта реакции одинаков, эти соединения являются изомерами. Именно поэтому такой процесс получил название реакция изомеризации.
При нагревании в присутствии катализатора алканы способны вступать в реакцию отщепления. Что же могут отщеплять молекулы предельных углеводородов? Если предположить, что углеродная цепь остаётся без изменения, то отщепляться могут только молекулы водорода.
| Реакцию, при которой от молекулы органического вещества отщепляется молекула водорода, называют реакцией дегидрирования. |
При дегидрировании этана образуются два продукта — этилен и водород:
Этилен С2Н4 — представитель непредельных углеводородов, о которых пойдёт речьПОЗЖЕ .
Тема: Применение алканов на основе свойств.
Области применения алканов связаны с их физико-химическими свойствами:
Таблица «Предельные углеводороды
(алканы, парафины)»

ГРУППА 505 ХИМИЯ 11,12
ТЕМА 11,12:Особенности строения электронных оболочек атомов элементов больших периодов (переходных элементов). Понятие об орбиталях. s-, р- и d-Орбитали
Электронные конфигурации атомов химических элементов.
Моделирование построения Периодической таблицы химических элементов.
Состояние электронов в атоме. Строение атомов элементов больших и малых периодов.
По современным представлениям атом состоит из положительно заряженного ядра и движущихся вокруг него электронов. В ядре содержатся протоны и нейтроны. Число протонов, а также электронов равно порядковому номеру элемента.
Частица масса заряд
Протон 1 +1
Нейтрон 1 0
Электрон ≈ 0 – 1
Сумма протонов и нейтронов численно равна относительной атомной массе элемента.
Пространство вокруг ядра, в котором наиболее вероятно место нахождения электрона, называется орбиталью или электронным облаком. Формы электронных облаков различны (s, p, d, f ); О – s- орбиталь ; ∞ – p- орбиталь
Электронные облака d и f имеют более сложную форму.
Электроны, двигаясь в пространстве вокруг ядра , образуют его электроннуюоболочку, которая делится на электронные слои или уровни. Распределение электронов по электронным слоям (уровням) можно представить следующим образом: +1 H ) +6 C ) ) +12 Mg ) ) )
1 2 4 2 8 2
Максимальное число электронов в электронном слое (уровне) определяется по формуле: N = 2 n 2, где n – номер электронного слоя (уровня).
Число электронных слоев (уровней) равно номеру периода, в котором находится элемент. Уровни делятся на подуровни (s, p, d, f) и заполняются электронами в определенной последовательности. В зависимости от того, какой подуровень последним заполняется электронами, все элементы делятся на 4 семейства: s, p, d, f – элементы. Число валентных электронов (участвующих в образованиихимических связей) численно равно номеру группы.
Электронная конфигурация атомов отображается с помощью электронных формул, например, атом водорода имеет электронную конфигурацию: 1 S1
А атом углерода – 1 S 2 2 S 2 2 P 2.
У элементов малых и больших периодов строение электронных оболочек атомов отличается. В малых периодах слева направо число внешних электронов увеличивается резко – от 1 до 8 и свойства элементов также меняются резко - от металлическим к неметаллическим. Так, в начале 3 периода стоит типичный металл натрий (легко отдает 1 электрон внешнего уровня), а в конце периода – типичный неметалл хлор (легко присоединяет 1 электрон до завершения уровня). Завершает период аргон – инертный газ.
Свойства соединений элементов изменяются от основных к кислотным через амфотерные. Оксиды натрия и магния – основные, оксид алюминия – амфотерный, а оксиды кремния, фосфора, серы и хлора – кислотные.
Большие периоды состоят из 2-х рядов. В четных рядах больших периодов на внешнем уровне число эдектронов не меняется (равно 1 или 2), идет дозаполнение предыдущего снаружи уровня (d – подуровень, элементы «вставных» декад), поэтому свойства элементов меняются плавно, здесь все элементы – металлы. В нечетных рядах число внешних эектронов снова резко растет, как в малом периоде, от 1 до 8 и свойства элементов снова меняются резко - от металлических к неметаллическим. Однако, в целом, в начале любого большого периода – типичные металлы, а в конце – типичные неметаллы, т. е. при переходе от одного периода к другому наблюдается периодичность изменения свойств элементов, а значит, и их соединений. Свойства элементов, их оксидов, гидратов этих оксидов (и водородных соединений элементов главных подгрупп) периодически повторяются
В группах (в главных подгруппах) сверху вниз, с ростом заряда ядра и радиуса атома металлические свойства усиливаются, а неметаллические ослабевают, основность соединений в подгруппе сверху вниз усиливается.
ЗАДАНИЕ: ПРОЧИТАЙТЕ ВИМАТЕЛЬНО.
1. ПРЕПИШИТЕ И ВЫУЧИТЕ ПРАВИЛА ПАУЛИ И ХУНДА
2. Составьте схемы электронного строения, электронные формулы и графические электронные формулы атомов следующих химических элементов: Са, Fе, Zr, Sn, Nb, Hf, Ра.
Швейцарский физик В. Паули в 1925 г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского «веретено»), то есть обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемой оси: по часовой или против часовой стрелки. Этот принцип носит название принципа Паули.
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, то есть электроны с противоположными спинами.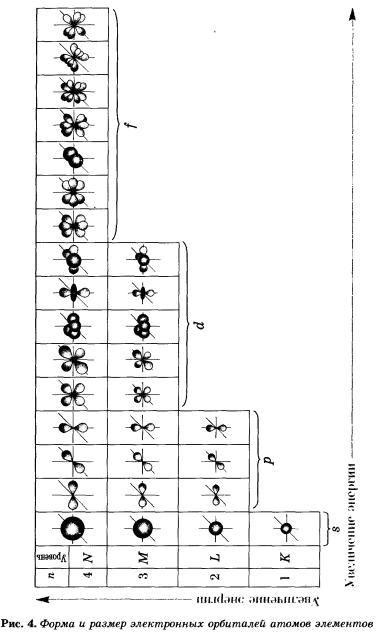
На рисунке 5 показана схема подразделения энергетических уровней на подуровни.
s-Орбиталь, как вы уже знаете, имеет сферическую форму. Электрон атома водорода (s = 1) располагается на этой ор-битали и неспарен. Поэтому его электронная формула или электронная конфигурация будет записываться так: 1s1. В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой (1 ...), латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа вверху от буквы (как показатель степени), показывает число электронов на подуровне.
Для атома гелия Не, имеющего два спаренных электрона на одной s-орбитали, эта формула: 1s2.
Электронная оболочка атома гелия завершена и очень устойчива. Гелий — это благородный газ.
На втором энергетическом уровне (n = 2) имеется четыре орбитали: одна s и три р. Электроны s-орбитали второго уровня (2s-орбитали) обладают более высокой энергией, так как находятся на большем расстоянии от ядра, чем электроны 1s-орбитали (n = 2).
Вообще, для каждого значения n существует одна s-орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере увеличения значения n.
р-Орбиталь имеет форму гантели или объемной восьмерки. Все три р-орбитали расположены в атоме взаимно перпендикулярно вдоль пространственных координат, проведенных через ядро атома. Следует подчеркнуть еще раз, что каждый энергетический уровень (электронный слой), начиная с n = 2, имеет три р-орбитали. С увеличением значения n электроны анимают р-орбитали, расположенные на больших расстояниях от ядра и направленные по осям х, у, г.
У элементов второго периода (n = 2) заполняется сначала одна в-орбиталь, а затем три р-орбитали. Электронная формула 1л: 1s22s1. Электрон слабее связан с ядром атома, поэтому атом лития может легко отдавать его (как вы, очевидно, помните, этот процесс называется окислением), превращаясь в ион Li+.
В атоме бериллия Ве0 четвертый электрон также размещается на 2s-орбитали: 1s22s2. Два внешних электрона атома бериллия легко отрываются — Ве0 при этом окисляется в катион Ве2+.
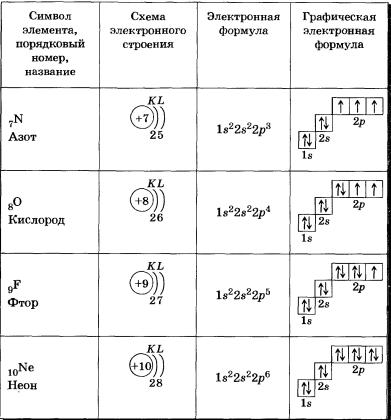
У атома бора пятый электрон занимает 2р-орбиталь: 1s22s22р1. Далее у атомов С, N, О, Е идет заполнение 2р-орбиталей, которое заканчивается у благородного газа неона: 1s22s22р6.
У элементов третьего периода заполняются соответственно Зв- и Зр-орбитали. Пять d-орбиталей третьего уровня при этом остаются свободными:
11Nа 1s22s2Зв1; 17С11в22822р63р5; 18Аг П^Ёр^Зр6.
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, то есть записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул.
У элементов больших периодов (четвертого и пятого) первые два электрона занимают соответственно 4я- и 5я-орбитали: 19К 2, 8, 8, 1; 38Sr 2, 8, 18, 8, 2. Начиная с третьего элемента каждого большого периода, последующие десять электронов поступят на предыдущие 3d- и 4d- орбитали соответственно (у элементов побочных подгрупп): 23V 2, 8, 11, 2; 26Tr 2, 8, 14, 2; 40Zr 2, 8, 18, 10, 2; 43Тг 2, 8, 18, 13, 2. Как правило, тогда, когда будет заполнен предыдущий d-подуровень, начнет заполняться внешний (соответственно 4р- и 5р ) р-подуровень.
У элементов больших периодов — шестого и незавершенного седьмого — электронные уровни и подуровни заполняются электронами, как правило, так: первые два электрона поступят на внешний в-подуровень: 56Ва 2, 8, 18, 18, 8, 2; 87Гг 2, 8, 18, 32, 18, 8, 1; следующий один электрон (у Nа и Ас) на предыдущий (p-подуровень:57Lа 2, 8, 18, 18, 9, 2 и 89Ас 2, 8, 18, 32, 18, 9, 2.
Затем последующие 14 электронов поступят на третий снаружи энергетический уровень на 4f- и 5f-орбитали соответственно у лантаноидов и актиноидов.
Затем снова начнет застраиваться второй снаружи энергетический уровень (d-подуровень): у элементов побочных подгрупп: 73Та 2, 8,18, 32,11, 2; 104Rf 2, 8,18, 32, 32,10, 2, — и, наконец, только после полного заполнения десятью электронами сйгоду-ровня будет снова заполняться внешний р-подуровень:
86Rn 2, 8, 18, 32, 18, 8.
Очень часто строение электронных оболочек атомов изображают с помощью энергетических или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки (орбитали), располагаются в них сначала по одному и имеют при этом одинаковое значение спина, а лишь затем спариваются, но спины при этом по принципу Паули будут уже противоположно направленными.
В заключение еще раз рассмотрим отображение электронных конфигураций атомов элементов по периодам системы Д. И. Менделеева. Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).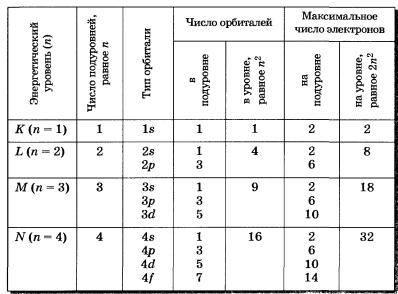
В атоме гелия первый электронный слой завершен — в нем 2 электрона.
Водород и гелий — s-элементы, у этих атомов заполняется электронами s-орбиталь.
Элементы второго периода
У всех элементов второго периода первый электронный слой заполнен и электроны заполняют е- и р-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала s-, а затем р ) и правилами Паули и Хунда (табл. 2).
В атоме неона второй электронный слой завершен — в нем 8 электронов.
Таблица 2 Строение электронных оболочек атомов элементов второго периода
Li, Ве — в-элементы.
В, С, N, О, F, Nе — р-элементы, у этих атомов заполняются электронами р-орбитали.
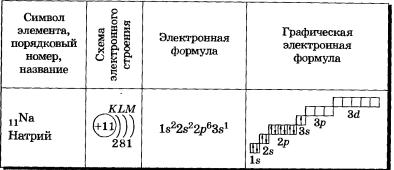
Элементы третьего периода
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать Зs-, 3р- и Зd-подуровни (табл. 3).
Таблица 3 Строение электронных оболочек атомов элементов третьего периода
У атома магния достраивается Зs-электронная орбиталь. Nа и Mg— s-элементы.
В атоме аргона на внешнем слое (третьем электронном слое) 8 электронов. Как внешний слой, он завершен, но всего в третьем электронном слое, как вы уже знаете, может быть 18 электронов, а это значит, что у элементов третьего периода остаются незаполненными Зd-орбитали.
Все элементы от Аl до Аг — р-элементы. s- и р-элементы образуют главные подгруппы в Периодической системе.
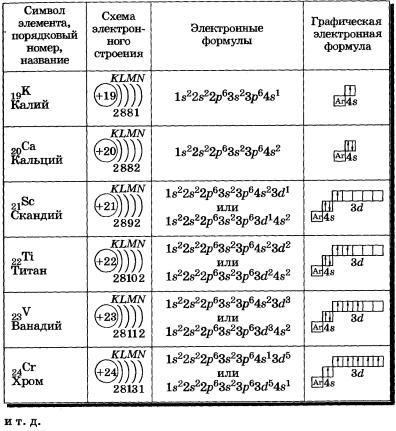
У атомов калия и кальция появляется четвертый электронный слой, заполняется 4s-подуровень (табл. 4), так как он имеет меньшую энергию, чем Зй-подуровень. Для упрощения графических электронных формул атомов элементов четвертого периода: 1) обозначим условно графическую электронную формулу аргона так:
Аr;
2) не будем изображать подуровни, которые у этих атомов не заполняются.
Таблица 4 Строение электронных оболочек атомов элементов четвертого периода
К, Са — s-элементы, входящие в главные подгруппы. У атомов от Sс до Zn заполняется электронами Зй-подуровень. Это Зй-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
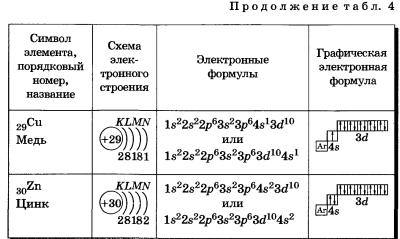
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с 4я- на Зй-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций Зd5 и Зd10:
В атоме цинка третий электронный слой завершен — в нем заполнены все подуровни 3s, Зр и Зd, всего на них 18 электронов.
У следующих за цинком элементов продолжает заполняться четвертый электронный слой, 4р-подуровень: Элементы от Gа до Кr — р-элементы.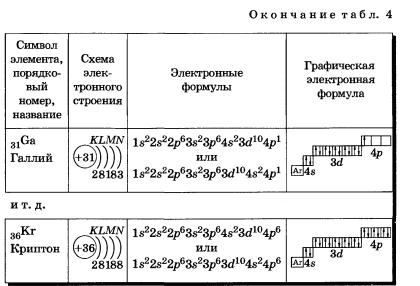
У атома криптона внешний слой (четвертый) завершен, имеет 8 электронов. Но всего в четвертом электронном слое, как вы знаете, может быть 32 электрона; у атома криптона пока остаются незаполненными 4d- и 4f- подуровни.
У элементов пятого периода идет заполнение подуровней в следующем порядке: 5s-> 4d -> 5р. И также встречаются исключения, связанные с «провалом» электронов, у 41Nb, 42MO и т.д.
В шестом и седьмом периодах появляются элементы, то есть элементы, у которых идет заполнение соответственно 4f- и 5f-подуровней третьего снаружи электронного слоя.
4f-Элементы называют лантаноидами.
5f-Элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: 55Сs и 56Ва — 6s-элементы;
57Lа... 6s25d1 — 5d-элемент; 58Се — 71Lu — 4f-элементы; 72Hf — 80Нg — 5d-элементы; 81Тl— 86Rn — 6р-элементы. Но и здесь встречаются элементы, у которых «нарушается» порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных f подуровней, то есть nf7 и nf14.
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, как вы уже поняли, делят на четыре электронных семейства или блока (рис. 7).
1) s-Элементы; заполняется электронами в-подуровень внешнего уровня атома; к s-элементам относятся водород, гелий и элементы главных подгрупп I и II групп;
2) р-элементы; заполняется электронами р-подуровень внешнего уровня атома; к р элементам относятся элементы главных подгрупп III—VIII групп;
3) d-элементы; заполняется электронами d-подуровень предвнешнего уровня атома; к d-элементам относятся элементы побочных подгрупп I—VIII групп, то есть элементы вставных декад больших периодов, расположенные между s- и р-элементами. Их также называют переходными элементами;
4) f-элементы, заполняется электронами f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и актиноиды.
ГРУППА 501 БИОЛОГИЯ 15,16
ТЕМА 15,16:Образование и-РНК по матрице ДНК. Генетический код. Биосинтез белков.
Образование и-РНК по матрице ДНК. Генетический код. Биосинтез белков.
Трудно, глядя на типографскую матрицу, судить о том, хорошая или плохая книга будет по ней напечатана. Невозможно судить и о качестве генетической информации по тому, «хороший» или «плохой» ген получили потомки по наследству, до тех пор, пока на основе этой информации не будут построены белки и не разовьется целый организм.
Ход образования и-РНК. К рибосомам, местам синтеза белков, из ядра поступает несущий информацию посредник, способный пройти через поры ядерной оболочки. Таким посредником является информационная РНК (и-РНК). Это одноцепочечная молекула, комплементарная одной нити молекулы ДНК. Специальный фермент — полимераза, двигаясь по ДНК, подбирает по принципу комплементарности нуклеотиды и соединяет их в единую цепочку (рис. 21). Процесс образования и-РНК называется транскрипцией (от лат. «транскрипцио» — переписывание). Если в нити ДНК стоит тимин, то полимераза включает в цепь и-РНК аденин, если стоит гуанин — включает цитозин, если аденин — то урацил (в состав РНК не входит тимин).
По длине каждая из молекул и-РНК в сотни раз короче ДНК. Информационная РНК — копия не всей молекулы ДНК, а только части ее, одного гена или группы рядом лежащих генов, несущих информацию о структуре белков, необходимых для выполнения одной функции. У прокариот такая группа генов называется опероном. В начале каждой группы генов находится своего рода посадочная площадка для полимеразы, называемая промотором. Это специфическая последовательность нуклеотидов ДНК, которую фермент «узнает» благодаря химическому сродству. Только присоединившись к промотору, полимераза способна начать синтез и-РНК. В конце группы генов фермент встречает сигнал (в виде определенной последовательности нуклеотидов), означающий конец переписывания. Готовая и-РНК отходит от ДНК, покидает ядро и направляется к месту синтеза белков — рибосоме, расположенной в цитоплазме клетки.
В клетке генетическая информация передается благодаря транскрипции от ДНК к белку:
ДНК—и-РНК—белок.
3. Генетический код — определенные сочетания нуклеотидов, несущих информацию о структуре белка, и последовательность их расположения в молекуле ДНК.\
Ген — участок молекулы ДНК, несущий информацию о структуре одной молекулы белка.
Свойства генетического кода:
— триплетность — одна аминокислота кодируется тремя рядом расположенными нуклеотидами — триплетом, или кодоном;
— универсальность — код един для всего живущего на Земле (у мха, сосны, амебы, человека, страуса и пр. одни и те же триплеты кодируют одни и те же аминокислоты);
— вырожденность — одной аминокислоте может соответствовать несколько триплетов (от двух до шести). Исключение составляют аминокислоты метионин и триптофан, каждая из которых кодируется только одним триплетом (метионин кодируется триплетом АУГ);
— специфичность — каждый триплет кодирует только одну аминокислоту.
Триплеты ГАА или ГАГ, занимающие шестое место в гене здоровых людей, несут информацию о цепи гемоглобина, кодируя глутаминовую кислоту. У больных серповидноклеточной анемией второй нуклеотид заменен на У, а триплеты ГУА и ГУГ кодируют валин;
— неперекрываемость — кодоны одного гена не могут одновременно входить в соседний;
— непрерывность — в пределах одного гена считывание генетической информации происходит в одном направлении.
4. Трансляция – механизм, с помощью которого последовательность триплетов оснований иРНК переводится в специфическую последовательность аминокислот в полипептидной цепи.
Подготовительным этапом трансляции является рекогниция – активирование и присоединение аминокислоты к тРНК (фермент аминоацил-тРНК-синтетаза (кодаза)).
Затем иРНК соединяется с рибосомой (у прокариот начинается синтез с кодона АУГ, с которым взаимодействует антикодон особой тРНК (с формилметионином)), затем первая тРНК доставляет сюда первую аминокислоту (для каждой аминокислоты есть своя тРНК) и связывается с определенным участком иРНК по принципу комплементарности (антикодон тРНК соответствует кодону иРНК).
Происходит связывание с иРНК и с рибосомой второй тРНК, несущей вторую аминокислоту. Первая и вторая аминокислоты соединяются пептидной связью (фермент пептидил-трансфераза). Затем рибосома перемещается на один триплет вперед, первая тРНК освобождается, приходит третья тРНК. Рибосома перемещается по молекуле иРНК прерывисто, триплет за триплетом, делая каждый из них доступным для контакта с тРНК. Сущность трансляции в подборе по принципу комплементарности антикодона тРНК к кодону иРНК. Если антикодон тРНК соответствует кодону иРНК, то аминокислота, доставляемая такой тРНК, включается в полипептидную цепь, и рибосома перемещается на следующий триплет (фермент транслоказа).
Как только рибосома дойдет до стоп-кодона иРНК, происходит распад комплекса, полипептид отделяется от матрицы-иРНК и приобретает свою конформацию.
Для трансляции необходимы ферменты (кодаза, пептидил-трансфераза, транслоказа), энергия АТФ, ионы Mg2+.
Таким образом, главными этапами трансляции являются:
1) присоединение иРНК к рибосоме;
2) рекогниция (активация аминокислоты и ее присоединение к тРНК);
3) инициация (начало синтеза) полипептидной цепи;
4) элонгация (удлинение) цепи;
5) терминация (окончание синтеза) цепи;
6) дальнейшее использование иРНК (или ее разрушение).