|
|
Решение:
1. Найдём, сколько чистого карбида кальция вступит в реакцию. В
техническом карбиде кальция массовая доля CаС2 составляет 80%:
m(CаС2)
= 130 × 0,8 = 104 кг.
2. Вычислим, какое вещество полностью вступило в реакцию. Для этого
составим уравнение реакции и запишем под формулами данные по условию задачи:
хкг 9 кг
CаС2 + 2Н2О = C2H2 + Са(ОН)2.
64 кг 36 г
Mr(CаС2)
= 64
М(CаС2) = 64 кг/моль
m(CаС2)
= 64 кг
Mr(Н2О) = 18
М(Н2О) = 18 кг/моль
m(Н2О) = 2 моль × 18 кг/моль = 36 кг
Составляем пропорцию:
на 64 кг
CаС2 потребуется 36 кг Н2О
на х кг CаС2_______ 9 кг Н2О;
9 × 64
x = --------- = 16 кг CаС2.
36
CаС2 дан в избытке.
3. Определим объём выделившегося ацетилена. Расчёт ведём по воде:
94
9 кг х м3
CаС2 + 2Н2О = C2H2 + Са(ОН)2.
36 кг 22,4 м3
Если вступит 36 кг
Н2О, то выделится 22,4
м3 C2H2;
если вступит 9 кг
Н2О, то выделится х м3 C2H2.
9 × 22,4
x = ------------ = 5,6 м3 C2H2.
36
Ответ: Выделилось 5,6 м3 C2H2, CаС2 дан
в избытке.
|
Задача 12. При нитровании 0,4 моль толуола потребовалось 150 г 94,6%-ной
азотной кислоты. Вычислите массу тринитротолуола.
|
Дано:
ν(C6H5СH3)=0,4
моль
m р-ра HNO3= 150г
w — 94,6%
Найти:
m(C6H2(NO2)3CH3)
= ?
|
Решение:
1. Вычислим, какое количество вещества азотной кислоты содержится в 150 г раствора
94,6%-ной концентрации.
m(НNO3) = 150 · 0,946 = 141,9 г ~ 142 г
ν(НNO3) = 142 г × 63 г/моль ~ 2,25 моль
2. Вычислим, какое вещество полностью вступило в реакцию. Для этого составим
уравнение реакции и запишем над/под формулами данные по условию задачи:
0,4 моль х моль
C6H5СH3+3HNO3 = C6H2(NO2)3CH3 + Н2О;
1 моль 3 моль
на 1мольC6H5СH3 потребуется3моль
HNO3
на0,4 моль C6H5СH3
-----------х моль HNO3;
Х = 1,2 моль HNO3.
Азотная кислота взята в избытке.
1. Вычислим массу образовавшегося тринитротолуола:
0,4 моль х моль
C6H5СH3+3HNO3 = C6H2(NO2)3CH3
+ Н2О.
1 моль 1 моль
Образуется 0,4 моль тринитротолуола или 227 г/моль × 0,4 моль = 90,8 г.
Ответ: Масса тринитротолуола равна 90,8 г.
|
Задача 14. Вычислите массу сложного эфира,
полученного из 200 мл 96%-ного раствора этанола (плотность раствора
0,8 г/мл) и 120 г
уксусной кислоты.
|
Дано:
Vр-ра(С2Н5ОН)=200 мл
w(С2Н5ОН)=96% =0,96
r = 0,8 г/мл
m (CH3COOH)=120г
Найти:
m сложного эфира = ? M = 60 г/моль m = 60
|
Решение:
1. Вычислим массу раствора этилового спирта:
m р-ра С2Н5ОН = 200 мл × 0,8 г/мл = 160 г.
2. Вычислим массу этанола в 160 г раствора 96%-ной концентрации:
m (С2Н5ОН) = 160 × 0,96 = 153,6 г.
1.
Вычислим, какое
вещество полностью прореагировало:
120г CH3COOH+С2Н5ОН=CH3COOС2Н5
+ H2О.
60 г 46 г
М(CH3COOH)= 60 г/моль
М(С2Н5ОН) = 46 г/моль
Составляем пропорцию:
60 г CH3COOH --------------- 46 г С2Н5ОН
120 г CH3COOH--------------- х г С2Н5ОН;
120×46
Х = ------- = 92 г С2Н5ОН.
60
Следовательно, этанол дан в избытке.
2.
Вычислим массу,
образовавшегося сложного эфира, если в реакцию вступило 120 г уксусной кислоты:
120г CH3COOH+С2Н5ОН®CH3COOС2Н5+H2О.
60 г 88 г
М(CH3COOС2Н5) = 88 г/моль
60г СН3СООН
----------88 г
CH3COOС2Н5
120гСН3СООН----------
х г CH3COOС2Н5;
120 × 88
х = ------------ = 176 г CH3COOС2Н5.
60
Ответ:
Образовалось 176 г
сложного эфира.
|
Задача 15.
Рассчитайте, какое количество теплоты выделится при сгорании 5 м3
метана (н. у.) и какое количество вещества кислорода потребуется на это
горение. Термохимическое уравнение реакции горения метана:
СН4(г.) +
2О2(г.) = СО2(г.) + 2Н2О(г.) + 803 кДж.
|
Дано:
Термохимическое
уравнение реакции:
СН4(г.) + 2О2(г.) = СО2(г.)
+ 2Н2О(г.) + 803 кДж
V(СН4)
= 5 м3
Найти:
Q = Х кДж ?
ν(О2)
= ?
|
Решение:
1. Вычислим, какое
количество теплоты выделится при сгорании 5 м3
метана. Для этого запишем термохимическое уравнение реакции:
5
м3 х кДж
СН4(г.) + 2О2(г.) = СО2(г.)
+ 2Н2О(г.) + 803 кДж.
22,4 м3
Составляем
пропорцию:
при сгорании 22,4 м3СН4
выделилось 803 кДж
при сгорании 5 м3 СН4
-------------Х кДж;
5×803
Х = --------- = 179,2 кДж.
22,4
2. Вычислим, какое
количество вещества кислорода потребуется на горение 5 м3 метана:
5 м3 х
моль
СН4(г.) +
2О2(г.)=СО2(г.) + 2Н2О(г.) + 803 кДж.
22,4 м3 2 моль
Составляем
пропорцию:
при сгорании 22,4м3СН4
потребовалось 2моль О2
при
сгорании 5 м3
СН4 ------------- Х моль О2;
5×2
Х = ----- = 0,45 моль О2.
22,4
Ответ:
Выделилось 179,2 кДж
и потребуется 0,45 моль кислорода на сжигание 5 м3
метана.
|
Задача 16.
Составьте термохимическое уравнение реакции горения метилового спирта, при
сжигании 0,8 г которого выделилось 18,2 кДж теплоты.
|
Дано:
m(СН3ОН)
= 0,8 г
Q = 18,2 кДж
Составьте
термохимическое уравнение.
|
Решение:
1. Запишем уравнение
химической реакции горения метанола и данные, соответствующие уравнению
реакции, и данные условия задачи:
0,8 г 18,2 кДж
2СН3ОН + 3О2
=2CO2 + 4Н2О
+ Q;
64 г х
кДж
М(СН3ОН)
= 32 г/моль;
m(СН3ОН)
= 32г/моль × 2 моль = 64 г;
64 г СН3ОН ---------------х кДж
0,8 г СН3ОН
-------------- 18,2 кДж;
64
· 18,2
Х = ------------------- = 1456 кДж.
0,8
2. Составим
термохимическое уравнение реакции:
2СН3ОН(ж.)
+ 3О2(г.) = 2СО2(г.) + 4 Н2О(г.) + 1456 кДж.
Ответ: 2СН3ОН(ж.)
+ 3О2(г.) = 2СО2(г.) + 4 Н2О(г.) + 1456 кДж.
|
Задача 17.
При взаимодействии 50 г
22%-ного раствора сульфида калия с избыточным количеством уксусной кислоты
выделилось 2 л
сероводорода (н. у.). Какова объёмная доля выхода данного продукта реакции
от теоретически возможного (%) ?
|
Дано:
m(р-раК2S)= 50 г
W(К2S)=22% (0,22)
V(Н2S) = 2
л
Найти:
η — (%) = ?
|
Решение:
1. Найдём массу сульфида
калия, содержащуюся в 50 г
22%-ного его раствора:
m(K2S) = 50
× 0,22 = 11 г.
2. Вычислим
теоретически возможный выход сероводорода:
11 г х л
К2S + 2СН3СООН = 2СН3СООК + Н2S;
110 г 22,4 л
М(К2S) = 110 г/моль;
m(К2S) = 110 г/моль · 1 моль = 110 г;
110 г K2S ---------- 22,4 л Н2S
11 г К2S ---------- х л Н2S;
11 × 22,4
Х = ------------- = 2,24 л Н2S.
110
Теоретически
возможный выход
сероводорода
составляет 2,24 л.
3. Рассчитаем объёмную
долю выхода сероводорода от теоретически возможного:
2,24 л Н2S составляют 100%
2 л Н2S ------------
х %;
2 × 100
Х = ----------- = 89,3 %.
2,24
Ответ: 89,3 %.
|
Задача 18.
Вычислите массу соли, образовавшейся в результате взаимодействия 11,2 г
оксида кальция с раствором, содержащем 25,6 г уксусной кислоты, если
известно, что выход соли составил 80% от теоретически возможного.
|
Дано:
m(СаО) =
11,2 г
m(СН3СООН)
= 25,6 г
η(Ca(СН3СОО)2 =80 %
Найти:
m(Ca(СН3СОО)2 = ?
|
Решение:
1. Определим, какое
из реагирующих веществ полностью вступит в реакцию:
Mr(CaO) = 56; М(CaO) =
56 г/моль;
m(CaO) =
56 г/моль · 1 моль = 56 г;
Mr(СН3СООН)
= 60; М(СН3СООН) = 60 г/моль ;
m(СН3СООН)
= 60 г/мль · 2 моль = 120 г;
Mr(Ca(СН3СОО)2)=158; М (Ca(СН3СОО)2 = 158 г/моль;
m(Ca(СН3СОО)2 =158
г/моль · 1 моль=158 г.
11,2 г х г у г
CaO + 2СН3СООН
=Са(СН3СОО) 2 + Н2О;
56 г 120 г 158 г
11,2 г CaO ---------х г СН3СООН
56 г CaO --------- 120 г СН3СООН;
11,2 × 120
Х = ------------- = 24 г.
56
Уксусная кислота
дана в избытке. Оксид кальция полностью вступил в реакцию, поэтому вычисление
массы ацетата кальция будем проводить по оксиду кальция.
2. Вычислим
теоретически возможный выход cоли:
11,2 г CaO –—
у г Са(СН3СОО)2
56 г CaO –––
158 г
Са(СН3СОО)2;
11,2 × 158
у = ------------------ = 31,6 г.
56
3. Рассчитаем практический выход ацетата rальция:
31,6 г · 0,8 = 25,28 г .
Ответ: Масса соли,
полученной в результате реакции, составляет 25,28 г.
|
Задача 19. При получении этилового спирта в результате реакции гидратации этилена
производственные потери составили 30 %.
Вычислите массу этилового спирта, которую получат при гидратации 500 литров этилена
(н. у.).
|
Дано:
V(C2H4) = 500
л
η = 70%
Найти:
m(C2H5OH) = ?
|
Решение:
1. Вычислим
теоретически возможный
выход продукта
реакции:
500 л х г
C2H4 + Н2О = C2H5OН;
22,4 л 46 г
500 × 46
Х = -------------- = 1026,8 г (С2Н5ОН)
.
22,4
2. Вычислим
практический выход
этилового спирта:
100% – 30% = 70%
(0,7)
m(C2H5OH) = 1026,8
г · 0,7 = 718,76 г.
Ответ: m(C2H5OH) = 718,76 г.
|
Задача 1 При сгорании органического вещества массой 4,8 г образовалось 3,36 л. CO2 (н.у.) и 5,4 г воды. Плотность паров органического вещества по водороду равна 16. Определите молекулярную формулу исследуемого вещества. Решение: Продукты сгорания вещества состоят из трех элементов: углерода, водорода, кислорода. При этом очевидно, что в состав этого соединения входил весь углерод, содержащийся в CO2, и весь водород, перешедший в воду. А вот кислород мог присоединиться во время горения из воздуха, а мог и частично содержаться в самом веществе. Для определения простейшей формулы соединения нам необходимо знать его элементный состав. Найдем количество продуктов реакции (в моль): n(CO2) = V(CO2) / VM = 3,36 л : 22,4 л/моль = 0,15 моль n(H2O) = m(H2O) / M(H2O) = 5,4 г : 18 г/моль = 0,3 моль Следовательно, в состав исходного соединения входило 0,15 моль атомов углерода и 0,6 моль атомов водорода: n(H) = 2n(H2O), так как в одной молекуле воды содержатся два атома водорода. Вычислим их массы по формуле: m = n х M m(H) = 0,6 моль х 1 г/моль = 0,6 г m(С) = 0,15 моль х 12 г/моль = 1,8 г Определим, входил ли кислород в состав исходного вещества: m(O) = 4,8 - (0,6 + 1,8) = 2,4 г Найдем число моль атомов кислорода: n(O) = m(O) / M(O) = 2,4 г : 16 г/моль = 0,15 моль Соотношение числа атомов в молекуле исходного органического соединения пропорционально их мольным долям: n(CO2) : n(H) : n(O) = 0,15 : 0,6 : 0,15 = 1 : 4 : 1 Самую маленькую из этих величин (0,15) принимаем за 1, а остальные делим на нее. Итак, простейшая формула исходного вещества CH4O. Однако по условию задачи требуется определить молекулярную формулу, которая в общем виде такова: (CH4O)х. Найдем значение x. Для этого сравним молярные массы исходного вещества и его простейшей формулы: x = M(CH4O)х / M(CH4O) Зная относительную плотность исходного вещества по водороду, найдем молярную массу вещества: M(CH4O)х = M(H2) х D(H2) = 2 г/моль х 16 = 32 г/моль x = 32 г/моль / 32 г/моль = 1 Есть и второй вариант нахождения x (алгебраический): 12x + 4x + 16x = 32; 32 x = 32; x = 1 Ответ: Формула исходного органического вещества CH4O. Задача 2 В лабораторной установке из 120 л ацетилена (н.у.) получили 60 г бензола. Найдите практический выход бензола. Решение: 3C2H2 (650 оС, активированный уголь) = C6H6 n(C2H2) = V(C2H2)/ VM = 120 л : 22,4 л/моль = 5,35 моль n(C6H6)теор = 1/3 х n(C2H2) = 1/3 х 5,35 моль = 1,785 моль n(C6H6)практ = m(C6H6)/ M(C6H6) = 60 г : 78 г/моль = 0,77 моль h = (nпракт : nтеор) х 100% = (0,77 : 1,785) х 100% = 43% Ответ: 43%. Задача 3 Какой объем водорода (н.у.) получится при взаимодействии 2 моль металлического натрия с 96%-ным (по массе) раствором этанола в воде (V = 100 мл, плотность d = 0,8 г/мл). Решение: В условии задачи даны количества обоих реагентов - это верный признак того, что какой-нибудь из них находится в избытке. Найдем массу этанола, введенного в реакцию: m(раствора) = V х d = 100 мл х 0,8 г/мл = 80 г m(C2H5OH) = {m(раствора) х w%} : 100% = 80 г х 0,96 = 76,8 г Найдем заданное количество этанола в моль: n(C2H5OH) = m(C2H5OH) / M(C2H5OH) = 76,84 г : 46 г/моль = 1,67 моль Поскольку заданное количество натрия составляло 2 моль, натрий в нашей задаче присутствует в избытке. Поэтому объем выделенного водорода будет определяться количеством этанола: n1(H2) = 1/2 n(C2H5OH) = 1/2 х 1,67 моль = 0,835 моль V1(H2) = n1(H2) х VM = 0,835 моль х 22,4 л/моль = 18,7 л Но это еще не окончательный ответ. Будьте внимательны! Вода, содержащаяся в растворе спирта, тоже реагирует с натрием с выделением водорода. Найдем массу воды: m(H2O) = {m(раствора) х w%} : 100% = 80 г х 0,04 = 3,2 г n(H2O) = m(H2O)/M(H2O) = 3,2 г : 18 г/моль = = 0,178 моль Количество натрия, оставшееся неизрасходованным после реакции с этанолом, составит: n(Na, остаток) = 2 моль - 1,67 моль = 0,33 моль Таким образом, и по сравнению с заданным количеством воды (0,178 моль) натрий все равно оказывается в избытке. Найдем количество и объем водорода, выделившегося по реакции: n2(H2) = 1/2 n(H2O) = 1/2 х 0,178 моль = 0,089 моль V2(H2) = n2(H2) х VM = 0,089 моль х 22,4 л/моль = 1,99 л Общий объем водорода: V(H2) = V1(H2) + V2(H2) = 18,7 л+ 1,99 л = 20,69 л Ответ: V(H2) = 20,69 л. Задача 4 Какой объем воздуха (н.у.) потребуется для сжигания смеси, состоящей из 5 л метана и 15 л ацетилена? Решение: 1) CH4 + 2O2 = CO2 + 2H2O на 1 моль CH4 -- 2 моль 2O2 2) 2C2H2 + 5O2 = 4CO2 + 2H2O на 2 моль 2C2H2 -- 5 моль 2O2 Объем кислорода, который пойдет на сжигание заданного объема метана V1(O2) и ацетилена V2(O2), составит: V1(O2) = 2V(CH4) = 2 х 5 = 10 л V2(O2) = 5/2 V(C2H2) = 5/2 х 15 = 37,5 л V(O2) = V1(O2) + V2(O2) = 10 л + 37,5 л = 47,5 л Отсюда рассчитаем объем воздуха на сжигание (содержание кислорода в воздухе принимаем равным 21% по объему): V(воздуха) = V(O2) : 0,21 = 47,5 л : 0,21 = 226 л Ответ: V(воздуха) = 226 л Задача 5 Смесь этана и этилена объемом 200 мл (нормальные условия) обесцветила бромную воду массой 25 г. Рассчитайте объемную долю этанола в смеси, если массовая доля брома в бромной воде равна 3,2%. Решение: С бромной водой легко взаимодействует только этилен с образованием 1,2 – дибромэтана: C2H4 + Br2 → C2H4Br2 Определяем массу и количество вещества молекулярного брома, содержащегося в бромной воде: m (Br2) = m*ω(Br2)/100 ; m (Br2) = 25*3,2/100 = 0,8 г. n (Br2) =m(Br2)/M(Br2) ; n (Br2) = 0,8/160 = 0, 005 моль. Из уравнения реакции следует: n (C2H4) = n (Br2) ; n (C2H4) = 0,005 моль. Вычисляем объем этилена при нормальных условиях: V (C2H4) = n (C2H4)*Vm ; V (C2H4) = 0,005*22,4 = 0,112 л = 112 мл. Рассчитываем объемную долю этилена в исходной газовой смеси: ω (C2H4) = V(C2H4)/ V( Cсмеси) ; ω (С2Н4) = 112/200 = 0,56 или 56%. Ответ: 0,56 или 56%. Задача 6 Смесь бензола с циклогексеном массой 5 г обесцвечивает бромную воду массой 125 г ( массовая доля брома 3,2 %). Определите массу воды, которая образуется при сжигании в кислороде той же смеси массой 20 г. Решение: С бромной водой взаимодействует только один компонент смеси – циклогексен: C6H10 + Br2 → C6H10Br2 (а) Определяем массу и количество вещества брома вступившего в реакцию: m (Br2) = m( бромной воды) *ω (Br2)/100; m (Br2) = 125*3,2/100 = 4 г ; n (Br2) = m(Br2)/M(Br2); n (Br2) = 4/160 = 0,025 моль. Вычисляем массу и массовую долю циклогексена ( обозначаем его буквой Ц), вступившего в реакцию с бромом. Из уравнения реакции (а) следует n (Ц) = n(Br2) ; n(Ц) = 0,025 моль. Рассчитываем массу и массовую долю циклогексена в смеси: m(Ц) = n(Ц) * M(Ц); m(Ц) = 0,025 * 82 = 2,05 г. ω(Ц) = m(Ц)/m смеси; ω(Ц) = 0,025/5 = 0,41 Массовая доля бензола (Б) в смеси двух веществ равна ω(Б) = 1 – ω(Ц); ω(Б) = 1 – 0,41 = 0,59. Определяем массу и количество вещества бензола в образце смеси массой m= 20 г. m*(Б) = m* * ω(Б); m*(Б) = 20 * 0,59 = 11,8 г; n*(Б) = m*(Б)/M(Б); n*(Б) = 11,8/78 = 0,15 моль. Аналогично для циклогексена получаем: m*(Ц) = 8,2 г и n*(Ц) = 0,1 моль. Составляем уравнения реакции горения бензола и циклогексена: 2 C6H6 + 15 O2 → 12 CO2 + 6 H2O (б) 2 C6H10 + 17 O2 → 12 CO2 + 10 H2O (в) На основании уравнения реакции (б) записываем n*(Б)/n(H2O) = 2/6 =1/3; n(H2O) = 3 n*(Б); n(H2O) = 3*0,15 = 0,45 моль. Используя уравнение реакции (в) находим n(H2O) = 5 n(Ц); n(H2O) = 5 *0,1 =0,5 моль. Общее количество вещества воды, выделившейся при горении смеси массой 20 г , составляет n(H2O) = (0,45 + 0,5) = 0,95 моль. Вычисляем массу полученной воды: m(H2O) = n(H2O) * M(H2O); m(H2O) = 0,95 * 18 = 17,1 г. Ответ: 17,1 г. Задача 7 При сжигании углеводорода, количество вещества которого равно 0,1 моль, образовались оксид углерода (IV) объемом 6,72 л (нормальные условия) и вода массой 7,2 г. Определите формулу углеводорода. Решение: Вычисляем количество вещества оксида углерода (IV), полученного при горении углеводорода: n(CO2) = V(CO2) / Vm ; n(CO2) = 6,72/22,4 = 0,3 моль. Количество вещества углерода, содержащегося в сожженном образце углеводорода, равно n(C) = n(CO2); n(C) = 0,3 моль. Рассчитываем количество вещества воды, полученной при сжигании углеводорода: n(H2O) = m(H2O)/M(H2O); n(H2O) = 7,2/18 = 0,4 моль. Определяем количество вещества водорода, содержащегося в образце углеводорода: n(H) = 2n(H2O); n(H) = 2*0,4 = 0,8 моль. Таким образом, образец углеводорода количеством вещества 0,1 моль содержит 0,3 моль углерода и 0,8 моль водорода. Следовательно, 1 моль углеводорода содержит 3 моль углерода и 8 моль водорода. Таким образом, формула углеводорода C3H8. Это пропан. Ответ: C3H8 Задача 8 Органическое вещество имеет относительную плотность паров по водороду 46. Образец этого вещества массой 13,8 г сожгли, получив оксид углерода (IV) объемом 23,52 л (нормальные условия) и воду массой 10,8 г. Определите формулу органического вещества, учитывая, что оно является ароматическим. Решение: Вычисляем молярную массу органического вещества (В), используя относительную плотность его паров по водороду: M(B) = 2DH2; M(B) = 2 *46 = 92 г/моль. Определяем количество вещества В, которое сожгли: n(B) = m(B)/M(B) ; n(B) = 13,8/92 = 0,15 моль. Рассчитываем количество вещества образовавшегося оксида углерода (IV) CO2 n(CO2) = V(CO2)/Vm ; n(CO2) = 23,54/22,4 = 0,15 моль. Вычисляем количество вещества углерода в сожженном веществе равно n(C) = n(CO2); n(C) = 1,05 моль. Вычисляем количество вещества воды и количество вещества атомного водорода в сожженном веществе: n(H2O) = m(H2O)/M(H2O) ; n(H2O) = 10,8/18 = 0,6 моль. n(H) = 2n(H2O); n(H) = 2 * 0,6 = 1,2 моль. Определяем массу атомных углерода и водорода: m(C) = n(C)*M(C); m(C) = 1,05 * 12 = 12,6 г. m(H) = n(H)*M(H); m(H) = 1,2 * 1 = 1,2 г. m(C) + m(H) = (12,6 + 1,2) = 13,8 г. Сумма масс углерода и водорода равна массе сожженного вещества, следовательно, других элементов оно не содержит. Таким образом, вещество В – ароматический углеводород, формулу которого можно представить в виде CxHy . Мы определили, что образец CxHy, количество вещества которого равно 0,15 моль, содержит 1,05 моль С и 1,2 моль Н. Вычисляем коэффициенты x и y. x = n(C)/n(B); x = 1,05/0,15 = 7; y = n(H)/n(B); y = 1,2/0,15 = 8; Ответ: Формула ароматического углеводорода С7Н8 или С6Н5 – СН3. Это толуол. Задача 9 Этанол объемом 30 мл (плотностью 0,79 г/мл) нагрели с избытком бромида натрия и серной кислоты. Из реакционной среды выделили бромэтан массой 42,3 г. Определите массовую долю выхода бромэтана. Решение: При нагревании смеси этанола с бромидом калия и серной кислотой происходят реакции: 2KBr + H2SO4 ↔ 2HBr + K2SO4 (a) C2H5OH + HBr ↔ C2H5Br + H2O (б) Вычисляем массу и количество вещества этанола, взятого для реакции: m(C2H5OH) = V(C2H5OH) * p(C2H5OH); m(C2H5OH) = 30 * 0,79 = 23,7 г. n(C2H5OH) = m(C2H5OH)/M(C2H5OH); n(C2H5OH) = 23,7/46 = 0,515 моль. Из уравнения (б) следует: n(C2H5Br) = n(C2H5OH); n(C2H5Br) = 0,515 моль. Рассчитываем массу бромэтана, который мог бы образоваться при 100% - ном выходе: m(C2H5Br) = n(C2H5Br) * M(C2H5Br); m(C2H5Br) = 0,515 * 109 = 56,1 г. Вычисляем массовую долю выхода бромэтана: ω(C2H5Br) = mp(C2H5Br)*100/m(C2H5Br); ω(C2H5Br) = 42,3 * 100/56,1 = 75,4%. Ответ: 75,4%. Задача 10 Как, исходя из этана, получить этилацетат? Напишите уравнения соответствующих реакций. Решение: Бромированием этана вначале получаем бромэтан: C2H6 + Br2 → C2H5Br + HBr Проводя гидролиз бромэтана в присутствии щелочи, получаем этанол: C2H5Br + H2O → C2H5OH + HBr (щелочь необходима для смещения равновесия в сторону спирта). Из спирта можно получить альдегид двумя путями: а) дегидрированием спирта Cu, t C2H5OH → CH3CHO + H2 б) окислением спирта Cu, t 2C2H5OH → 2CH3CHO + 2H2O Окисляя альдегид (любым окислителем), можно получить уксусную кислоту: 5CH3CHO + 2KMnO4 + 3H2SO4 → 5CH3COOH + 2MnSO4 + K2SO4 + 3H2O Сложный эфир – этилацетат – получаем из этанола и уксусной кислоты по реакции этерификации в присутствии катализатора – концентрированной серной кислоты: H+ С2Н5OH + CH3COOH ↔ C2H5OCOCH3 + H2O. Задача 11 Одноосновная карбоновая кислота имеет следующий состав: углерод (массовая доля 40,0%), кислород (53,3%), водород (6,7%). Определите формулу этой кислоты. Рассчитайте объем раствора гидроксида натрия (массовая доля NaOH 15% , плотность 1,16 г/мл), который потребуется для нейтрализации образца этой кислоты массой 12 г. Решение: Формулу одноосновной карбоновой кислоты можно представить в виде CxHyCOOH или Cx+1Hy+1O2. Выбираем для расчетов образец кислоты массой 100 г. Вычисляем массы и количества вещества С, Н и О в этом образце: m(C) = m(кислоты) * ω(C)/100; m(C) = 100*40,0/100 = 40 г. n(C) = m(C)/M(C); n(C) = 40/12 = 3,33 моль. Аналогично получаем, что n(H) = 6,7 моль, n(O) = 3,33 моль. Коэффициенты в формуле кислоты будут равны: (x + 1) : (y + 1) : 2 = n(C) : n(H) : n(O); (x + 1) : (y + 1) : 2 = 3,33 : 6,7 : 3,33 = 2 : 4 : 2. Отсюда следует, что (x + 1) = 2, x = 1; (y + 1) = 4, y = 3, то есть формула кислоты CH3COOH. Это уксусная кислота. Записываем уравнение реакции нейтрализации этой кислоты гидроксидом натрия: CH3COOH + NaOH → CH3COONa + H2O Из условия задачи следует, что для нейтрализации взят образец кислоты массой 12 г, то есть m(CH3COOH) = 12 г. Определяем количество вещества кислоты: n(CH3COOH) = m(CH3COOH)/M(CH3COOH); n(CH3COOH) = 12/60 = 0,2 моль Из уравнения реакции следует: n(NaOH) = n(CH3COOH); n(NaOH) =0,2 моль. Вычисляем массу гидроксида натрия, которая реагирует с кислотой: m(NaOH) = n(NaOH) * M(NaOH) ; m(NaOH) = 0,2*40 = 8 г. Рассчитаем массу и объем раствора NaOH , который потребуется для нейтрализации кислоты: m = m(NaOH)*100/ω(NaOH) ; m = 8 * 100/15 = 53,3 г. V = m/ρ; V = 53,3/1,16 = 46 мл. Ответ: 46 мл., CH3COOH Задача 12 Какой объем 15%-ного раствора гидроксида калия (плотность 1,14 г/мл) потребуется для нейтрализации аминоуксусной кислоты, полученной из 12,8 г карбида кальция? Решение: Составляем уравнения реакции синтеза аминоуксусной кислоты из карбида кальция: а) получение ацетилена из карбида кальция CaC2 + 2H2O → Ca(OH)2 + C2H2 б) получение ацетальдегида (реакция Кучерова) Hg2+ C2H2 + H2O → CH3COH в) окисление ацетальдегида любым окислителем CH3COH + [O] → CH3COOH г) хлорирование уксусной кислоты CH3COOH + Cl2 → CH2ClCOOH + HCl д) взаимодействие хлоруксусной кислоты с аммиаком CH2ClCOOH + 2NH3 → H2NCH2COOH + NH4Cl Определяем количество вещества карбида кальция CaC2: n(CaC2) = m(CaC2)/M(CaC2); n(CaC2) = 12,8/64 = 0,2 моль. Из уравнения реакций (а – д) следует, что n(H2NCH2COOH) = n(CaC2); n(H2NCH2COOH) = 0,2 моль. Из уравнения реакции нейтрализации кислоты: H2NCH2COOH + KOH → H2NCH2COOK + H2O Следует, что: n(KOH) = n(H2NCH2COOH) ; n(KOH) = 0,2 моль Определяем массу требуемого КОН: m(KOH) = n(KOH) * M(KOH); m(KOH) = 0,2 * 56 = 11,2 г. Вычисляем массу и объем раствора гидроксида калия: m = m(KOH) * 100/ω(KOH); m = 11,2 * 100/15 = 74, 67 г. V = m/ρ ; V = 74,67/1,14 = 65,5 мл. Ответ: 65,5 мл. Задача 13 Как можно получить анилин, исходя из метана и не используя другие органические соединения. Укажите условия протекания реакций. Решение: Проводя пиролиз метана, можно получить ацетилен: t 2CH4 → C2H2 + 3H2 В присутствии угольного катализатора из ацетилена можно получить бензол: t, C 3С2H2 → C6H6 Под действием нитрирующей смеси ( смесь концентрированных азотной и серной кислот) на бензол образуется нитробензол: C6H6 + HNO3 → C6H5NO2 + H2O Из нитробензола можно получить анилин по реакции Н.Н. Зинина, используя в качестве восстановителя сульфид аммония , железо в кислой среде или водород в присутствии катализаторов, например: C6H5NO2 + 3H2 → C6H5NH2 + 2H2O Задача 14 Определите молярную массу (г\моль) алкана, содержащего 16 атомов водорода. Составьте структурную формулу. Назовите вещество Решение: 1) Запишем общую формулу гомологического ряда алканов: СnН2n+2 2) Запишем формулу алкана с 16 атомами водорода: Если водорода 16 атомов, то углерода соответственно 7. 3) Учитывая, что молярная масса – масса одного моля вещества – численно равна относительной молекулярной массе , а последняя равна сумме атомных масс элементов, входящих в вещество, с учетом индексов, запишем выражение для определения молярной массы заданного алкана с 16 атомами водорода. М(С7Н16)= 12*7+16*1=100г\моль 4) Составим структурную формулу: СН3 – СН2 – СН2 – СН2 – СН2 – СН2 –СН3 5) Назовем вещество: гептан. Ответ: 100 г/моль Задача 15 Молекулярная масса алкина равна 54 .Определите, сколько атомов водорода он содержит? Составьте структурную формулу. Назовите вещество. Решение: 1) Запишем общую формулу гомологического ряда алкинов: СnН2n-2 2) Учитывая, что молярная масса – масса одного моля вещества – численно равна относительной молекулярной массе , а последняя равна сумме атомных масс элементов, входящих в вещество, с учетом индексов, запишем выражение для определения молярной массы заданного алкина ,зная что она равна 54. М=12*n+1*(2n -2); 54=12*n+1*(2n -2); 3 Найдем n: 54= 12 n+2 n-2 14 n=56; n=4 3) Найдем число атомов водорода в молекуле, если n=4. Атомов водорода соответственно 6. 4) Составим структурную формулу: СН≡С - СН2 – СН3 5) Назовем вещество: Бутин – 1 . Задача 16 Какими способами можно распознать бутен , бутанол, бутановую кислоту? Составьте план решения, опишите наблюдения, составьте уравнения реакций. Решение: 1 Рассмотрим функциональные особенности веществ: а ) бутен СН2=СН – СН2– СН3 относится к ненасыщенным углеводородам, содержащим двойную связь. б ) бутанол СН3- СН 2– СН2– СН2ОН относится к насыщенным одноатомным спиртам. в) бутановая кислота СН3- СН 2– СН2– СООН относится к насыщенным одноатомным кислотам, содержит карбоксильную группу. 2 Рассмотрим качественные реакции: а ) Качественной реакцией на алкены является пропускание их через бромную воду или раствор перманганата калия. б ) Качественной реакцией на насыщенные одноатомные спирты является взаимодействие с металлическим натрием. в) Качественной реакцией на карбоновые кислоты является изменение окраски индикатора в их среде и взаимодействие их со спиртами. 3 Опишем наблюдения и составим уравнения реакций. а ) При пропускании бутена через бромную воду происходит обесцвечивание раствора. СН2=СН – СН2– СН3 + Br2 = СН2- СН – СН2– СН3 Br Br СН2=СН – СН2– СН3 + 2 [O]= СН2 - СН – СН2– СН3 ОН ОН б ) При действии на спирты металлического натрия наблюдается выделение газа и образование студенистой массой алкоголята. 2СН3- СН 2– СН2– СН2ОН +2 Na=2 СН3- СН 2– СН2– СН2О Na + Н2 в) При добавлении к раствору бутановой кислоты индикатора лакмуса или метилового оранжевого наблюдается красное окрашивание. При нагревании кислоты со спиртом в присутствии концентрированной серной кислоты появляется «эфирный запах» и образование слоя эфира, не смешивающегося с водой. СН3- СН 2– СН2– СООН + С2Н5ОН = СН3- СН 2– СН2– СОО С2Н5 + Н2О. Задача 17 Органическое вещество содержит углерод(массовая доля 84,21%) и водород (15,79%).Плотность паров вещества по воздуху составляет 3,93. Определите формулу этого вещества. Решение : W(С)= 84,21%.| 1 Пусть масса вещества 100г. W(Н)= 15,79%.| 2 Тогда m(С)=84,21г, m(Н)=15,79г. D(возд) = 3,93.| 3 Найдем соотношение количеств веществ: ____________|_υ(С): υ(Н)=84,21\12 :15,79/1=7,0175:15,79=1:2,25=4:9. Сx Нy С4Н9 - простейшая формула. Найдем молярную массу простейшей формулы: М(С4Н9)=57г\моль. Найдем молярную массу истиной формулы: Мист=3,93*29=114г\моль. Найдем соотношение истиной и простейшей молярных масс: Ми = 114 = 2. Мпр 57 Ответ: С8Н18 – истинная формула. Задача 18 Сколько граммов пропанола-2 с выходом 80% от теоретически возможного получится из 200г пропилена. Решение: m(С3Н6)= 200г.| 1 Составим уравнение реакции получения пропанола-2. W(С3Н7ОН)= | СН2=СН – СН3 + Н2О= СН3 – СН – СН3 80% | | ____________ | ОН m(С3Н7ОН)=? 2 Найдем количество вещества пропена, вступившего в реакцию: υ(С3Н6)= m\М υ(С3Н6)= 200\42=4,76моль. 3 Найдем по уравнению, что количество вещества пропанола -2 равно количеству вещества пропена, вступившего в реакцию: υ(С3Н7 ОН)=4,76 моль. 4 Найдем массу теоретическую образовавшегося пропанола-2 m = υ*М; m = 4,76*60=285,7г 5 Учитывая, что выход вещества составляет 80%, найдем массу практическую продукта. m пр= mтеор* W\100% m пр= 285,7*80\100=228,6г. Ответ: 228,6г. Задача 19 Какой объем (при нормальных условиях) займет метан, образовавшийся из 100г ацетата натрия. Решение: m (СН3СООNa)= 100г.| 1 Составим уравнение реакции получения метана: CH3COONa+NaOH=CH4+Na2CO3 VCH4 =? 2 Найдем количество вещества ацетата натрия, вступившего в реакцию: υ(CH3COONa)= m\М υ(CH3COONa)= 100\82=1,22моль. 3 Найдем по уравнению, что количество вещества метана равно количеству вещества ацетата натрия, вступившего в реакцию. υ(CH4)=1,22моль. 4 Найдем объем метана, образовавшегося в результате реакции: V=Vm* υ; Vm=22,4 л\моль. V=22,4*1,22=27,3л Ответ: 22,4л. Задача 20 Сколько литров (н.у.) образуется из 50г 60% -ного карбида кальция. Решение: m(СаС2)= 50г | 1 Составим уравнение реакции получения ацетилена: W(СаС2)=60% | СаС2+2Н2О=С2Н2+Са(ОН)2 VC2H2=? 2 Найдем массу чистого карбида кальция: m(СаС2)=50*60\100=30г. 3 Найдем количество вещества карбида кальция, вступившего в реакцию: υ(СаС2)= m\М υ(СаС2)=30\64=0,47 моль. 4 Найдем по уравнению, что количество вещества ацетилена равно количеству вещества карбида кальция, вступившего в реакцию: υ(С2Н2)=0,47 моль. 5 Найдем объем ацетилена, образовавшегося в результате реакции: V=Vm* υ; Vm=22,4 л\моль. V=22,4* 0,47=10,5л. Ответ: 10,5л. Задача 21 Определить выход эфира в процентах от теоретически возможного , если из 300г уксусной кислоты и соответствующего количества спирта получено 400г этилацетата. Решение : m(СН3СООН)=300г | 1 Составим уравнение реакции m (СН3СООС2Н5)= 400г.| СН3СООН+ С2Н5ОН= СН3СООС2Н5 +Н2О W (СН3СООС2Н5)= ? | 2 Найдем количество вещества уксусной кислоты, вступившей в реакцию: υ(СН3СООН)= m\М υ(СН3СООН)=300\60=5 моль. 3 Найдем по уравнению, что количество вещества этилацетата равно количеству вещества уксусной кислоты, вступившей в реакцию: υ(СН3СООС2Н5)=5моль. 4 Найдем теоретическую массу образовавшегося этилацетата m = υ*М; m(СН3СООС2Н5)=5*88=440г 5 Учитывая, что масса практическая этилацетата 400г, найдем массовую долю выхода продукта: W= mпр\ mтеор *100% ; W=400\440*100=90%. Ответ: 90%. Задача 22 Определить содержание примесей (в процентах)в карбиде кальция , если из 170г карбида кальция получено 50г ацетилена. Решение : m(СаС2)= 170г | 1 Составим уравнение реакции получения ацетилена: m (C2H2)= 50г | СаС2+2Н2О=С2Н2+Са(ОН)2 W(прим)= ? 2 Найдем количество вещества ацетилена, образовавшегося в результате реакции: υ(С2Н2)= m\М υ(С2Н2)=50\26=1,92моль. 3 Найдем по уравнению, что количество вещества карбида кальция равно количеству вещества ацетилена, образовавшегося в результате реакции: υ(СаС2)= 1,92моль. 4 Найдем массу чистого карбида кальция: m = υ*М; m (СаС2)=1,92*64=123г 5 Найдем массу примесей: m (прим)= m(загряз. в-ва)- m(чист. в-ва) m (прим) =170-123=47г 6 Найдем массовую примесей в карбиде: W(прим)= m (прим)\ m(загряз. в-ва) *100% W(прим)= 47\170*100=27,6% Ответ : 27,6% Задача 23 Сколько граммов этилового спирта нужно взять для получения 200г диэтилового эфира , если выход продукта равен 80% от теоретически возможного. Решение : m ( С2Н5ОС2Н5) =200г| 1 Составим уравнение реакции W=80% | С2Н5ОН+ С2Н5ОН= С2Н5ОС2Н5 +Н2О m ( С2Н5ОН)= ? 2 Найдем теоретическую массу образовавшегося продукта: m теор= mпр* 100%\ W m теор=200*100\80=250г. 3 Найдем количество вещества диэтилового эфира, образовавшегося в результате реакции: υ(С2Н5ОС2Н5)= m\М υ(С2Н5ОС2Н5)=250\74=3,38моль. 4 Найдем по уравнению, что количество вещества этанола в 2 раза больше количеств вещества диэтилового эфира , вступившего в реакцию. υ(С2Н5ОН)=3,38*2=6,76моль. 5 Найдем массу этанола, вступившего в реакцию: m = υ*М; m =6,76*46=310,8г Ответ: 310,8 г Задача 24 Сколько грамм 8% раствора уксусной кислоты необходимо для получения водорода объемом 2,8л при взаимодействии ее с магнием. Решение: V(Н2)=2,8л | 1 Составим уравнение реакции W(СН3СООН)=8% | 2 СН3СООН+Мg= (СН3СОО)2 Мg +Н2 m (р-ра)= ? 2 Найдем количество вещества водорода, образовавшегося в результате реакции : υ = V \Vm; Vm=22,4 л\моль υ =2,8\22,4=0,125моль. 3 Найдем по уравнению, что количество вещества водорода в 2 раза меньше количеств вещества уксусной кислоты, вступившей в реакцию: υ (СН3СООН)= 0,125*2=0,25моль. 4 Найдем массу уксусной кислоты: m = υ*М; m = 0,25*60=15г 5 Найдем массу раствора уксусной кислоты: W= m в-ва\ m р-ра*100% m р-ра = m в-ва* 100\ W. m р-ра = 15*100\8=187,5 г Ответ: 187,5 г Задача 25 Сколько граммов этилацетата можно получить при взаимодействии 100г уксусной кислоты с 50г этанола. Решение : m(СН3СООН)=100г| 1 Составим уравнение реакции m (С2Н5ОН)= 50г. | СН3СООН+ С2Н5ОН= СН3СООС2Н5 +Н2О m (СН3СООС2Н5)= ?| 2 Найдем количество веществ уксусной кислоты и этанола, вступившей в реакцию: υ= m\М υ(СН3СООН)= 100\60=1,67моль. υ(С2Н5ОН)= 50\46=1,09 моль. 3 Так как по уравнению реакции уксусная кислота и этанол реагирует 1:1, то из найденных значений видно, что в избытке находится уксусная кислота и часть ее останется после реакции, а этанол прореагирует полностью. Решаем по недостатку. 4 Найдем по уравнению, что количество вещества этанола равно количеству вещества этилацетата, образовавшегося в результате реакции: υ(СН3СООС2Н5 )=1,09моль. 5 Найдем массу этилацетата: m = υ*М; m = 1,09*88=95,7г ответ : 95,7г Ответ: 95,7 г.
Источник: https://nauka.club/khimiya/zadachi-po-organicheskoy-khimii-s-resheniyami.html
Решение задач на определение массовой или объемной доли выхода продукта реакции от теоретически возможного. 
КОНТРОЛЬНАЯ РАБОТА № 1 по теме: «АЛКАНЫ» (10 класс) Вариант 1 ЧАСТЬ А При выполнении заданий этой части для каждого задания (А1 – А10) запишите цифру, которая соответствует номеру выбранного вами ответа. Задание A1 Общая формула циклоалканов 1) С n H 2n–6 2) C n H 2n–2 3) C n H 2n 4) C n H 2n+2 Задание A2 Название углеводорода, формула которого C 5 H 12 1) этан 2) пентан 3) бутан 4) пропан Задание A3 Изомером октана является: 1) 2,3-диметилгептан; 2) 2,3-диметилбутан; 3) 2,3-диметилпентан; 4) 2,3-диметилгексан. Задание A4 Молекулярная формула бутана 1) СH 4 2) C 3 H 6 3) C 4 H 10 4) C 4 H 8 Задание A5 Гомологом 2,4-диметилоктана является: 1) 2,5-диметилгептан; 2) 3,3-диметилбутан; 3) 2,3-диметилпентан; 4) 2,4-диметилгексан. Задание A6 Процесс разложения углеводородов нефти на более летучие вещества называется 1) крекинг 2) дегидрирование 3) гидрирование 4) дегидратация Задание A7 Пропан реагируют 1) с водой 2) с раствором KMnO 4 3) с водородом 4) с хлором Задание A8 Сумма коэффициентов в уравнении реакции полного сгорания этана равна 1) 10 2) 9 3) 19 4) 16 Задание A9 Известно термохимическое уравнение горения метана CH 4 + 2O 2 → CO 2 +2H 2 O + 896 кДж. Какое количество метана расходуется при выделении 89,6 кДж теплоты? 1) 0,1 моль 2) 0,2 моль 3) 0,25 моль 4) 0,5 моль  Задание A10 Реакция горения алкана 1) 2C 3 H 6 + 9О 2 →6 CО 2 +6 H 2 О 2) 2С 2 H 2 +5О 2 → 4CО 2 + 2H 2 О 3) C 3 H 8 + 5О 2 → 3CО 2 +4 H 2 О 4) С 2 H 4 +3О 2 → 2CО 2 + 2H 2 О ЧАСТЬ В Ответом к заданиям этой части (В1 – В2) является набор чисел и букв, которые следует записать как соответствия, например: 1-А, 2-Д, 3-Г, 4-В. Задание B1 Установите соответствие между формулой органического вещества и названием , принадлежащим ему. ФОРМУЛА 1) СН 3 - СН - СН 2 - СН 2 - СН 3 | СН 3 2) СН 3 - СН 2 - СН 2 - СН 2 - CH 2 - CH 3 3) СН 3 - СH - CH 3 - СН 3 | СН 3 4) СН 3 - СН - СН - СН 2 - CH 2 - CH 3 | | НАЗВАНИЕ ВЕЩЕСТВА НАЗВАНИЕ ВЕЩЕСТВА А) 2 - метилбутан Б) 2 - метилпентан В) 2 - метил - 3 - этилгексан Г) гексан СН 3 С 2 Н 5 Задание B2 Установите соответствие между названием вещества и формулой его гомолога. НАЗВАНИЕ ВЕЩЕСТВА ФОРМУЛА ГОМОЛОГА 1) циклопентан A) СН 3 | Н 3 С − С − СН 2 − СН 3 | СН 3 2) 2,4-диметилгептан Б) CH 3 – CH – CH 2 – CH – CH 3 | | CH 3 CH 3 3) Изобутан (2-метилпропан) В) CH 2 – CH 2 | | CH 2 – CH 2 4) 2,2-диметилгексан Г) CH 3 – CH 2 – CH – CH 3 | CH 3 ЧАСТЬ С При ответе на задания этой части запишите полный ответ Задание C1 Составьте структурную формулу органического вещества 2,2,4 – триметилгексана. Задание C2 При полном сгорании циклического углеводорода образовался оксид углерода (IV) массой 3,52 г и вода массой 1,44 г. Относительная плотность этого углеводорода по воздуху равна 1,448. Найдите молекулярную формулу углеводорода.  Примерное распределение времени, отводимое на выполнение отдельных заданий составляет: для каждого задания части 1–1-2 минуты; для каждого задания части 2 – 5-7 минут; для каждого задания части 3 – до 10-12 минут. Оценки за тестовый вариант контрольной работы: 10 - 13 баллов – оценка «3». 14-17 баллов – оценка «4» 18-21 балл – оценка «5». ОТВЕТЫ (Вариант 1): СН 3 | Н 3 С − С − СН 2 − СН− СН 2 − СН 3 | | СН 3 СН 3 1.Составим схему горения неизвестного углеводорода, представив его формулу в виде C x H y . C x H y + O 2 → CO 2 + H 2 O 2. 44 г/моль CO 2 содержит 12 г/моль C 3,52 г CO 2 содержит y г C m(C) = 0,96 г 3. 18 г/моль H 2 O содержит 2 г/моль H 1,44 г H 2 O содержит х г H m(H) = 0,16 г 4. ν(C) = m(C)/M(C) ν(C) = 0,96 г/12 г/моль ν(C) = 0,08 моль 5. ν(H) = m(H)/M(H) ν(H) = 0,16 г/1 г/моль ν(H) = 0,16 моль 6. ν(C): ν(H) =0,08 моль : 0,16 моль (: 0,08 моль) C: H=1:2 CH 2 –простейшая формула углеводорода M(CH 2 )= 12+2=14 г/моль 7. M(C x H y ) = D(возд.) ×M(возд.) M(C x H y ) = 1,448 × 29 г/моль = 42 г/моль 8. . n= M(C x H y ) / M(CH 2 )= 42 г/моль: 14 г/моль=3 9. C 3 H 6 формула циклического углеводорода- циклопропана. Ответ: C 3 H 6 - циклопропан. КОНТРОЛЬНАЯ РАБОТА № 1 по теме: «АЛКАНЫ» (10 класс) Вариант 2 ЧАСТЬ А При выполнении заданий этой части для каждого задания (А1 – А10) запишите цифру, которая соответствует номеру выбранного вами ответа. Задание A1 Общая формула алканов 1) С n H 2n–6 2) C n H 2n–2 3) C n H 2n 4) C n H 2n+2 Задание A2 Название углеводорода, формула которого C 3 H 8 1) этан 2) пропан 3) бутан 4) пентан Задание A3 Изомером гептана является: 1) 2,3-диметилгептан; 2) 2,3-диметилбутан; 3) 2,3-диметилпентан; 4) 2,3-диметилгексан. Задание A4 Молекулярная формула циклобутана 1) СH 4 2) C 3 H 6 3) C 4 H 10 4) C 4 H 8 Задание A5 Гомологом 2,3-диметилоктана является: 1) 2,5-диметилгептан; 2) 3,3-диметилбутан; 3) 2,3-диметилпентан; 4) 2,4-диметилгексан. Задание A6 Способом переработки нефти и нефтепродуктов, при котором не происходят химические реакции, является 1) перегонка 2) крекинг 3) риформинг 4) пиролиз. Задание A7 Метан реагируют 1) с раствором KMnO 4 2) с водородом 3) с кислородом 4) с бромной водой Задание A8 Сумма коэффициентов в уравнении реакции полного сгорания пропана равна 1) 10 2) 12 3) 13 4) 26 Задание A9 Известно термохимическое уравнение горения метана CH 4 + 2O 2 → CO 2 +2H 2 O + 896 кДж. Какое количество метана расходуется при выделении 448 кДж теплоты? 1) 0,1 моль 2) 0,2 моль 3) 0,25 моль 4) 0,5 моль  Задание A10 Схеме алкан + галоген → соответствует уравнение реакции 1) С 2 H 4 + Н 2 О→ C 2 H 5 ОH 2) C 3 H 4 + 2Cl 2 → C 3 H 4 Cl 4 3) C 3 H 6 + Вr 2 → C 3 H 4 Вr 2 4) С 2 H 6 + 2Cl 2 → C 2 H 5 Cl+ HCl ЧАСТЬ В Ответом к заданиям этой части (В1 – В2) является набор чисел и букв, которые следует записать как соответствия, например: 1-А, 2-Д, 3-Г, 4-В. Задание B1 Установите соответствие между формулой алкана и названием, принадлежащим ему. ФОРМУЛА 1) СН 3 - СН 2 - СН - СН - CH 2 - CH 3 | | С 2 Н 5 СН 3 2) Н 3 С − СН 2 − СН 3 3) СН 3 - СН - CH 2 - СН 3 | СН 3 4) СН 3 - СН 2 - СН - СН 2 - CH 3 | С 2 Н 5 НАЗВАНИЕ ВЕЩЕСТВА НАЗВАНИЕ ВЕЩЕСТВА А) пропан Б) 3 - этилпентан В) 3 - метил - 4 - этилгексан Г) 2 - метилбутан Задание B2 Установите соответствие между названием вещества и формулой его изомера. НАЗВАНИЕ ВЕЩЕСТВА ФОРМУЛА ИЗОМЕРА 1) 2-метилпропан A) СН 3 | Н 3 С − С − СН 2 − СН 3 | СН 3 2) 2,2-диметилгептан Б) CH 3 – CH – CH 2 – CH – CH 2 – CH 2 – CH 3 | | CH 3 CH 3 3) 2,3-диметилпентан В) CH 3 – CH 2 –CH 2 –CH 3 4) гексан Г) CH 3 – CH 2 – CH – CH 2 –CH 2 –CH 3 | CH 3 ЧАСТЬ С При ответе на задания этой части запишите полный ответ Задание C1 Составьте структурную формулу органического вещества 2 – метил -3- этилпентана. Задание C2 При полном сгорании углеводорода образовался оксид углерода (IV) массой 0,88 г и вода массой 0,54 г. Относительная плотность этого углеводорода по водороду равна 15. Найдите молекулярную формулу углеводорода.  Примерное распределение времени, отводимое на выполнение отдельных заданий составляет: для каждого задания части 1–1-2 минуты; для каждого задания части 2 – 5-7 минут; для каждого задания части 3 – до 10-12 минут. Оценки за тестовый вариант контрольной работы: 10 - 13 баллов – оценка «3». 14-17 баллов – оценка «4» 18-21 балл – оценка «5». ОТВЕТЫ (Вариант 2): СН 3 - СН 2 - СН - СН - CH 3 | | С 2 Н 5 СН 3 1.Составим схему горения неизвестного углеводорода, представив его формулу в виде C x H y . C x H y + O 2 → CO 2 + H 2 O 2. 44 г/моль CO 2 содержит 12 г/моль элемента C 0,88 г CO 2 содержит y г элемента C m(C) = 0,24 г 3. 18 г/моль H 2 O содержит 2 г/моль элемента H 0,54 г H 2 O содержит х г элемента H m(H) = 0,06 г 4. ν(C) = m(C)/M(C) ν(C) = 0,24 г/12 г/моль ν(C) = 0,02 моль 5. ν(H) = m(H)/M(H) ν(H) = 0,06 г/1 г/моль ν(H) = 0,06 моль 6. ν(C): ν(H) =0,02 моль : 0,06 моль C: H=1:3 CH 3 –простейшая формула углеводорода M(CH 3 )= 12+3=15 г/моль 7. M(C x H y ) = D(H 2 ) ×M(H 2 ) M(C x H y ) = 15 × 2 г/моль = 30 г/моль 8. . n= M(C x H y ) / M(CH 3 )= 30 г/моль: 15 г/моль=2 9. C 2 H 6 формула углеводорода, имеющего название этан. Ответ: C 2 H 6 - этан.
|
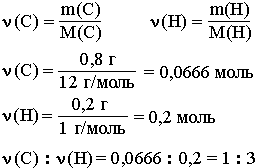
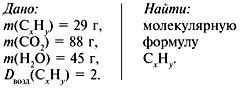
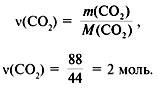
![]() (C) =
(C) = ![]() (CO2) = 2 моль.
(CO2) = 2 моль.![]() (H2O) = 45/18 = 2,5 моль.
(H2O) = 45/18 = 2,5 моль.![]() (H) = 2
(H) = 2![]() (H2O),
(H2O),![]() (H) = 2,5•2 = 5 моль.
(H) = 2,5•2 = 5 моль.![]() (C) :
(C) : ![]() (Н) = 2 : 5,
(Н) = 2 : 5,
![]() (CO2) = 16,8/22,4 = 0,75 моль,
(CO2) = 16,8/22,4 = 0,75 моль,![]() (C) = 0,75 моль.
(C) = 0,75 моль.![]() (H2O) = 13,5/18 = 0,75 моль,
(H2O) = 13,5/18 = 0,75 моль,![]() (H) = 0,75•2 = 1,5 моль.
(H) = 0,75•2 = 1,5 моль.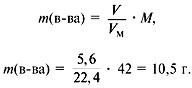
![]() (C) :
(C) : ![]() (H) = 0,75 : 1,5 = 1 : 2,
(H) = 0,75 : 1,5 = 1 : 2,
Комментариев нет:
Отправить комментарий