ПЯТНИЦА, 18.02.22г. 401, 208, 301
ИНСТРУКЦИЯ ДЛЯ ТЕХ, КТО НЕ МОЖЕТ НАЙТИ СВОЮ ГРУППУ:
СПРАВА ЕСТЬ АРХИВ. В АРХИВЕ ПО-ПОРЯДКУ РАСПОЛОЖЕНЫ ДНИ НЕДЕЛИ. ТАМ ЖЕ ВИДНЫ ДАТЫ И НОМЕРА ГРУПП. ВЫБИРАЕТЕ ДЕНЬ СО СВОЕЙ ГРУППОЙ, И ОН ОТКРОЕТСЯ. УРОКИ ВЫЛОЖЕНЫ ПО РАСПИСАНИЮ. НА ОДНОЙ СТРАНИЦЕ ВЫЛОЖЕН ОДИН ДЕНЬ . ВНИМАНИЕ!!! На выполнение задания отводится 1 неделя. Моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
Критерии оценивания: Для получения положительной оценки обучающийся должен: -соблюдать отведенное время; - разборчиво и правильно выполнить работу. Если работа будет прислана после указанного срока , оценка будет снижаться.
ГРУППА 401 ХИМИЯ 36,37
ТЕМА: Химические свойства кислот в свете теории электролитической диссоциации.
Кислоты как электролиты

Чем обусловлены общие свойства кислот?
Какие группы кислот вам известны?
Рассмотрим в свете теории электролитической диссоциации свойства веществ, растворы которых обладают электропроводностью.
Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода (гидроксония). |
По признаку осно́вности кислоты подразделяются на три группы:
- одноосно́вные (НСl, HI, HNO3, СН3СООН);
- двухосно́вные (H2S, H2SO3, H2SO4, H2SiO3);
- многоосно́вные (H3BO3, H3AsO4, H4P2O7).
Диссоциация многооснбвных кислот протекает ступенчато. Рассмотрим пример реакции электролитической диссоциации.
Диссоциация серной кислоты протекает по двум ступеням:
В наибольшей степени диссоциация протекает по первой ступени и значительно меньше по второй.
Среди кислот есть сильные и слабые электролиты, а их диссоциация протекает преимущественно по I ступени. Сильные кислоты диссоциируют в водных растворах практически нацело.
ВАЖНЕЙШИЕ ОБЩИЕ ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
1. Кислоты взаимодействуют с металлами. При этом образуются соли и выделяется водород. Однако металлы, стоящие в электрохимическом ряду напряжений металлов правее водорода, не вытесняют его из кислот:
HNO3 (как концентрированная, так и разбавленная), концентрированная H2SO4 реагируют с металлами иначе!
2. Кислоты взаимодействуют с осно́вными и амфотерными оксидами:
При избытке кислот образуются кислые соли:
MgO + 2H2SO4 (изб.) = Mg(HSO4)2 + Н2O
3. Взаимодействие кислот с основаниями является реакцией нейтрализации:
4. Кислоты взаимодействуют с солями:
Для протекания реакции необходимо выполнение одного из следующих условий:
а) кислота должна быть более сильной, чем та, что образовала соль;
б) в результате реакции должно образоваться нерастворимое или летучее соединение (покидающее сферу реакции).
Основные понятия
Ион гидроксония • Основность кислот • Сильные кислоты • Слабые кислоты
Вопросы и задания



ТЕМА: Особенности взаимодействия концентрированной серной и азотной кислот с металлами. Основные способы получения кислоты.
Азотная кислота
любой концентрации — сильный окислитель. Окислительные свойства азотной кислоты обусловлены азотом в высшей степени окисления . Состав продуктов восстановления
зависит от температуры, активности восстановителя и концентрации кислоты. При этом, чем активнее восстановитель и чем более разбавлена кислота, тем глубже протекает восстановление азота: 
Рис. 1. Зависимость продуктов восстановления
от активности восстановителя и концентрации Металлы особо реагируют с серной концентрированной и азотной кислотами:
H2SO4 (конц.) + Me = Сульфат + H2O + Х
2H2SO4 (конц.) + Cu =t°C= CuSO4 + 2H2O + SO2↑
8Na0 + 5H2+6SO4 = 4Na2+1SO4 + H2S-2↑ + 4H2O
Окислительные свойства концентрированной серной кислоты
Особые свойства концентрированной серной кислоты
1. С водой образуются гидраты:
H2SO4 + nH2O = H2SO4 · nH2O + Q
"Гигроскопичность серной кислоты"
2. Органические вещества обугливаются
C12H22O11 (сахароза) - H2SO4(конц., -11H2O → 12С (уголь)
Поведение металлов в концентрированной серной кислоте и её растворе
3. Серная кислота окисляет неметаллы и металлами:
а) концентрированная H2+6SO4 – сильный окислитель; при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до S+4O2, S0 или H2S-2 (без нагревания не реагируют также Fe, Al, Cr - пассивируются):
H2SO4 (конц.) + Me = соль + H2O + Х
, где Х – H2S, S, SO2
2Ag0 + 2H2+6SO4 = Ag2+1SO4 + S+4O2 + 2H2O
8Na0 + 5H2+6SO4 = 4Na2+1SO4 + H2S-2 + 4H2O
б) концентрированная H2S+6O4 реагирует при нагревании с некоторыми неметаллами за счет своих сильных окислительных свойств, превращаясь в соединения серы более низкой степени окисления, (например, S+4O2):
неМе + H2SO4(конц.) = H2O + SO2 + кислородсодержащая кислота неМе
, где неметалл в высшей валентности
С0 + 2H2S+6O4(конц) = C+4O2 + 2S+4O2 + 2H2O
S0 + 2H2S+6O4(конц) = 3S+4O2 + 2H2O
2P0 + 5H2S+6O4(конц) = 5S+4O2 + 2H3P+5O4 + 2H2O
Тренажёр - Обобщающий тест "Элементы подгруппы кислорода и их соединения"
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Запишите уравнения реакций между серной концентрированной кислотой и следующими веществами: натрия, ртуть, сера.
Расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель.
№2. Вычислите объём газа (н.у.), который образуется при взаимодействии 15% - ного раствора серной кислоты массой 900 г с цинком?
№3. Осуществите превращения по схеме:
Сu → CuSO4 → Cu(OH)2 → CuO → CuSO4 → BaSO4
1. Бескислородные кислоты получают при растворении в воде газообразных соединений неметаллов с водородом.Так, например, соляная кислота образуется в результате растворения газа хлороводородаHCl в воде, а сероводородная кислота образуется при растворении газа сероводородаH2S в воде. Сами же упомянутые газообразные соединения можно получить в реакциях соединения водорода с соответствующими неметаллами:H2+Cl2−→−свет2HCl,
2. Кислородсодержащие кислоты можно получить взаимодействием соответствующих кислотных оксидов с водой:N2O5+H2O→2HNO3,SO3+H2O→H2SO4. 3. Кислоты можно получить из соответствующих солей. Реакции обмена протекают в соответствии с вытеснительным рядом кислот.Например, соляная кислота вытесняет уксусную из растворов её солей, а фосфорная кислота может быть вытеснена серной:
ВНИМАНИЕ! Экзамен в МАРТЕ!
См. вкладку "Экзамен 208" , обращайте особое внимание темам, которые будут в билетах. Задачи, аналогичные экзаменационным во вкладке "Решаем задачи"и ещё..
ТЕМА:Химия и производство. Химическая промышленность и химические технологии. Сырье для химической промышленности. Вода в химической промышленности. Энергия для химического производства. Научные принципы химического производства. 1 1 23 Защита окружающей среды и охрана труда при химическом производстве.
Химическая промышленность — это отрасль народного хозяйства, производящая продукцию на основе химической переработки сырья.
Основой химического производства является химическая технология — это наука о наиболее экономичных методах и средствах массовой химической переработки сырья (природных материалов) в продукты потребления и промежуточные продукты, применяемые в различных отраслях народного хозяйства. Слово технология образовано из греческих корней технос – "мастерство", "искусство" и логос – "наука", учение. Химическая технология непосредственно связана с химией. Другими словами:
Химическая технология - наука о способах производства промышленных продуктов посредством химических реакций.
Главная задача химической технологии — производство разнообразных веществ и материалов с определенным комплексом заданных механических, физических, химических или биологических свойств.
Знание общих закономерностей протекания химических реакций позволяет правильно определить условия, при которых тот или иной процесс протекает с максимальным выходом.
Структура химической промышленности
В химической и нефтехимической отрасли России работает около 8 тыс. предприятий, в которых сконцентрировано около 7% основных фондов всей промышленности страны. Химический комплекс России является базовым сегментом экономики. Химическая промышленность имеет сложный многоотраслевой состав. Традиционно она подразделяется на горнохимическую отрасль (производит добычу и первичную переработку химического сырья — апатитов, фосфоритов, серы, каменных солей, нефти, газа, угля); основное химическое производство и производство (переработку) резиновых и пластмассовых изделий (использует пластики и каучуки в качестве полуфабрикатов).

В свою очередь, основное химическое производство включает:
- производство основных химических веществ или химию органического синтеза (удобрений, синтетического каучука, пластмасс и синтетических смол и др.);
- производство ПАВ (поверхностно-активных веществ);
- производство фармацевтической продукции;
- производство красок;
- производство искусственных и синтетических волокон;
- производство химических средств защиты растений.
Существует также несколько иная классификация химического производства, включающая, помимо горно-химической отрасли, основную химию, химию органического синтеза (производство основных органических веществ), химико-фармацевтическую промышленность и производство бытовой химии.

В данной классификации производство синтетических волокон, а также лаков и красок относится к химии органического синтеза.
В любом случае, разделение по отраслям является достаточно условным, поскольку многие современные предприятия-холдинги производят разные виды продукции с целью комплексного использования сырья (пример холдинг "Титан").
ТЕМА:Химия в сельском хозяйстве. Химизация сельского хозяйства и ее направления. Растения и почва, почвенный поглощающий комплекс. Удобрения и их классификация.
ТЕМА:Химические средства защиты растений. Отрицательные последствия применения пестицидов и борьба с ними. Химизация животноводства.
Химия в сельском хозяйстве и её направления
Химизация — это одно из направлений научно-технического прогресса, основанное на широком применении химических веществ, процессов и методов в различных отраслях, например в сельском хозяйстве.
Основные направления химизации сельского хозяйства:
Производство минеральных макро- и микроудобрений, а также кормовых фосфатов.
Внесение извести, гипса и других веществ для улучшения структуры почв.
Применение химических средств защиты растений: гербицидов, зооцидов и инсектицидов и т. д.
Использование в растениеводстве стимуляторов роста и плодоношения растений.
Разработка способов выращивания экологически чистой сельскохозяйственной продукции.
Повышение продуктивности животных с помощью стимуляторов роста, специальных кормовых добавок.
Производство и применение полимерных материалов для сельского хозяйства.
Производство материалов для средств малой механизации, использующихся в сельском хозяйстве.
Основная цель химизации сельского хозяйства — обеспечение роста производства, улучшение качества и продление сроков сохранности сельскохозяйственной продукции, повышение эффективности земледелия и животноводства.
Удобрения и их классификация
Эффективность удобрений значительно возрастает, если их применяют в комплексе с другими приемами агротехники. Сейчас в мире более 90% удобрений не возвращается в почву, откуда они взяты с урожаем, а безвозвратно теряется в сточных трубах городов и населенных пунктов. Чудовищная концентрация населения в городах привела к извлечению из почвы всех минеральных удобрений, вследствие чего почва производит продукты питания низкого биологического качества, которые снижают энергию и жизнедеятельность народа. Однако чрезмерное и неправильное использование удобрений в сельском хозяйстве дает также значительный отрицательный эффект. Использование удобрений и пестицидов в сельском хозяйстве приводит к избыточному содержанию нитритов и нитратов в сельскохозяйственной продукции, загрязнению водоемов, морей и океанов вымываемых удобрениями.
По происхождению удобрения разделяют на:
неорганические (минеральные)
органические
органо-минеральные
бактериальные.
Минеральные удобрения — неорганические вещества (в основном соли), содержащие необходимые для растений элементы питания. Их получают химической или механической обработкой неорганического сырья и другими способами.
По составу бывают:
Азотные
Фосфорные
Калийные
Микроудобрения (борные, молибденовые и т. д.)
Органические удобрения. Питательные элементы в них находятся в веществах растительного и животного происхождения. Это навоз, торф, жмых, фекалии, пищевые отходы и отбросы, люпин, сераделла.
Органо-минеральные удобрения содержат органические и минеральные вещества. Их получают путем обработки аммиаком и фосфорной кислотой органических веществ (торфа, сланцев, бурого угля) или путем смешивания навоза либо торфа с фосфорными удобрениями.
Бактериальные удобрения — препараты, содержащие культуру микроорганизмов, фиксирующих органическое вещество почвы и удобрений (азотобактерин, нитрагин почвенный).
По агрегатному состоянию они могут быть:
Твердыми
Жидкими
Суспензированными
По агрохимическому воздействию они могут быть:
Прямые
Косвенные
Препараты, регулирующие рост растений
I. Прямые удобрения предназначаются для непосредственного питания растений. Они содержат азот, фосфор, калий, магний, серу, железо и микроэлементы (В, Mo, Cu, Zn) и делятся на:
a) Простые, которые содержат один из элементов питания: азот, фосфор, калий, молибден и т. д. В свою очередь, их подразделяют на:
1) азотные удобрения, которые различают по форме соединений азота:
Аммиачные
Аммонийные
Нитратные
Амидные
Их сочетания
2) фосфорные удобрения, в основу классификации которых положена их растворимость в воде и органических кислотах, они делятся на:
растворимые в воде (гидрофосфат аммония)
нерастворимые в воде, но растворимые в растворах лимонной кислоты и ее солей (преципитат)
труднорастворимые в воде (фосфоритная мука, простой суперфосфат)
3) калийные удобрения разделают на:
сырые соли (минералы каинит, сильвинит)
концентрированные удобрения, полученные переработкой природных калийных солей (КС1, K2SO4), золы (древесные и торфяные), содержащие поташ — К2СО3
4) микроудобрения — технические смеси, содержащие микроэлементы В(ОН)3 (Н3ВО3, молибдат аммония и др.).
b) Комплексные удобрения: содержат не менее двух питательных элементов.
II. Косвенные удобрения применяют для химического, физического, микробиологического воздействия на почву с целью улучшения условий использования удобрений. Например, для нейтрализации кислотности почв применяют молотые известняки, доломит, гашеную известь; для мелиорации солонцов используют гипс; для подкисления почв используют гидросульфит натрия.
Химическая мелиорация почв
Химическую мелиорацию проводят для улучшения качества почв с повышенной кислотностью или щелочностью. В первом случае осуществляют известкование, во втором — гипсование.
Химические средства защиты растений
Ежегодно из-за вредителей, сорняков и болезней в мире теряется до 24% урожая. Суммарный ущерб сельскому хозяйству ежегодно исчисляется в 70 млрд долларов.
Для борьбы с вредителями, сорняками и болезнями в нашей стране ежегодно выпускают более 500 тыс. т пестицидов. Их применение позволяет сберечь до сотни тысяч тонн урожая в год.
По назначению пестициды делят на:
инсектициды (для борьбы с вредными насекомыми)
фунгициды ( для излечения растений и почвы от грибковых заболеваний)
гербициды (для уничтожения сорняков)
бактерициды (для уничтожения вредных микроорганизмов)
зооциды (для уничтожения грызунов)
половые аттрактанты (для приманки вредителей и их уничтожения)
репелленты (для отпугивания вредных насекомых от растений, которыми они питаются)
хемостерилянты (для стерилизации вредных насекомых)
Широкое применение пестицидов не только ведет к росту урожайности, но и к таким отрицательным последствиям, как:
гибель диких животных при обработке полей пестицидами
массовое размножение вредителей после применения пестицидов
появление вредителей, устойчивых к пестицидам
Уменьшить вредное влияние пестицидов на природу можно, пользуясь следующими методами борьбы с грызунами:
Карантинный метод (предепреждение распространения вредителей)
Селекционный метод (выведении сортов растений и пород животных, устойчивых к болезням и вредным насекомым)
Агротехнический метод (обработки почвы, введение севооборотов и т.д.)
Химический метод (созданию новых пестицидов с высокой избирательностью действия и большой скоростью распада)
Физический способ (ультразвук, ультрафиолет, электропропольник и т.д.)
Химизация животноводства — это комплекс мер, способствующих повышению качества кормов и продуктивности животных. Основные ее направления:
- производство химических консервантов и стабилизаторов кормов;
- производство кормовых дрожжей и микробиологического белка;
- использование мочевины и других кормовых добавок;
- применение стимуляторов роста животных.
Так, для создания прочной кормовой базы важно не только увеличить заготовку кормов, но и улучшить их качество, снизить потери при уборке и хранении. Наиболее прогрессивная форма заготовки зеленых кормов — химическое консервирование, так как оно обеспечивает хорошую сохранность питательных веществ, подавляет развитие гнилостных и маслянокислых бактерий, предотвращает нежелательные ферментативные процессы. В качестве консервантов используют пропионовую и бензойную кислоты, дисульфат натрия Na2S2O7 и гидросульфат натрия NaHSO4, концентрат низкомолекулярных кислот. Химические добавки при силосовании трав, кукурузы, подсолнечника и бобово-злаковых смесей повышают качество корма и значительно сокращают потери питательных веществ. Для повышения содержания перевариваемого протеина в рационах скота и птицы используют кормовые дрожжи, белки микробного происхождения, мочевину и другие вещества. Так, применение 1 т кормовых дрожжей в рационе птицы позволяет дополнительно получить по 2 т мяса или 35 тыс. яиц.
При составлении пищевых рационов для откорма животных в настоящее время экологически более обоснованно вводить в растительную пищу незаменимые аминокислоты, которые получают ферментативным или полным синтезом. Так, добавкой 0,4% лизина к пшеничной муке можно повысить ее биологическую ценность не менее чем на 50%.
Недостаток протеина в рационе животных можно восполнить, используя мочевину, бикарбонат аммония и другие аммонийные соли органических и минеральных кислот, безопасные в экологическом отношении. Скармливание животным мочевины позволяет экономить от 20 до 35% кормового белка.
Полноценность рационов сельскохозяйственных животных во многом определяется тем, насколько они сбалансированы по содержанию минеральных веществ, витаминов и других биологически активных веществ.
Напомним значение одного из важнейших биогенных элементов — фосфора. Он входит в состав молекул сложных белков, нуклеиновых кислот, фосфатидов, фитина и других веществ, без которых невозможна жизнь. Содержание фосфора в теле животного (в пересчете на Р2O5) достигает 1 %.
Фосфор вместе с кальцием составляет основу костей животных. На эти два элемента приходится около 65— 70% всех минеральных веществ. Они играют очень важную роль в обмене веществ, поэтому для нормального роста и развития животные нуждаются в кормовых фосфатах. Включение их в рацион коров на 5—10% увеличивает надои молока. Для восполнения дефицита фосфора в качестве кормовых добавок используют также гидроортофосфаты натрия и аммония, кормовой преципитат. Вместе с тем избыток фосфора в рационе затрудняет всасывание и усвоение организмом животного солей магния.
Важную роль в организме животных играют и другие химические элементы. Железо, медь, марганец, кобальт и кальций участвуют в синтезе гемоглобина, сера — в синтезе белка. Иод является составной частью гормона щитовидной железы, хлор — соляной кислоты. Многим животным необходима поваренная соль, содержащая натрий и хлор.
Применение витаминов и стимуляторов роста обеспечивает увеличение суточных привесов крупного рогатого скота, свиней, овец и цыплят.
Чаще всего биологически активные вещества дают в виде так называемых премиксов — смеси микроэлементов, витаминов, ферментных препаратов, антибиотиков.
Вопросы (Уметь устно отвечать,данные вопросы могут быть в контрольной)
- Что понимают под химизацией сельского хозяйства? Каковы ее основные направления?
- Рассмотрите на примерах взаимосвязь растений и почвы.
- Что такое ППК? Какие существуют виды поглощения веществ почвой?
- Рассмотрите общую классификацию удобрений и сравните экологическую безопасность минеральных и органических удобрений.
- Какова классификация удобрений: а) минеральных; б) органических? Ответ иллюстрируйте примерами.
- Какую роль играют микроудобрения в повышении урожайности сельскохозяйственных культур? Существуют ли ультрамикроудобрения? Приведите примеры.
- Что понимают под химической мелиорацией почв? Какие ее виды вам известны? В чем сущность каждого из видов?
- Что такое пестициды? Какие виды пестицидов вы знаете? Какие из них используются: а) в вашем приусадебном (дачном) хозяйстве; б) в быту?
- Как уменьшить отрицательные последствия применения пестицидов на практике?
- Какие направления химизации животноводства вы знаете? Расскажите о каждом из них и опишите значение отдельных химических веществ в животноводстве для решения продовольственной проблемы.
ГРУППА 301 ХИМИЯ 53,54
ТЕМА: Практическая работа №3
Решение экспериментальных задач на идентификацию органических соединений.
Цель работы: повторить основные качественные реакции органических веществ, научиться решать экспериментальные задачи на распознавание органических веществ.
Реактивы и оборудование: раствор KMnO4(розовый), Аммиачный раствор оксида серебра – реактив Толленса[Ag(NH3)2]OH (упрощённо +Ag2O NH3 раствор→), раствор FeCl3(светло-жёлтый), свежеосаждённый гидроксид меди (II) в сильнощелочной среде, лакмус, фенолфталеин, насыщенный раствор соли кальция.
Литература: Г.Е.Рудзитис, Ф.Г.Фельдман, химия 10 класс, стр.149
С правилами по технике безопасности ознакомлен:______________________(подпись)
Ход работы:
Оформить работу в виде отчетной таблицы.
Отчетная таблица
Что делали | Что наблюдали | Уравнения реакций | Выводы |
|
|
|
|
|
|
|
1.Распознавание уксусной кислоты (уксусная кислота –одна из самых древних кислот ,которую удалось выделить и использовать человечеству. В организме человека за сутки образуется до 400 грамм этой кислоты)
СuSО4 + 2NаОН → | Сu(ОН)2 ↓ | + Nа2SО4 |
голубой осадок |
2СН3 – СООН + Сu(ОН)2 → (СН3 – СОО)2Сu + Н2О
Получить свежеосажденный гидроксид меди. Прилить к нему 1 – 2 мл этанола. Голубой осадок растворяется, образуя раствор такого же цвета.
2. Распознавание глюкозы
СuSО4 + 2NаОН → | Сu(ОН)2 ↓ | + Nа2SО4 |
голубой осадок |
СН2ОН – (СНОН)4 – СНО + 2Сu(ОН)2 ![]() СН2ОН – (СНОН)4 – СООН + Сu2О↓ +2Н2О
СН2ОН – (СНОН)4 – СООН + Сu2О↓ +2Н2О
К 1 – 2 мл глюкозы прилить свежеосажденный гидроксид меди. Сначала осадок растворяется, затем при нагревании раствор приобретает окраску от красной до желто – оранжевой. Это свидетельствует о наличии в исследуемой жидкости глюкозы.
3. Распознавание глицерина(глицерин входит в состав мазей, в пищевой промышленности глицерин под кодом Е-422).
2СН2ОН – СНОН – СН2ОН + Сu(ОН)2 → глицерат меди (II) + 2Н2О
К 2 мл глицерина прилить свежеосажденный гидроксид меди. Раствор окрашивается в ярко – синий цвет в результате образования комплексного соединения глицерата меди (II).
4. Распознавание сахарозы. Сахар-сложное орган.в-во, содержащее много С. Чтобы доказать возьмем немного сахара и добавим к нему серную кислоту. Она забирает воду, получается свободный углерод(черное в-во) С12Н22О11-----серн.к-та------------12С+11Н2О
5.Распознавание крахмала. Капнем р-ром иода на картофель и белый хлеб. Если образуется синее пятно, то они содержат крахмал.
6. Определение кислотности р-ров глицерина и мыла с помощью имеющихся индикаторов.
(лакмус, фенолфталеин,метилоранж). Глицерин имеет слабокислую среду, а мыло-щелочную.
Общий вывод(на основе цели)!
(((
1. Распознавание уксусной кислоты (уксусная кислота – одна из самых древних кислот, которую удалось выделить и использовать человечеству. В организме человека за сутки образуется до 400 грамм этой кислоты) СuSО4 + 2NаОН →Сu(ОН)2 ↓+ Nа2SО4
2СН3 – СООН + Сu(ОН)2 → (СН3 – СОО)2Сu + Н2О
Получить свежеосажденный гидроксид меди. Прилить к нему 1 – 2 мл этанола. Голубой осадок растворяется, образуя раствор такого же цвета.
2. Распознавание глюкозы
СuSО4 + 2NаОН → Сu(ОН)2 ↓ + Nа2SО4
СН2ОН – (СНОН)4 – СНО + 2Сu(ОН)2 СН2ОН – (СНОН)4 – СООН + Сu2О↓ +2Н2О
К 1 – 2 мл глюкозы прилить свежеосажденный гидроксид меди. Сначала осадок растворяется, затем при нагревании раствор приобретает окраску от красной до желто – оранжевой. Это свидетельствует о наличии в исследуемой жидкости глюкозы.
3. Распознавание глицерина (глицерин входит в состав мазей, в пищевой промышленности глицерин под кодом Е-422).
2СН2ОН – СНОН – СН2ОН + Сu(ОН)2 → глицерат меди (II) + 2Н2О
К 2 мл глицерина прилить свежеосажденный гидроксид меди. Раствор окрашивается в ярко – синий цвет в результате образования комплексного соединения глицерата меди (II).
4. Распознавание сахарозы. Сахар-сложное орган. в-во, содержащее много С. Чтобы доказать возьмем немного сахара и добавим к нему серную кислоту. Она забирает воду, получается свободный углерод (черное в-во) С12Н22О11---серн.к-та--12С+11Н2О
5. Распознавание крахмала. Капнем р-ром иода на картофель и белый хлеб. Если образуется синее пятно, то они содержат крахмал.
6. Определение кислотности р-ров глицерина и мыла с помощью имеющихся индикаторов.
(лакмус, фенолфталеин,метилоранж). Глицерин имеет слабокислую среду, а мыло-щелочную.)))_
ТЕМА:
.Практическая работа №4. Распознавание пластмасс и волокон.
Тема: «Распознавание пластмасс и волокон»
Оборудование и реактивы: образцы пластмасс и волокон под номерами, спиртовка, спички, стеклянные палочки, тигельные щипцы, асбестовые сетки.
Распознавание пластмасс
В разных пакетах под номерами имеются образцы пластмасс. Пользуясь при веденными ниже данными, определите, под каким номером какая пластмасса находится.
Полиэтилен. Полупрозрачный, эластичный, жирный на ощупь материал. При нагревании размягчается, из расплава можно вытянуть нити. Горит синеватым пламенем, распространяя запах расплавленного парафина, продолжает гореть вне пламени.
Поливинилхлорид. Эластичный или жесткий материал, при нагревании быстро размягчается, разлагается с выделением хлороводорода. Горит коптящим пламенем, вне пламени не горит.
Полистирол. Может быть прозрачным и непрозрачным, часто хрупок. При нагревании размягчается, из расплава легко вытянуть нити. Горит коптящим пламенем, распространяя запах стирола, продолжает гореть вне пламени.
Полиметилметакрилат. Обычно прозрачен, может иметь различную окраску. При нагревании размягчается, нити не вытягиваются. Горит желтоватым пламенем с синей каймой и характерным потрескиванием, распространяя эфирный запах.
Фенолформальдегидная пластмасса. Темных тонов (от коричневого до черного). При нагревании разлагается. Загорается с трудом, распространяя запах фенола, вне пламени постепенно гаснет.
Распознавание волокон
В разных пакетах под номерами содержатся образцы волокон. Пользуясь приведенными ниже данными, определите, под каким номером какое волокно находится.
Хлопок. Горит быстро, распространяя запах жженой бумаги, после сгорания остается серый пепел.
Шерсть, натуральный шелк. Горит медленно, с запахом жженых перьев, после сгорания образуется черный шарик, при растирании превращающийся в порошок.
Ацетатное волокно. Горит быстро, образуя нехрупкий, спекшийся шарик темно-бурого цвета. В отличие от других волокон растворяется в ацетоне.
Капрон. При нагревании размягчается, затем плавится, из расплава можно вытянуть нити. Горит, распространяя неприятный запах.
Лавсан. При нагревании плавится, из расплава можно вытянуть нити. Горит коптящим пламенем с образованием темного блестящего шарика.
Краткие теоретические и учебно-методические материалы
по теме практического занятия
Полимерами называют вещества, молекулы которых состоят из множества повторяющихся структурных звеньев, соединенных между собой химическими связями. Существует два основных способа получения полимеров — реакции полимеризации и реакции поликонденсации.
Реакция полимеризации — это химический процесс соединения множества исходных молекул низкомолекулярного вещества (мономера) в крупные молекулы (макромолекулы ) полимера.
В реакцию полимеризации могут вступать соединения, содержащие кратные связи, то есть непредельные соединения. Это могут быть молекулы одного мономера или разных мономеров.
В первом случае происходит реакция гомополимеризации — соединение молекул одного мономера, во втором — реакция сополимеризации — соединение молекул двух и более исходных веществ.
К реакциям гомополимеризации относятся реакции получения полиэтилена, полипропилена, поливинилхлорида и т. д., например:
Выражение в скобках называют структурным звеном, а число n-в формуле полимера — степенью полимеризации.
К реакциям сополимеризации относится, например, реакция получения бутадиен-стирольного каучука.
Реакция поликонденсации — это химический процесс соединения исходных молекул мономера в макромолекулы полимера, идущий с образованием побочного низкомолекулярного продукта (чаще всего воды).
В реакции поликонденсации вступают молекулы мономеров с функциональными группами.
Например, реакция получения фенолформальдегидных смол: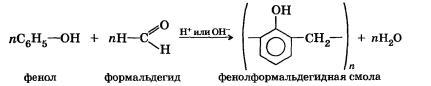
С помощью реакций поликонденсации получают полиэфиры, полиамиды, полиуретаны, полиакрил и т. д.
Пластмассы.
Пластмассами называют материалы, изготовляемые на основе полимеров. Пластмассы сочетают в себе разнообразные ценные качества, такие как лёгкость, прочность, химическая
стойкость и др., которые обусловили проникновение их в различные отрасли народного хозяйства. Кроме полимеров (их часто называют смолой) в пластмассах почти всегда содержатся другие компоненты, придающие материалу определённые качества. Полимерное вещество является для них связующим.
В пластмассы входят наполнители (древесная мука, ткань, асбест, стекловата и др.), которые улучшают их механические свойства.
Пластификаторы – повышают эластичность, устраняют хрупкость.
Стабилизаторы – способствуют сохранению свойств пластмасс в процессе их переработки и использования; красители придают необходимую окраску.
Обычные способы получения полимеров – это реакции полимеризации, лежащие в основе получения термопластичных пластмасс, и реакции поликонденсации, лежащие в основе получения термореактивных пластмасс.
Термопластичные полимеры при нагревании размягчаются и в этом состоянии легко изменяют форму, которую сохраняют при охлаждении. При следующем нагревании они снова размягчаются и могут принимать новую форму.
Термореактивные полимеры при нагревании сначала становятся пластичными, при дальнейшем нагревании утрачивают пластичность, становятся неплавкими. Повторно переработать такой полимер в новое изделие невозможно.
Наиболее типичными способами получения изделий из термопластичных пластмасс является литьё под давлением и экструзия (выдавливание), а из термореактивных пластмасс – горячее прессование.
Краткая характеристика некоторых пластмасс
Полиэтилен – твёрдый, жирный на ощупь, белого цвета термопластичный полимер. Стоек по отношению к агрессивным средам. Благодаря высокой температуре плавления, обладает существенными преимуществами перед другими материалами (полиэтиленом, полиметилметакрилатом, поливинилхлоридом), близким по свойствам.
Полипропилен идёт на изготовление высокопрочной изоляции, труб, деталей машин, химической аппаратуры. Благодаря высокой механической прочности, его используют для изготовления канатов, сетей, технических тканей.
Поливинилхлорид – обладает большой химической стойкостью, хорошими электроизоляционными свойствами и большой механической прочностью. Термопластичный полимер, на его основе изготавливают два вида пластмасс: винипласт, обладающий значительной жесткостью и пластикат – более мягкий материал.
Винипласт идёт на изготовление химически стойкой аппаратуры, ванн для никелирования, жестких плёнок. Пластикат используется для изоляции, для производства предметов широкого потребления (плащей, сумок, линолеума, клеенок, для получения материалов, заменяющих кожу – в производстве обуви).
Полиметилметакрилат – за свою прозрачность называется органическим стеклом. Обладает удовлетворительной прочностью и значительно меньшей хрупкостью, чем обычное силикатное стекло, способностью пропускать ультрафиолетовые лучи. Термопластичный полимер, находит применение в строительстве, в часовом деле, различных отраслях промышленности и в быту.
Фенолформальдегидная смола – обычно используется в смеси с наполнителями, красителями и т.п., а затем уже производят формование изделий способом горячего прессования. Термореактивный полимер. Введение различных наполнителей позволяет получить материалы, имеющие ценные свойства. Так текстолит и стеклотекстолит, армированные текстильными тканями и стеклотканью, по прочности близки к дюралюминию и стали.
Текстолит – хлопчатобумажная ткань, пропитанная фенолформальдегидной смолой и спрессованная при повышенной температуре. Устойчив к нагрузкам. Легко поддаётся механической обработке. Применяется для изготовления шарикоподшипников, шестерёнки для машин, предусмотренных для больших нагрузках.
Таблица 1 « Распознавание пластмасс»
Название пластмассы | Отношение к нагреванию | Характер горения |
Полиэтилен | Размягчается – можно вытянуть нить. | Горит синеватым пламенем, распространяя слабый запах горящего парафина. При горении отделяются капли. Вне пламени продолжает гореть. |
Поливинилхлорид (полихлорвинил) | Размягчается при 60-70˚С, выше 110-120˚С разлагается. | Горит коптящим пламенем. Вне пламени не горит. |
Полистирол | Размягчается – легко вытягиваются нити. | Горит коптящим пламенем, распространяя специфический запах. Вне пламени продолжает гореть. |
Полиметилметакрилат (орг. стекло) | Размягчается. | Горит жёлтым пламенем, с синей каймой у краев, с характерным потрескиванием, распространяя резкий запах. |
Целлулоид | Разлагается. | Горит очень быстро, оставляя следы золы. |
Фенолформальдегидные пластмасы | Разлагается при сильном нагревании | Загорается с трудом, при горении обугливается, распространяя резкий запах фенола. Вне пламени постепенно гаснет, не размягчается. |
Волокна
– природные или искусственные высокомолекулярные вещества, отличающиеся от других полимеров более высокой степенью упорядоченности молекул и, как следствие, особыми физическими свойствами, позволяющими использовать их для получения нитей. Волокна делят на натуральные (природные) и химические. Натуральные волокна могут быть растительного или животного происхождения. Химические волокна в свою очередь подразделяют на искусственные и синтетические.
Природные волокна:
Волокно растительного происхождения – хлопок, лен.
Хлопковое волокно получают из субтропического растения – хлопчатника. Хлопковое волокно легкое, достаточно прочное, мягкое, гигроскопичное.
Волокна животного происхождения – шерсть и шелк.
Шелк вырабатывают многочисленные гусеницы и пауки.
Шерсть – волокна волосяного покрова овец, коз, верблюдов и других животных.
Искусственные волокна:
Наибольшее значение среди искусственных волокон занимают ацетатное и вискозное волокна, получаемые из древесной целлюлозы.
Синтетические волокна:
из синтетических волокон наибольший интерес представляют полиамидное волокно – полиамид – 6 (капрон) и полиэфирное – полиэтиленгликольтерефталат (лавсан).
Капрон получают из капролактала, который под воздействием воды размыкает цикл, образуя ε – капроновую кислоту. Из этой кислоты в результате поликонденсации образуется полимер линейной структуры:
n H2N – (CH2)5 – COOH → [- NH – (CH2)5 – CO -]n + (n-1)H2O
Лавсан (полиэтилентерефталат) - представитель полиэфиров:

Получают реакцией поликонденсации терефталевой кислоты и этиленгликоля:
HOOC-C6H4-COOH + HO-CH2CH2-OH + HOOC-C6H4-COOH + … →
→ HOOC-C6H4-CO – O-CH2CH2-O – OC-C6H4-CO – … + nH2O
полимер-смола
В общем виде:
n HOOC-C6H4-COOH + n HO-CH2CH2-OH →
→ HO-(-CO-C6H4-CO-O-CH2CH2-O-)n-H + (n-1) H2O
Таблица 2. «Распознавание волокон»
Волокно | Сжигание |
Хлопок | Горит быстро с запахом жжёной бумаги. После горения остается серый пепел. |
Шерсть | Горит медленно с запахом жжёных перьев. После горения образуется хрупкий чёрный шарик, растирающийся в порошок. |
Ацетатное волокно | Горит быстро, образуя нехрупкий спёкшийся тёмно-бурый шарик. Вне пламени горение постепенно прекращается. |
Капрон | Плавится, образуя твёрдый блестящий шарик тёмного цвета. При горении распространяется неприятный запах. |
Лавсан | Плавится, затем горит коптящим пламенем с образованием тёмного твердого блестящего шарика. |
Нитрон | Горит, образуя тёмный рыхлый неблестящий шарик. |
Вопросы для закрепления теоретического материала к практическому занятию:
Дайте определения следующим понятиям: полимеры, структурное звено, степень полимеризации.
В чем разница между реакциями полимеризации и поликонденсации?
Какие полимеры называются термопластичными?
Какие полимеры называются термореактивными?
Дайте классификацию волокон.





