28.11.22г. ПОНЕДЕЛЬНИК 501,406,405
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 501 ХИМИЯ 11,12
ТЕМА 11,12: Строение электронных оболочек атомов элементов малых периодов. Особенности строения электронных оболочек атомов элементов больших периодов (переходных элементов). Понятие об орбиталях. s-, р- и d-Орбитали.
Состояние электронов в атоме. Строение атомов элементов больших и малых периодов.
По современным представлениям атом состоит из положительно заряженного ядра и движущихся вокруг него электронов. В ядре содержатся протоны и нейтроны. Число протонов, а также электронов равно порядковому номеру элемента.
Частица масса заряд
Протон 1 +1
Нейтрон 1 0
Электрон ≈ 0 – 1
Сумма протонов и нейтронов численно равна относительной атомной массе элемента.
Пространство вокруг ядра, в котором наиболее вероятно место нахождения электрона, называется орбиталью или электронным облаком. Формы электронных облаков различны (s, p, d, f ); О – s- орбиталь ; ∞ – p- орбиталь
Электронные облака d и f имеют более сложную форму.
Электроны, двигаясь в пространстве вокруг ядра , образуют его электронную оболочку, которая делится на электронные слои или уровни. Распределение электронов по электронным слоям (уровням) можно представить следующим образом: +1 H ) +6 C ) ) +12 Mg ) ) )
1 2 4 2 8 2
Максимальное число электронов в электронном слое (уровне) определяется по формуле: N = 2 n 2, где n – номер электронного слоя (уровня).
Число электронных слоев (уровней) равно номеру периода, в котором находится элемент. Уровни делятся на подуровни (s, p, d, f) и заполняются электронами в определенной последовательности. В зависимости от того, какой подуровень последним заполняется электронами, все элементы делятся на 4 семейства: s, p, d, f – элементы. Число валентных электронов (участвующих в образовании химических связей) численно равно номеру группы.
Электронная конфигурация атомов отображается с помощью электронных формул, например, атом водорода имеет электронную конфигурацию: 1 S1
А атом углерода – 1 S 2 2 S 2 2 P 2.
У элементов малых и больших периодов строение электронных оболочек атомов отличается. В малых периодах слева направо число внешних электронов увеличивается резко – от 1 до 8 и свойства элементов также меняются резко - от металлическим к неметаллическим. Так, в начале 3 периода стоит типичный металл натрий (легко отдает 1 электрон внешнего уровня), а в конце периода – типичный неметалл хлор (легко присоединяет 1 электрон до завершения уровня). Завершает период аргон – инертный газ.
Свойства соединений элементов изменяются от основных к кислотным через амфотерные. Оксиды натрия и магния – основные, оксид алюминия – амфотерный, а оксиды кремния, фосфора, серы и хлора – кислотные.
Большие периоды состоят из 2-х рядов. В четных рядах больших периодов на внешнем уровне число эдектронов не меняется (равно 1 или 2), идет дозаполнение предыдущего снаружи уровня (d – подуровень, элементы «вставных» декад), поэтому свойства элементов меняются плавно, здесь все элементы – металлы. В нечетных рядах число внешних эектронов снова резко растет, как в малом периоде, от 1 до 8 и свойства элементов снова меняются резко - от металлических к неметаллическим. Однако, в целом, в начале любого большого периода – типичные металлы, а в конце – типичные неметаллы, т. е. при переходе от одного периода к другому наблюдается периодичность изменения свойств элементов, а значит, и их соединений. Свойства элементов, их оксидов, гидратов этих оксидов (и водородных соединений элементов главных подгрупп) периодически повторяются
В группах (в главных подгруппах) сверху вниз, с ростом заряда ядра и радиуса атома металлические свойства усиливаются, а неметаллические ослабевают, основность соединений в подгруппе сверху вниз усиливается.
ГРУППА 406 ХИМИЯ 25,26,27
ТЕМА 25: Применение этилена на основе свойств.
| Углеводороды, в молекулах которых содержатся две двойные углерод-углеродные связи и общая формула которых СnН2n-2, называют диеновыми углеводородами, или алкадиенами, или диенами. |
В соответствии с третьим положением теории химического строения даже незначительные изменения в структуре вещества могут существенно изменить его химические свойства, а следовательно, сделать незаменимым для производства жизненно необходимых материалов. Не будь углеводородов этого класса, нам пришлось бы обходиться без резины и каучука, а точнее без всего бесчисленного ассортимента изделий, изготовленных из этих материалов.
Большое значение в производстве каучуков имеют диеновые углеводороды особого строения: в их молекулах две двойные связи разделены одной одинарной. Такие диены называют сопряжёнными диенами.
Простейший сопряжённый диен — бутадиен-1,3 имеет формулу СН2=СН—СН=СН2. Как видите, в международных названиях алкадиенов указывают номера обоих атомов углерода, от которых начинаются двойные связи в молекуле.
Ещё один важнейший диеновый углеводород — 2-метилбутадиен-1,3 (его чаще называют изопрен) имеет формулу 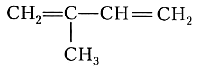
Способы получения алкадиенов
Для получения диеновых углеводородов в промышленности используют реакцию дегидрирования, т. е. отщепления водорода. В качестве исходного вещества берут предельный углеводород с тем же строением углеродной цепи, что и у получаемого продукта. Понятно, что для образования двух двойных связей С=С алкан должен отдать четыре атома, т. е. две молекулы водорода. Например, для синтеза изопрена в качестве исходного вещества необходимо взять 2-метилбутан: 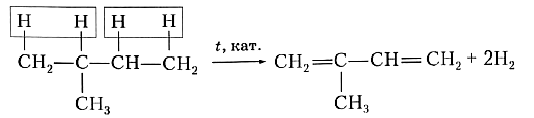
или 
Рассмотренная реакция наглядно показывает, что в составе алкадиенов на четыре атома водорода меньше, чем в молекулах соответствующих предельных углеводородов, и на два атома водорода меньше, чем в молекулах соответствующих алкенов.

(с) Цитата из справочного издания «ХИМИЯ. Справочник в таблицах / М.: Издательство АЙРИС-пресс»
Алкадиены. Химические свойства
Будучи непредельными углеводородами, алкадиены, подобно алкенам, склонны к реакциям присоединения. Они так же, как алкены, обесцвечивают бромную воду и раствор перманганата калия.
Особенность реакций присоединения диеновых углеводородов состоит в том, что две сопряжённые связи проявляют себя как единое целое. Присоединение галогена происходит не по одной двойной связи, а за счёт крайних атомов углерода сопряжённой системы двойных связей: 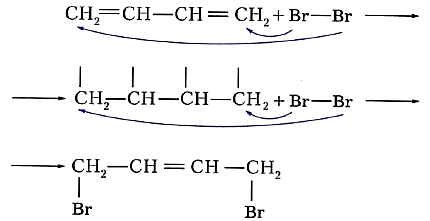
или ![]()
Продукт реакции 1,4-дибромбутен-2 также содержит двойную связь и, следовательно, тоже способен присоединять молекулу брома: ![]()
Аналогичным образом диеновые углеводороды присоединяют водород (реакция гидрирования): 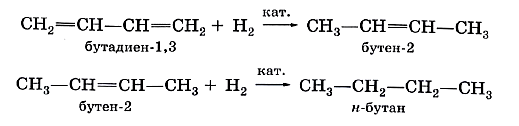
Каучук и продукты его вулканизации
Сопряжённые диеновые углеводороды способны к реакциям полимеризации, в результате которых получают синтетические каучуки.
Каучуки можно рассматривать как продукты полимеризации сопряжённых диенов или их производных. Каучуки относят к эластомерам. Такое название эти полимеры получили потому, что обладают эластичностью (от греч. elastikos — растяжимый), т. е. способностью обратимо изменять форму под действием внешних сил. Другие ценные свойства каучуков — водо- и газонепроницаемость — также широко используют в промышленном производстве.
Природными источниками каучука служат растения, богатые млечным соком: гевея, фикусы, молочаи, одуванчики. В промышленных масштабах натуральный (природный) каучук получают из сока тропического дерева гевеи. Такой каучук можно рассматривать как продукт полимеризации изопрена, или 2-метилбутадиена-1,3.
Чувствительность натурального каучука к перепадам температур и потерю при этом эластичности устраняет его вулканизация. Этот процесс заключается в «сшивании» полимерных цепей атомами серы при нагревании за счёт разрыва некоторой части двойных связей в этих цепях. Так получают резину. Если же «сшить» полимерные цепи каучука атомами серы за счёт разрыва подавляющего большинства двойных связей, то образуется эбонит, который уже не обладает эластичностью. Из него раньше изготавливали детали электрической арматуры, так как он хороший диэлектрик.
Каучуконосы нашей страны (одуванчики кок-сагыз и тау-сагыз) содержат очень мало млечного сока, а потому не могут использоваться в качестве источника натурального каучука. Проблему получения синтетического каучука решил коллектив учёных под руководством академика С. В. Лебедева в 1931 г. Этот каучук назвали бутадиеновым каучуком, поскольку в качестве мономера для его получения был выбран бутадиен-1,3. В процессе полимеризации двойные связи алкадиена разрываются, за счёт освободившихся валентностей крайних углеродных атомов растёт полимерная цепь. Одновременно с этим между центральными атомами углерода образуется двойная связь:
nСН2=СН—СН=СН2 → (—СН2—СН=СН—СН2—)„
Коллективом под руководством С. В. Лебедева был разработан также уникальный способ получения исходного диенового углеводорода — бутадиена-1,3 — на основе этилового спирта: 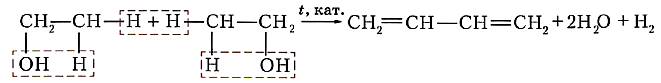
или ![]()
Эту реакцию называют реакцией Лебедева.
Синтетический бутадиеновый каучук обладает такими ценными качествами, как газо- и водонепроницаемость, однако уступает натуральному в эластичности.
В 60-х гг. прошлого столетия был получен эластичный синтетический каучук на основе изопрена — синтетический изопреновый каучук: 
По эластичности и износоустойчивости изопреновый каучук сходен с природным и так же, как бутадиеновый, используется для производства шин.
Общая формула СnH2n-2 отражает состав не только алкадиенов, но и ацетиленовых углеводородов. Речь о них пойдёт в следующем конспекте.
ТЕМА 27: Химические свойства бутадиена-1,3 и изопрена: обесцвечивание бромной воды и полимеризация в каучуки .
Химические свойства бутадиена-1,3 и изопрена: обесцвечивание бромной воды и полимеризация в каучуки.
Химические свойства сопряженных алкадиенов
Сопряженные алкадиены – непредельные нециклические углеводороды, в молекулах которых две двойные связи образуют сопряженную систему.
Химические свойства алкадиенов похожи на свойства алкенов. Алкадиены также легко вступают в реакции присоединения и окисления.
| Химические свойства сопряженных алкадиенов отличаются от алкенов некоторыми особенностями, которые обусловлены делокализацией электронной плотности π-связей. |
1. РЕАКЦИИ ПРИСОЕДИНЕНИЯ
Для алкадиенов характерны реакции присоединения по одной из двойных связей С=С, либо по обоим связям. Реакции с водой, галогенами и галогеноводородами протекают по механизму электрофильного присоединения. При присоединении одной молекулы реагента к алкадиену рвется только одна двойная связь. При присоединении двух молекул реагента к алкадиену разрываются обе двойные связи.
| Помимо присоединения по одной из двух двойных связей (1,2-присоединение), для сопряженных диенов характерно так называемое 1,4-присоединение, когда в реакции участвует вся делокализованная система из двух двойных связей, реагент присоединяется к 1 и 4 атому углерода сопряженной системы, а двойная связь образуется между 2 и 3 атомами углерода. |
1.1. Гидрирование
Гидрирование алкадиенов протекает в присутствии металлических катализаторов, при нагревании и под давлением.
При присоединении одной молекулы водорода к дивинилу образуется смесь продуктов (бутен-1 и бутен-2):
Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции.
| При комнатной и повышенной температуре основным продуктом реакции является 1,4-продукт (бутен-2). |
При полном гидрировании дивинила образуется бутан:
1.2. Галогенирование алкадиенов
Присоединение галогенов к алкадиенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкадиенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь. |
| Например, при взаимодействии бутадиена-1,3 с бромной водой преимущественно протекает 1,4 присоединение и образуется 1,4-дибромбутен-2: |
Побочным продуктом бромирования дивинила является 3,4-дибромбутен-1:
При полном бромировании дивинила образуется 1,2,3,4-тетрабромбутан:
1.3. Гидрогалогенирование алкадиенов
Алкадиены взаимодействуют с галогеноводородами. При присоединении хлороводорода к бутадиену-1,3 преимущественно образуется 1-хлорбутен-2:
3-Хлорбутен-1 образуется в небольшом количестве.
При присоединении полярных молекул к алкадиенам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к алкадиенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Полимеризация алкадиенов протекает преимущественно по 1,4-механизму, при этом образуется полимер с кратными связями, называемый каучуком. |
Продукт полимеризации дивинила (бутадиена) называется искусственным каучуком:
При полимеризации изопрена образуется природный (натуральный) каучук:
2. ОКИСЛЕНИЕ АЛКАДИЕНОВ
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на мягкое и жесткое.
2.1. Мягкое окисление алкадиенов
Мягкое окисление алкадиенов протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкадиена разрываются только π-связи и окисляются атомы углерода при двойных связях. При этом образуются четырехатомные спирты.
| Обесцвечивание алкадиенами водного раствора перманганата калия, как и в случае алкенов – качественная реакция на двойную связь. |






