ВТОРНИК, 01.02.22 г. 405, 308, 405, 208 ИНСТРУКЦИЯ ДЛЯ ТЕХ, КТО НЕ МОЖЕТ НАЙТИ СВОЮ ГРУППУ:
СПРАВА ЕСТЬ АРХИВ. В АРХИВЕ ПО-ПОРЯДКУ РАСПОЛОЖЕНЫ ДНИ НЕДЕЛИ. ТАМ ЖЕ ВИДНЫ ДАТЫ И НОМЕРА ГРУПП. ВЫБИРАЕТЕ ДЕНЬ СО СВОЕЙ ГРУППОЙ, И ОН ОТКРОЕТСЯ. УРОКИ ВЫЛОЖЕНЫ ПО РАСПИСАНИЮ. НА ОДНОЙ СТРАНИЦЕ ВЫЛОЖЕН ОДИН ДЕНЬ . ВНИМАНИЕ!!! На выполнение задания отводится 1 неделя. Моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
Критерии оценивания: Для получения отличной оценки обучающийся должен:- соблюдать отведенное время; разборчиво и правильно выполнить работу. Если работа будет прислана после указанного срока , оценка будет снижаться.
ГРУППА 405 ХИМИЯ 15
ТЕМА: Ионная связь, как связь между катионами и анионами за счет электростатического притяжения. Классификация ионов: по составу, знаку заряда, наличию гидратной оболочки
Просмотрите видео, прочитайте текст, Выполните необходимые( по вашему мнению) записи, приведите примеры ионных соединений.
Примером связи между атомами типичного металла и типичного неметалла можно назвать связь атомов в хлориде натрия (поваренная соль).
Составляющие ее элементы – натрий и хлор находятся в третьем периоде периодической системы.

Их относительные электроотрицательности соответственно равны у натрия – 1,1, у хлора – 2,8. На внешнем электронном слое у атома натрия находится один неспаренный s-электрон, у атома хлора из 7 внешних электронов один р-электрон неспаренный. За счет неспаренных электронов между атомами натрия и хлора может образоваться химическая связь. Из-за большой разницы электроотрицательности способ ее образования будет иной: за счет отдачи и присоединения электронов.
Отдав свой электрон атому хлора, атом натрия приобретает устойчивую оболочку инертного газа неона и превращается в положительно заряженную частицу – ион Na+. Атом хлора, приобретая электрон натрия, достраивает внешний электронный слой до устойчивой структуры инертного газа аргона – приобретает отрицательный заряд, превращаясь в ион Cl-.
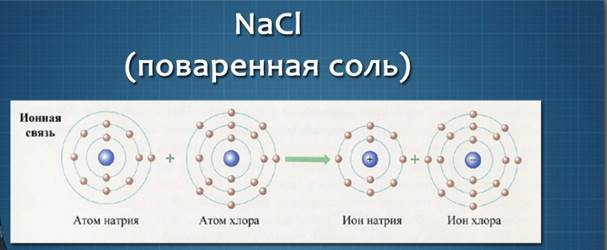
Ионы (от греческого ion – «идущий») – электрически заряженные частицы, которые образуются в результате потери или присоединения электронов атомами или группами атомов. Положительно заряженные ионы называют катионами, а отрицательно заряженные ионы – анионами.

Между ними возникают силы электростатического притяжения. За счет этих сил разноименно заряженные ионы связываются между собой, образуя ионное соединение, например, катионы натрия и хлорид-анионы образуют ионное соединение хлорид натрия.
Следует учитывать, что чем левее и ниже находится в периодической системе элемент, тем легче его атомы переходят в катионы (отдают электроны). А также, чем правее и выше расположен в периодической системе элемент, тем сильнее проявляют его атомы тенденцию переходить в анионы (принимать электроны).
При переходе нейтральных атомов в ионы размер и свойства их меняются.
Связь атомных частиц в ионном соединении объясняется не повышенной плотностью двухэлектронного облака (общей электронной пары), а силами электростатического притяжения ионов.
Химическая связь между ионами, осуществляемая силами их электростатического притяжения, называется ионной связью, а соединения, которые образовались вследствие притяжения ионов, называются ионными.
Ионы в природе существуют вокруг нас. Много разнообразных ионов в морской воде, прибрежный воздух также ионизирован и поэтому весьма полезен для здоровья. Ионы активны, результатом их взаимодействия часто бывают негативные явления: насыщение почв нитрат-анионом NО3-, разрушение мраморных изделий сульфат-анионом SO42-, кислотные дожди, приводящие к появлению в атмосфере катионов водорода, сульфат-анионов, нитрат-анионов, хлорид-анионов, загрязнение воды токсичными катионами металлов.
Важнейшими свойствами ионной связи являются ее прочность, ненасыщенность, ненаправленностъ.
Ионная связь весьма прочная.

Так, например, энергия разрыва связи К–Сl равна 426,1 кДж/моль, связи Li-F – 577,3 кДж/моль, Nа–Сl – 411,3 кДж/моль.
Ненасыщенность ее объясняется тем, что вокруг заряженной частицы – иона создается сферическое электромагнитное поле.
Притяжение противоположно заряженных ионов в сферическом поле происходит во всех направлениях, поэтому ионная связь является ненаправленной.
Мы познакомились с ковалентной (неполярной и полярной) и ионной химическими связями. Природа их одинакова – электрическая. Она связана с электрическим взаимодействием электронов и ядер атомов.
Соединения ионного и ковалентного полярного типа образованы атомами разных элементов с разной электроотрицательностью.
В этих соединение электронные пары, связывающие атомы, смещены к более электроотрицательному элементу. Наиболее полное смещение электронной пары или пар происходит в ионных соединениях. Экспериментальные исследования доказывают, что полного перехода электронов от атомов металлов к атомам неметаллов при образовании ионной связи не происходит.
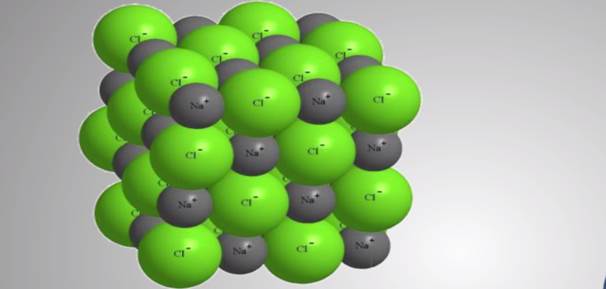
Поэтому в хлориде натрия (Na+Cl-) заряды его ионов не равны единице, а имеют в действительности заряды на ионах, равные +0,8 и –0,8. Реальные заряды на ионах называются эффективными зарядами.
Чем больше разность между значениями относительной электроотрицательности атомов, тем выше степень ионности их соединения. Связи с разностью относительной электроотрицательности больше 2,1 можно отнести к ионным.
Ионную связь можно рассматривать как предельный случай полярности ковалентной связи.
Чисто ионной связи практически не существует. Отсюда деление химической связи на типы – ковалентная и ионная также условно.
ГРУППА 308 БИОЛОГИЯ 21
ТЕМА: Охрана видов и популяций. |
Задание: прочитайте текст, составьте краткий план, подготовьте сообщение на тему : "Животные нашего края , занесенные в Красную книгу"или "Растения ЛНР, занесенные в красную книгу", можно выбрать тему самостоятельно, главное, чтобы она касалась защите видов животных или растений, находящихся в нашей местности.
Сохранение и восстановление численности популяций.
Перед человечеством встал вопрос о необходимости принятия охранных мер для сохранения и восстановления численности популяций редких и исчезающих видов растений и животных. Этот уровень природоохранной деятельности называют популяционно-видовым.
Для прекращения исчезновения видов растений и животных, увеличения их численности в природе в мировой практике применяют следующие меры:
изучают флору и фауну страны (региона, области), определяют редкие и исчезающие виды;
создают Красные книги;
создают генные банки;
ведут пропаганду охраны растительного и животного мира, вырабатывают и соблюдают правила и нормы поведения человека в природе, создают различные экологические программы.
Красные книги. В мире задействовано более 30 международных организаций, которые координируют исследования и практическую деятельность разных стран в охране и рациональном использовании природных ресурсов. Наиболее известна из них ЮНЕСКО (United Educational, Scientific and Cultural Organization) - Организация Объединенных наций по вопросам образования, науки и культуры. По инициативе ЮНЕСКО был создан МСОП - Международный союз охраны природы и природных ресурсов со штаб-квартирой в г. Глан (Швейцария). Именно МСОП стал организатором создания первой международной Красной книги (1965).
Первая Красная книга состояла из 5 томов с перечнем видов, которым угрожает исчезновение. Книга была издана на листах красного цвета (цвет предостережения). Затем Красные книги стали издавать в различных странах. В них названия видов были перечислены на белых страницах и лишь обложки книг красный цвет.
В 1985 и 1988 гг. вышли, соответственно, "Красная книга РСФСР: животные" (в нее было включено 247 видов) и "Красная книга РСФСР: растения" (533 вида). В настоящее время создаются Красные книги областей и республик Российской Федерации. В 2004 г. вышла в свет Красная книга Ярославской области (см. Приложения).
На основе списка видов, занесенных в Красные книги, осуществляют их охрану, запрещая сбор красиво цветущих редких растений, заготовку тех лекарственных трав, популяции которых ослаблены чрезмерной эксплуатацией (валериана лекарственная, цмин песчаный). Запрещают охоту на представителей редких видов: птиц (дрофу, журавля, лебедя, утку-мандаринку) и млекопитающих (выхухоля, уссурийского тигра, барса), отлов рыб некоторых видов (форели, стерляди, осетра), редких бабочек и жуков.
В результате охранной деятельности в России были восстановлены многие популяции бобра; более стабильными стали популяции серого кита, дальневосточного моржа, северного калана (морских млекопитающих). Благодаря усилиям работников Астраханского государственного заповедника значительно (в 8-10 раз) увеличилась площадь "лотосовых полей" - мест произрастания лотоса орехоносного или розового.
Успешной является охрана фауны лесов в Финляндии, где в последние годы удвоилось число медведей и росомах, в 8 раз стало больше рысей. Благодаря поддержке правительств Индии, Непала, Бангладеш почти втрое возросла численность индийского подвида тигра.
Вы уже знаете, что популяции разных видов в сообществе тесно взаимодействуют между собой, образуя биотические связи. В связи с этим охрана популяций отдельных видов часто является неэффективной. Так, для поддержания популяции уссурийского тигра необходимо восстановить популяции его кормовой базы - "жертв", то есть следует охранять не только отдельные популяции и виды, но и целые сообщества.
Искусственное разведение видов. Как правило, растения искусственно разводят в ботанических садах, а животных - в зоопарках или в заповедниках. Виды, сохраняемые таким образом, служат резервом и источником для их восстановления в природе. Например, в Дарвинском заповеднике, что на берегу Рыбинского водохранилища, разводят в вольерах боровую дичь (тетеревов, белых куропаток, глухарей), которую затем переселяют в естественные места обитания, в Хоперском заповеднике размножают выхухоль.
Существуют и специальные центры размножения особей редких видов - питомники, в которых выращивается молодь редких и исчезающих видов растений и животных, часть которой затем расселяют в подходящие места обитания. Широко известны Окский журавлиный питомник, Приокско-Террасный зубровый питомник. Так, благодаря сложнейшей работе сотрудников Приокско-Террасного питомника, организованного в 1959 г. среди первых в России, стало возможным восстановление популяции зубра в европейских лесах (в том числе и в Беловежской пуще) и на Кавказе. Зубры в настоящее время способны жить в дикой природе лишь при заповедном режиме.
Известны многочисленные рыбозаводы, где разводят молодь рыб разных видов, которую затем выпускают в реки и озера. Таким способом удается поддерживать численность популяций осетра, севрюги, стерляди.
В ряде европейских стран (Австрии, Франции, ФРГ, Швеции) в леса была переселена рысь, разведенная в неволе.
Генные банки - специально организованные хранилища, где в особых условиях хранятся половые клетки, зародыши и личинки животных, семена, споры и культуры тканей растений. Как видно, эти банки своеобразны: в них хранятся не деньги, а нечто более ценное - основа биоразнообразия планеты.
Самым первым генным банком в нашей стране можно считать созданную в 20-40-х гг. XX в. Н.И. Вавиловым коллекцию семян культурных растений. Она считается бесценным сокровищем. Коллекция хранилась в Ленинграде во Всесоюзном институте растениеводства (ВИР). Сотрудники института сберегли ее во время Второй мировой войны, пережив блокаду. Они голодали вместе с другими ленинградцами, но не тронули из коллекции ни зернышка. В настоящее время Национальное хранилище мировых растительных ресурсов расположено в Кубанской станции бывшего ВИР им. Н. И. Вавилова. Здесь, в подземных комнатахпри температуре + 4,5 С сохраняются более 350 тыс. образцов семян растений: множество древних, ныне исчезнувших сортов, диких видов - сородичей культурных растений, и, кроме того, все новое и лучшее, что было создано за последние годы селекционерами всего мира. Коллекция постоянно дополняется новыми образцами.
Для сохранения и восстановления исчезающих видов используется также метод низкотемпературной консервации клеток. Сейчас в мире существует много генных банков, использующих его. Например, в России есть банки спермы редких и промысловых видов рыб, крупного рогатого скота, редких пород домашних птиц, семян редких и исчезающих видов растений. В г. Пущино существует специальный научный центр при Российской Академии наук, где разрабатываются способы консервации и восстановления популяций редких и исчезающих видов животных.
Но для восстановления любого вида нужно создать довольно многочисленную популяцию, особи которой должны быть способны к самостоятельному размножению, расселению и адаптациям к условиям среды. То есть необходимо восстановить свойственную виду популяционную структуру. Естественно, что эта работа не только трудоемкая, продолжительная, но и требующая больших финансовых затрат. Не проще ли сохранять естественные популяции видов?
ГРУППА 405 БИОЛОГИЯ 11,12
ТЕМА:Обмен веществ.
ТЕМА: Фотосинтез.
ПРОЧИТАЙТЕ, РАССМОТРИТЕ РИСУНКИ, СОЗДАЙТЕ КРАТКИЙ КОНСПЕКТ,МОЖНО ЧЕРТИТЬ СХЕМЫ,ГДЕ ЭТО НАДО.
Обязательным условием существования любого организма является постоянный приток питательных веществ и постоянное выделение конечных продуктов химических реакций, происходящих в клетках. Клетка постоянно находится в движении – цитоплазма перемещается, увлекая за собой органоиды и включения, активно работают рибосомы и митохондрии, совершается множество химических превращений. Все живые организмы, существующие на Земле, представляют собой открытые системы, характеризующиеся способностью активно обмениваться с окружающей средой веществами и энергией. Из окружающей среды в клетку поступают различные вещества, а из клетки в окружающую среду удаляются ненужные продукты обмена – происходит обмен веществ, или метаболизм (Рис. 1).

Рис. 1. Обмен веществ клетки с окружающей средой
Питательные вещества используются организмами в качестве источника атомов химических элементов (прежде всего атомов углерода), из которых строятся либо обновляются все структуры. В организм, кроме питательных веществ, поступают также вода, кислород, минеральные соли.
Поступившие в клетки органические вещества (или синтезированные в ходе фотосинтеза) расщепляются на строительные блоки – мономеры и направляются во все клетки организма (Рис. 2). Часть молекул этих веществ расходуется на синтез специфических органических веществ, присущих данному организму. В клетках синтезируются белки, липиды, углеводы, нуклеиновые кислоты и другие вещества, которые выполняют различные функции (строительную, каталитическую, регуляторную, защитную и так далее).
Другая часть низкомолекулярных органических соединений, поступивших в клетки, идет на образование АТФ, в молекулах которой заключена энергия, предназначенная непосредственно для выполнения работы.

Рис. 2. Распределение органических веществ
Энергия необходима для синтеза всех специфических веществ организма, поддержания его высокоупорядоченной организации, активного транспорта веществ внутри клеток, из одних клеток в другие, из одной части организма в другую, для передачи нервных импульсов, передвижения организмов, поддержания постоянной температуры тела (у птиц и млекопитающих) и для других целей.
Обмен веществ (метаболизм) – совокупность биохимических реакций, протекающих в клетке и обеспечивающих процессы ее жизнедеятельности.
В ходе превращения веществ в клетках образуются конечные продукты обмена, которые могут быть токсичными для организма и выводятся из него (например, аммиак). Таким образом, все живые организмы постоянно потребляют из окружающей среды определенные вещества, преобразуют их и выделяют в среду конечные продукты.
В зависимости от общей направленности процессов выделяют катаболизм и анаболизм.
Анаболизм (ассимиляция) – совокупность химических процессов, направленных на образование и обновление структурных частей клеток, этот процесс имеет второе название – пластический обмен.
Фотосинтез: 6Н2О + 6СО2 → С6Н12О6 + 6СО2 ↑
Сюда можно отнести, например, фиксацию азота и биосинтез белка, синтез углеводов из углекислого газа и воды в ходе фотосинтеза, синтез полисахаридов, липидов, нуклеотидов, ДНК, РНК и других веществ. Анаболизм является созидательным этапом обмена веществ, он всегда осуществляется с потреблением энергии и с участием ферментов.
Катаболизм (диссимиляция) – совокупность реакций, в которых происходит распад крупных органических молекул до простых соединений с одновременным высвобождением энергии.
Катаболизм обеспечивает энергией все процессы, протекающие в клетке, и имеет второе название – энергетический обмен.
Дыхание: С6Н12О6 + 6СО2 → 6Н2О + 6СО2 + АТФ
При разрыве химических связей молекул органические соединения энергии высвобождаются и запасаются главным образом в виде молекул аденозинтрифосфорной кислоты – АТФ, универсального источника энергии у всех живых организмов (Рис. 3).

Рис. 3. Строение молекулы АТФ
По своей химической природе АТФ является мононуклеотидом и состоит из азотистого основания аденина, углевода рибозы и трех остатков фосфорной кислоты, соединенных между собой макроэргическими связями. Выделение энергии в клетке происходит при отделении одного из фосфорных остатков от молекулы АТФ, разрыв этой связи высвобождает 7,3 килокалории, тогда как при разрыве химических связей других соединений энергии выделяется в три-четыре раза меньше. При этом образуется молекула аденозиндифосфата – АДФ, с двумя фосфорными остатками. Она легко может восстановиться до АТФ, присоединив один остаток фосфорной кислоты или отдать еще один фосфорный остаток и превратиться в аденозинмонофосфат – АМФ (Рис. 4).

Рис. 4. Выработка энергии в клетке
Переход АТФ в АДФ и обратно – это основной механизм выработки энергии в клетке. Отщепление от АТФ и АДФ фосфорного остатка приводит к выделению энергии, а присоединение к АМФ и АДФ фосфорного остатка приводит к накоплению энергии.
ТЕМА:ФОТОСИНТЕЗ.
Фотосинтез – это процесс образования органических веществ в зелёных растениях. Фотосинтез создал всю массу растений на Земле и обогатил атмосферу кислородом.
КАК ПИТАЕТСЯ РАСТЕНИЕ?
Раньше люди были уверены, что все вещества для своего питания растения берут из почвы. Но один опыт показал, что это не так.
В горшок с землёй было посажено дерево. При этом измерили массу и земли, и дерева. Когда через несколько лет снова взвесили то и другое, оказалось, что масса земли уменьшилась всего на несколько граммов, а масса растения увеличилась на много килограмм.
В почву вносили только воду. Откуда же взялись эти килограммы растительной массы?
Из воздуха. Все органические вещества растений созданы из углекислого газа атмосферы и почвенной воды.
ЭНЕРГИЯ
Животные и человек питаются растениями, чтобы получить энергию для жизни. Эта энергия содержится в химических связях органических веществ. Откуда она там?
Известно, что растение не может нормально расти без света. Свет и является энергией, с помощью которой растение строит органические вещества своего тела.
Не важно какой это свет, солнечный или электрический. Любой луч света несёт энергию, которая становится энергией химический связей и как клей удерживает атомы в больших молекулах органических веществ.
ГДЕ ИДЁТ ФОТОСИНТЕЗ
Фотосинтез проходит только в зелёных частях растений, а точнее, в особых органах растительных клеток – хлоропластах.
Хлоропласты являются разновидностью пластид. Они всегда зелёные, т. к. содержат вещество зелёного цвета – хлорофилл.
Хлоропласт отделён от остального объёма клетки мембраной и имеет вид зёрнышка. Внутреннее пространство хлоропласта называется стромой. В ней и начинаются процессы фотосинтеза.
Хлоропласты являются как бы фабрикой, на которую поступает сырьё:
- углекислый газ (формула – СО₂);
- вода (Н₂О).
Вода поступает из корней, а углекислый газ – из атмосферы через особые отверстия в листьях-устьица. Свет является энергией для работы фабрики, а полученные органические вещества – продукцией.
Сначала производятся углеводы (глюкоза), но впоследствии из них образуется множество веществ разнообразных запахов и вкусов, которые так любят животные и люди.
Из хлоропластов полученные вещества транспортируются в разные органы растения, где откладываются в запас, либо используются для процессов жизнедеятельности.
РЕАКЦИЯ ФОТОСИНТЕЗА
В общем виде уравнение фотосинтеза выглядит так:
СО₂(углекислый газ) + Н₂О(вода) = органические вещества(глюкоза) + О₂ (кислород)
Зелёные растения входят в группу автотрофов (в переводе – «сам питаюсь») – организмов, которым для получения энергии не нужны другие организмы.
Основная функция фотосинтеза – создание органических веществ, из которых строится тело растений.
Выделение кислорода – побочный эффект процесса.
ЗНАЧЕНИЕ ФОТОСИНТЕЗА
Роль фотосинтеза в природе чрезвычайно велика. Благодаря ему создан весь растительный мир и озоновый экран нашей планеты.
Благодаря фотосинтезу растения:
- являются источником кислорода для атмосферы;
- переводят энергию солнца в доступную для животных и человека форму.
Жизнь на Земле стала возможной при накоплении достаточного количества кислорода в атмосфере. Ни человек, ни животные не смогли бы жить в те далёкие времена, когда его не было, или было мало.
КАКАЯ НАУКА ИЗУЧАЕТ ПРОЦЕСС ФОТОСИНТЕЗА
Фотосинтез изучают разные науки, но больше всего ботаника и физиология растений.
Ботаника – это наука о растениях и, поэтому изучает его как важный жизненный процесс растений.
Наиболее подробно изучает фотосинтез физиология растений. Учёные-физиологи определили, что этот процесс сложный и имеет стадии:
- световую;
- темновую.
Это значит, что фотосинтез начинается на свету, но заканчивается в темноте.
ЧТО МЫ УЗНАЛИ?
Изучив данную тему по биологии 5 класса, можно объяснить кратко и понятно фотосинтез как процесс образования в растениях органических веществ из неорганических (СО₂ и Н₂О). Его особенности: проходит в зелёных пластидах (хлоропластах), сопровождается выделением кислорода, осуществляется под действием света.
Пользуясь презентацией, выберите только ту информацию, которая раскрывает понятие "Ангидрид" и всё, что связано с карбоновыми кислотами.
ТЕМА:Ангидриды карбоновых кислот как аналоги кислотных оксидов. Кислоты органические и неорганические. Кислоты в свете теории электролитической диссоциации. Кислоты в свете протолитической теории. Классификация органических и неорганических кислот.
HNO3 ↔ H+ + NO3—
CH3COOH↔ H+ +CH3COO—
Классификация кислот
Кислоты прежде всего классифицируют на неорганические и органические (карбоновые). Слабые кислотные свойства проявляют такие органические соединения как спирты и фенолы. Неорганические и карбоновые кислоты, в свою очередь, имеют свои собственные классификации. Так, все неорганические кислоты можно классифицировать:
- по числу атомов водорода, способных к отщеплению в водном растворе (одноосновные –HCl, HNO2, двухосновные –H2SO4, H2SiO3, трехосновные –H3PO4)
- по составу кислоты (бескислородсодержащие – HI, HF, H2S и кислородсодержащие – HNO3, H2CO3)
Карбоновые кислоты классифицируют:
- по числу карбоксильных групп (одноосновные – HCOOH, CH3COOH и двухосновные –H2C2O4)
Физические свойства кислот
При н.у. большинство неорганических кислот существуют в жидком состоянии, некоторые – в твёрдом состоянии (H3PO4, H3BO3).
Органические кислоты с числом атомов углерода до 3 представляют собой легкоподвижные бесцветные жидкости с характерным резким запахом; кислоты с 4-9 атомами углерода — маслянистые жидкости с неприятным запахом, а кислоты с большим количеством атомов углерода— твёрдые вещества, нерастворимые в воде.
Строение карбоксильной группы
Рис. 1 Строение карбоксильной группы
Получение кислот
Неорганические и органические кислоты получают разными способами. Так, неорганические кислоты можно получить:
- по реакции кислотных оксидов с водой
SO3 + H2O = H2SO4
- по реакции соединения неметаллов с водородом
H2 + S ↔ H2S
- по реакции обмена между солями и другими кислотами
K2SiO3 + 2HCl → H2SiO3↓ + 2KCl
Органические кислоты получают путем:
- окисления альдегидов и первичных спиртов (в качестве окислителей выступают KMnO4 и K2Cr2O7)
R – CH2 –OH → R –C(O)H → R-COOH,
где R – углеводородный радикал.
Химические свойства кислот
К общим химическим свойствам и органических и неорганических кислот относят:
— способность изменять окраску индикаторов, например, лакмус при попадании в раствор кислоты приобретает красную окраску (это обусловлено диссоциацией кислот);
— взаимодействие с активными металлами
2RCOOH + Mg = (RCOO)2Mg + H2↑
Fe + H2SO4(р—р) = FeSO4 + H2↑
— взаимодействие с основными и амфотерными оксидами
2RCOOH + CaO = (RCOO)2Ca + H2O
6RCOOH + Al2O3 = 2(RCOO)3Al + 3H2O
2HCl + FeO = FeCl2 + H2O
6HNO3 + Al2O3 = 2Al(NO3)3 + 3H2O
— взаимодействие с основаниями
RCOOH + NaOH = RCOONa + H2O
H2SO4 + 2NaOH = Na2SO4 + H2O
— взаимодействие с солями слабых кислот
RCOOH + NaHCO3 = RCOONa + H2O + CO2↑
CH3COONa + HCl = CH3COOH + NaCl
Специфические свойства неорганических кислот
К специфическим свойствам неорганических кислот относят окислительно-восстановительные реакции, связанные со свойствами анионов кислот:
H2SO3 + Cl2 + H2O = H2SO4 + 2HCl
Pb + 4HNO3(конц) = Pb(NO3)2 + 2NO2 + 2H2O
Специфические свойства органических кислот
К специфическим свойствам органических кислот относят образование функциональных производных путем замещения гидроксильной группы (1, 2, 3, 4), а также галогенирование (5), восстановление (6) и декарбоксилирование (7).
R –C(O)-OH + PCl5 = R –C(O)-Cl (хлорангидрид) + POCl3 + HCl (1)
R –C(O)-OH + H-O-C(O)-R = R – C(O) – O – C(O) – R (ангидрид) (2)
CH3COOH + CH3-CH2-OH = CH3-C(O)-O-C2H5 (этилацетат (сложный эфир)) + H2O (3)
CH3COOH + СH3 –NH2 = CH3-C(O)-NH-CH3 (амид) + H2O (4)
CH3 –CH2-COOH + Br2 = CH3 – CHBr –COOH + HBr (катализатор – Pкр) (5)
R-COOH + LiAlH4 (водный раствор, подкисленный HCl) = R-CH2-OH +AlCl3 + LiCl (6)
CH2=CH-CH2-COOH = CO2↑ + CH2=CH-CH3 (7)
Примеры решения задач
| Задание | Напишите уравнения реакций по следующей схеме: |
| Решение | 1) ЗС2Н5ОН + 4Na2CrO4 + 7NaOH + 4H2O = 3CH3COONa + 4Na3[Cr(OH)6] 2) СН3СООС2Н5 + NaOH = CH3COONa + С2Н5ОН 3) 5С2Н5ОН + 4KMnO4 + 6H2SO4 = 5СН3СООН + 2K2SO4 +4MnSO4 + 11H2O 4) CH3COONa + C2H5I = СН3СООС2Н5 + Nal 5) CH3COONa + HCl = СН3СООН + NaCl 6) СН3СООН + С2Н5ОН |
| Задание | Определите массу пирита (FeS2), необходимую для получения такого количества SO3, чтобы при растворении последнего в растворе серной кислоты с массовой долей 91 % массой 500 г получить олеум с массовой долей 12,5 %. |
| Решение | Запишем уравнения реакций: 1) 4FeS2+11O2 = 2Fe2O3+8SO2 2) 2SO2+O2 = 2SO3 3) SO3+H2O = H2SO4 Найдем молярные массы веществ, необходимых для дальнейших расчетов: M(H2O) = 18 г/моль; M(SO3) = 80 г/моль; M(H2SO4) = 98 г/моль; M(FeS2) = 120 г/моль Масса воды в 100 г раствора серной кислоты (ω = 91 %) составит: 100 — 91 = 9,0 г v(H2O)=9/18 = 0,5 моль Из уравнения реакции (3) следует, что 1 моль SO3 → 1 моль H2O → 1 моль H2SO4, т.е. 0,5 моль H2O прореагирует с 0,5 моль SO3 и образуется 0,5 моль H2SO4 Рассчитаем массу SO3 m(SO3)= 0,5•80 = 40 г Рассчитаем массу H2SO4 m(H2SO4)= 0,5•98 = 49 г Тогда общая масса H2SO4 составит m (H2SO4)sum =91 + 49 = 140 г Для получения олеума (ω = = 12,5 %) на 140 г H2SO4 потребуется SO3: m(SO3) = 12,5•140/87,5 = 20 г Таким образом, всего SO3 расходуется m(SO3)sum = (40 + 20) = 60 г v(SO3)sum =60/80 = 0,75 моль Из уравнений реакций (2, 3) следует, что на образование 0,75 моль SO3 расходуется v(FeS2)= 0,75/2 = 0,375 моль m(FeS2)=0,375•120 = 45 г |
| Ответ | Масса пирита 45 г. |


